7.2: Chymotrypsin
Úvod
Chymotrypsin je jedním z nejvíce studovaných enzymů díky své dvoufázové kinetice: pre-steady-state a steady state. Studium těchto dvou kinetické států dává důkaz o „Ping-Pong“ mechanismus, tvorba kovalentní komplexy, což vede k kovalentní hydrolýza reakce a rychlost katalyzované reakce. Syntéza chymotrypsinu se vyskytuje primárně v pankreatu. Místo aktivní formy se však vyrábí jako neaktivní zymogen zvaný chymotrypsinogen, aby se zabránilo jeho proteázové aktivitě v trávení pankreatu. Po sekreci do lumen tenkého střeva se převede na svou aktivní formu jiným enzymem zvaným trypsin. Tato závislost jiného enzymu na aktivaci proteázy je běžným způsobem, jak tělo zabránit trávení orgánů a dalším škodlivým enzymatickým vedlejším účinkům.
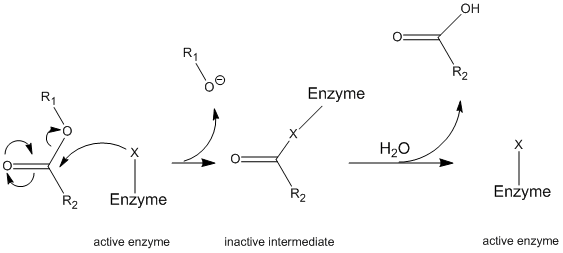
Chymotrypsin působí prostřednictvím obecný mechanismus, známý jako ping-pong mechanismus (Obrázek \(\PageIndex{1}\)), přičemž enzym reaguje se substrátem tvoří enzym zprostředkující. Tento meziprodukt má jiné vlastnosti než počáteční enzym, takže pro regeneraci počáteční enzymatické aktivity musí reagovat se sekundárním substrátem. Tento proces je znázorněn níže:

přesněji, chymotrypsin působí prostřednictvím určitého typu ping-pong mechanismus nazývá kovalentní hydrolýzy. To znamená, že enzym nejprve vytvoří kovalentní vazbu s cílovým substrátem a vytlačuje stabilnější část do roztoku. Tento komplex enzym-substrát se nazývá enzymový meziprodukt. Meziprodukt pak reaguje s vodou, která vytlačuje zbývající část počátečního substrátu a reformuje počáteční enzym.
Chymotrypsin, stejně jako většina enzymů, je specifický v typech substrátů, se kterými reaguje. Jako proteáza štěpí polypeptidy a její inherentní specificita jí umožňuje působit pouze na karboxy-terminál aromatických zbytků. Jedná se o poněkud komplikovaný mechanismus a je nejlépe vysvětlen v řadě kroků.
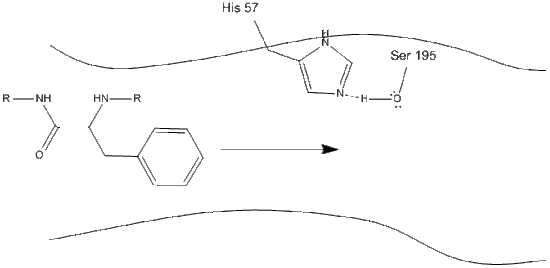
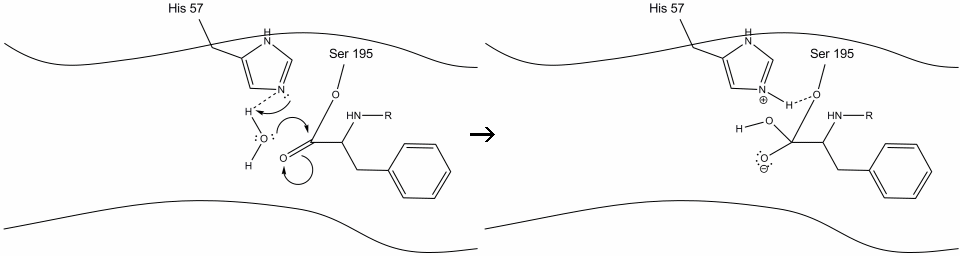
1. Cíl vstupuje do aktivního místa chymotrypsinu, a je držen tam hydrofobní interakce mezi vystavené non-polární skupiny enzymu, zbytků a non-polární aromatické postranní řetězce substrátu. Je důležité si uvědomit vodíkovou vazbu mezi dusíkem Schiff na histidinu-57 a kyslíkovým postranním řetězcem serinu-195.
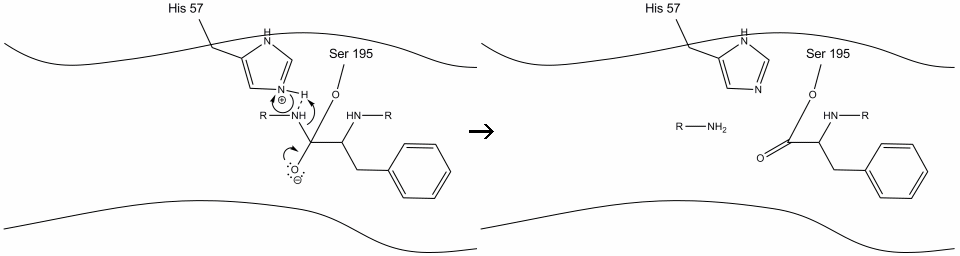
2. Podporovaný histidin-serin vodíkové vazby, hydroxylové skupiny na serinové-195 provádí nucleophilic útok na uhlíku karbonylové aromatických aminokyselin, zatímco současně přenos hydroxylové vodíku na histidin Schiff dusíku. Tento útok tlačí pi karbonylové elektrony na kyslíku karbonylové, tvořící krátký-žil intermediate se skládá z c-terminální uhlík se čtyřmi jednoduchými vazbami: kyslíkový anion, beta-uhlík aromatických aminokyselin, n-konci následné aminokyselin substrátu bílkovin, a serin-195 side-chain kyslíku.
.gif?revision=1&size=bestfit&width=720&height=192)
3. Tento meziprodukt je krátkodobý, protože oxyanionové elektrony reformují vazbu pi s C-koncem aromatické aminokyseliny. Pouto mezi karboxy-konci aromatických aminokyselin a na n-konci následné zbytky se štěpí, a jeho elektrony jsou použity k extrakci vodíku z protonované Schiffovy dusíku na histidin-57. Vazby mezi karbonylovým uhlíkem a kyslíkem serin-195 zůstávají v esterové konfiguraci. Tomu se říká meziprodukt acyl-enzymu. C-koncová strana polypeptidu se nyní může volně disociovat z aktivního místa enzymu.
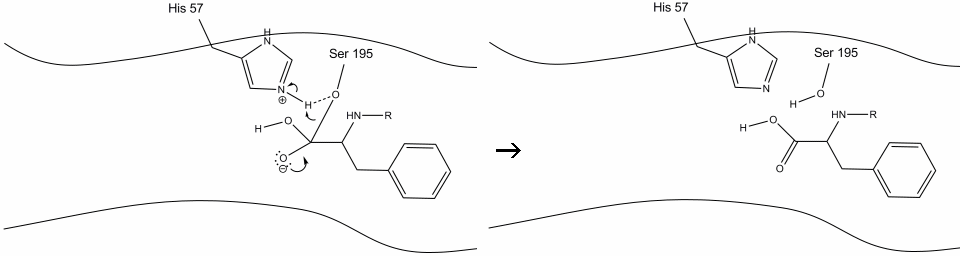
4. Molekuly vody jsou nyní schopny vstoupit a vázat se na aktivní místo pomocí vodíkové vazby mezi vodíkovými atomy vody a dusíkem histidin-57 Schiff.
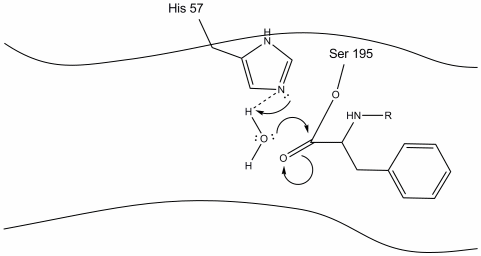
5. Voda kyslík teď dělá nucleophilic útok na uhlíku karbonylové z acyl-enzymový meziprodukt, tlačí karbonylové je pí elektronů na uhlíku karbonylové jako histidin-57 výtažky jeden proton z vody. To vytváří další kvartérní uhlík kovalentně vázaný se serinem, hydroxylem, oxyanionem a aromatickou aminokyselinou. Proton na nedávno protonované histidin-57 je nyní schopen vytvořit vodíkovou vazbu s kyslíkem serinu.
6. Na oxyanion elektrony reformy karbonylové pí vazba, štěpit vazby mezi karbonylové uhlíku a hydroxyl serinu. Elektrony v této vazbě používají serinový kyslík k deprotonaci dusíku histidine Schiff a reformě původního enzymu. Substrát již nemá afinitu k aktivnímu místu a brzy se oddělí od komplexu.
Leave a Reply