8.5: Receptor tyrozinkináz (RTKs)
Receptor tyrosin kinázy zprostředkovávají reakce na velký počet signálů, včetně peptidové hormony jako insulin a růstové faktory, jako epidermální růstový faktor. Jako GPCRs, receptor tyrosin kináz vázat signál, pak předat vzkaz prostřednictvím řady intracelulárních molekul, z nichž poslední, působí na cílové proteiny pro změnu stavu buňky.
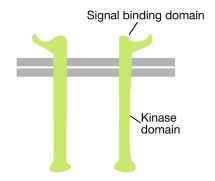
Jak už název napovídá, receptor tyrosin kinázy je buňky povrchu receptor, který má také tyrosin kinázy. Signální vazebná doména receptorové tyrosinkinázy je na buněčném povrchu, zatímco enzymatická aktivita tyrosinkinázy spočívá v cytoplazmatické části proteinu (viz obrázek výše). Transmembránová alfa šroubovice spojuje tyto dvě oblasti receptoru.
Co se stane, když se signální molekuly vážou na receptorové tyrosinkinázy?
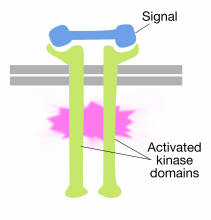
Vazba signální molekuly na extracelulární domény receptoru tyrosinkinázy molekuly způsobuje dvě molekuly receptoru na dimerizovat (sejít a spojit). To přivádí cytoplazmatické ocasy receptorů blízko sebe a způsobuje zapnutí aktivity tyrosinkinázy těchto ocasů. Aktivované ocasy se pak navzájem fosforylují na několika zbytcích tyrosinu. Toto se nazývá autofosforylace.
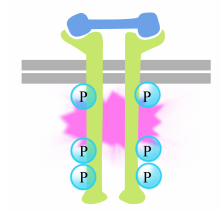
fosforylace tyrosines na receptor ocasy spouští shromáždění intracelulární signalizační komplex na ocasy. Nově fosforylované tyrosiny slouží jako vazebná místa pro signální proteiny, které pak předávají zprávu dalším proteinům. Důležitý protein, který je následně aktivován pomocí signalizační komplexy na receptor tyrosin kinázy se nazývá Ras.
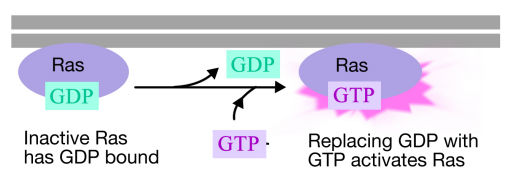
Ras protein je monomerní guanin nukleotid vázající protein, který je spojen s cytosolickou povrchu plazmatické membrány (ve skutečnosti, to je hodně jako alfa podjednotku trimerního G-proteiny). Stejně jako alfa podjednotka g – proteinu je Ras aktivní, když je na něj navázán GTP, a neaktivní, když je na něj navázán GDP.Stejně jako alfa podjednotka může Ras hydrolyzovat GTP na HDP.
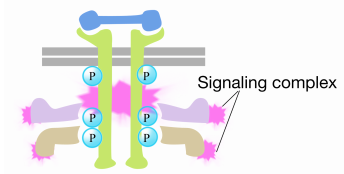
Když signál dorazí na receptor tyrosin kinázy receptoru monomery se spojily a fosforylují druhých tyrosines, což vyvolalo shromáždění komplex bílkovin v cytoplazmatické ocas receptoru. Jeden z proteinů v tomto komplexu interaguje s Ras a stimuluje výměnu HDP vázaného na neaktivní Ras za GTP. Tím se aktivuje Ras.
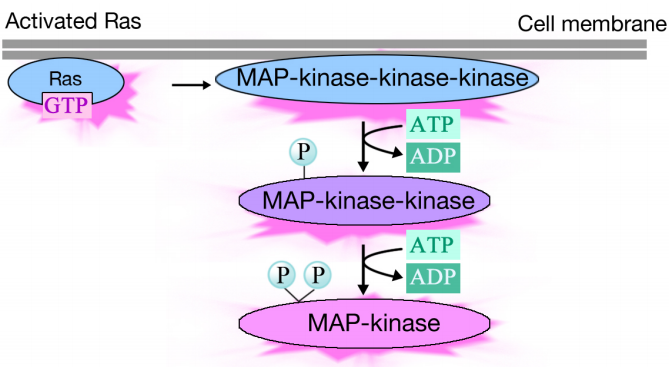
Aktivovaný Ras spouští fosforylaci kaskáda tří proteinových kináz, které relé a distribuovat signál. Tyto proteinkinázy jsou členy skupiny zvané MAP kinázy (Mitogenem aktivované proteinkinázy). Konečná kináza v této kaskádě fosforyluje různé cílové proteiny, včetně enzymů a transkripčních aktivátorů, které regulují genovou expresi.
fosforylace různých enzymů mohou ovlivnit jejich činnosti, a vyrazil nové chemické reakce v buňce, zatímco fosforylace transkripční aktivátory mohou změnit geny, které jsou vyjádřeny. Kombinovaný účinek změn genové exprese a proteinové aktivity mění fyziologický stav buňky.
při sledování dráhy přenosu signálu zprostředkované RTKs je opět možné rozeznat stejný základní vzorec událostí: signál je vázán na extracelulární domény receptoru tyrozinkinázy, což vede receptorů dimerizace a autophosphorylation z cytosolu ocasy, tedy předávání zpráv do interiéru buňky.
zpráva je předána prostřednictvím signalizačního komplexu Ras, který pak stimuluje řadu kináz. Terminální kináza v kaskádě působí na cílové proteiny a přináší změny v proteinových aktivitách a genové expresi.
popis výše poskytují velmi jednoduchý náčrt některých hlavních tříd receptorů a vypořádat se především s mechanistické údaje o kroky, které signály přijímané od různých typů receptorů, které přinese změny v buňkách. Hlavní lekcí s sebou domů je základní podobnost různých cest.
Dalším bodem mít na paměti, je, že zatímco jsme se dívali na každou jednotlivou cestu v izolaci, buňky, v daném okamžiku přijímá více signálů, že vydali celou řadu různých odpovědí najednou. Cesty popsané výše vykazují značný stupeň „cross-talk“ a reakce na daný signál je ovlivněn dalšími signály, že buňka přijme současně. Množství různých receptorů, signálů a jejich kombinací je prostředkem, kterým jsou buňky schopny reagovat na obrovskou škálu různých okolností.
Přispěvatelé
-
Dr. Kevin Ahern a Dr. Indira Rajagopal (Oregon State University)
Leave a Reply