Halobetasol Propionát Mast
Léková Forma: mast
Lékařsky přezkoumány Drugs.com. Naposledy aktualizován dne 1. Března 2020.
- Přehled
- Nežádoucí Účinky
- Dávkování
- Odborné
- Interakce
- Další
Halobetasol Propionát Mast Popis
Halobetasol Propionát Mast, 0.05% obsahuje halobetasol propionát, syntetický kortikosteroid pro lokální dermatologické použití. Kortikosteroidy představují třídu primárně syntetických steroidů používaných lokálně jako protizánětlivé a antipruritické činidlo.
Chemicky halobetasol propionát je 21-chlor-6α, 9-difluoro-11beta, 17-dihydroxy-16β-methylpregna-1, 4-dien-3-20-dion, 17-propionátu, C25H31ClF2O5. To má následující strukturní vzorec:
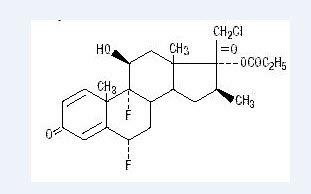
Halobetasol propionát má molekulovou hmotnost 485. Je to bílý krystalický prášek nerozpustný ve vodě.
jeden gram masti Halobetasol propionátu obsahuje 0.5 mg/g halobetasol propionátu v základně z hliníku hořečnatý, včelí vosk, pentaerythritolu kokosového oleje, vazelínu, propylen glykol, sorbitan sesquioleát, a-stearyl-citrát.
Halobetasol Propionát Mast – Klinická Farmakologie
stejně Jako ostatní lokální kortikosteroidy, halobetasol propionát má protizánětlivé, antipruritické a vazokonstrikční akce. Mechanismus protizánětlivé aktivity topických kortikosteroidů je obecně nejasný. Předpokládá se však, že kortikosteroidy působí indukcí inhibičních proteinů fosfolipázy A2, souhrnně nazývaných lipokortiny. Předpokládá se, že tyto bílkoviny kontrolují biosyntézu účinných mediátorů zánětu, jako jsou prostaglandiny a leukotrieny, inhibicí uvolňování jejich společným prekurzorem kyseliny arachidonové. Kyselina arachidonová se uvolňuje z membránových fosfolipidů fosfolipázou A2.
Farmakokinetika
rozsah perkutánní absorpce lokálních kortikosteroidů je dána mnoha faktorech, včetně vozidla a integrity epidermální bariéry. Okluzivní obvazy s hydrokortizonem po dobu až 24 hodin nebyly prokázány pro zvýšení penetrace; okluze hydrokortizonu po dobu 96 hodin však výrazně zvyšuje penetraci. Lokální kortikosteroidy mohou být absorbovány z normální neporušené kůže. Zánět a / nebo jiné chorobné procesy v kůži mohou zvýšit perkutánní absorpci.
Lidské a zvířecí studie ukazují, že méně než 6% aplikované dávky halobetasol propionát vstupuje do oběhu do 96 hodin po topické podání Halobetasol Propionát Mast.
studie provedené s mastí Halobetasol propionátu naznačují, že je v super vysokém rozmezí účinnosti ve srovnání s jinými topickými kortikosteroidy.
Indikace a Využití pro Halobetasol Propionát Mast
Halobetasol Propionát Mast je super-vysokou účinnost kortikosteroidy indikován pro zmírnění zánětlivých a svědivých projevů kortikosteroidy-citlivé dermatózy. Léčba po dvou po sobě jdoucích týdnech se nedoporučuje a celková dávka by neměla překročit 50 g / týden kvůli potenciálu léku potlačit osu hypotalamus-hypofýza-nadledviny (HPA). Použití u dětí mladších 12 let se nedoporučuje.
stejně jako u jiných vysoce aktivních kortikosteroidů by měla být léčba po dosažení kontroly přerušena. Pokud během 2 týdnů nedojde ke zlepšení, může být nutné přehodnotit diagnózu.
Kontraindikace
Halobetasol Propionát Mast je kontraindikován u pacientů s anamnézou přecitlivělosti na některou ze složek přípravku.
bezpečnostní Opatření
Obecné
Systémová absorpce lokálních kortikosteroidů může produkovat reverzibilní hypotalamus – hypofýza-nadledviny (HPA) osy, potlačení s potenciálem pro glukokortikosteroid insuficience po vysazení léčby. Projevy Cushingova syndromu, hyperglykémie a glukosurie mohou být u některých pacientů také produkovány systémovou absorpcí topických kortikosteroidů během léčby.
pacienti, kteří aplikují topický steroid na velkou plochu povrchu nebo na oblasti pod okluzí, by měli být pravidelně vyšetřováni na důkaz suprese osy HPA. To lze provést pomocí ACTH stimulace, a. m.plazmatický kortizol a testy volného kortizolu v moči. Pacienti užívající super silné kortikosteroidy by neměli být léčeni po dobu delší než 2 týdny najednou a kvůli zvýšenému riziku suprese HPA by měly být léčeny pouze malé oblasti.
Halobetasol propionát mast produkoval potlačení osy HPA při použití v rozdělených dávkách 7 gramů denně po dobu jednoho týdne u pacientů s psoriázou. Tyto účinky byly reverzibilní po přerušení léčby.
Pokud HPA osy potlačení je třeba poznamenat, měl by být proveden pokus zrušit drog, snížit frekvenci aplikace, nebo nahradit méně účinnými kortikosteroidy. Obnovení funkce osy hPa je obecně okamžité po vysazení topických kortikosteroidů. Zřídka se mohou objevit příznaky a příznaky glukokortikosteroidní insuficience vyžadující doplňkové systémové kortikosteroidy. Informace o systémové suplementaci naleznete v části Informace o předepisování těchto přípravků.
Pediatričtí pacienti mohou být náchylnější k systémové toxicitě z ekvivalentních dávek kvůli jejich většímu poměru povrchu kůže k tělesné hmotnosti (viz opatření: pediatrické použití).
Pokud se objeví podráždění, mast Halobetasol propionátu by měla být přerušena a měla by být zahájena vhodná léčba. Alergické kontaktní dermatitidy kortikosteroidy je obvykle diagnostikována sledovat selhání léčit, než zmínku, klinické exacerbace jako s většinou lokální přípravky obsahující kortikosteroidy. Takové pozorování by mělo být potvrzeno vhodným diagnostickým testováním náplasti.
pokud jsou přítomny nebo se vyvíjejí souběžné kožní infekce, je třeba použít vhodné antimykotikum nebo antibakteriální činidlo. Pokud se příznivá odpověď neobjeví okamžitě, mělo by být použití masti Halobetasol propionátu přerušeno, dokud nebude infekce dostatečně kontrolována.
Halobetasol Propionát Mast by neměl být používán v léčbě rosacea nebo periorální dermatitidy, a to by neměl být používán na obličej, třísla, nebo v axillae.
Informace pro Pacienty
Pacienti používají lokální kortikosteroidy by měly zobrazit následující informace a instrukce:
- léky je třeba používat podle pokynů lékaře. Je určen pouze pro vnější použití. Zabraňte kontaktu s očima.
- lék by neměl být používán pro jiné poruchy, než pro které byl předepsán.
- ošetřené oblasti kůže by měly být ovázanou, jinak zakryty nebo zabalené tak, aby být okluzivní, pokud podle pokynů lékaře.
- pacienti by měli hlásit svému lékaři jakékoli známky lokálních nežádoucích účinků.\
Laboratorní Testy
následující testy mohou být užitečné při hodnocení pacientů pro HPA osy potlačení: ACTH-stimulační test; A. M. plazmatické hladiny kortizolu test, Močový volný kortizol test.
karcinogeneze, mutageneze, zhoršení Fertility
dlouhodobé studie na zvířatech nebyly provedeny k vyhodnocení kancerogenního potenciálu halobetasol-propionátu. Pozitivní účinky mutagenity byly pozorovány ve dvou testech genotoxicity. Halobetasol propionát byl pozitivní v mikronukleárním testu čínského křečka a v testu mutace genu pro myší lymfom in vitro.
Studie u potkanů po perorálním podání v dávkách až 50 mg/kg/den uvedeno žádné zhoršení fertility ani reprodukční výkonnosti.
V další zkoušky genotoxicity, halobetasol propionát nebyl nalezen genotoxický v Ames/Salmonella test, v sesterské výměny chromatid test v somatických buňkách Čínského křečka, v chromozomové aberace studie germinálních a somatických buňkách hlodavců a savců spot test k určení bodových mutací.
těhotenství
teratogenní účinky: u laboratorních zvířat bylo prokázáno, že kortikosteroidy jsou teratogenní, pokud jsou podávány systémově v relativně nízkých dávkách. Bylo prokázáno, že některé kortikosteroidy jsou teratogenní po dermální aplikaci u laboratorních zvířat.
Halobetasol propionátem ukázaly být teratogenní u SPF potkanů a činčil-typ králíky, pokud je podáván systémově během březosti v dávce 0,04-0,1 mg/kg u potkanů a 0,01 mg/kg u králíků. Tyto dávky jsou přibližně 13, 33 a 3krát vyšší než lokální dávka masti Halobetasol propionátu u člověka. Halobetasol propionát byl embryotoxický u králíků, ale ne u potkanů.
rozštěp patra byl pozorován jak u potkanů, tak u králíků. Omfalokéla byla pozorována u potkanů, ale ne u králíků.
neexistují adekvátní a dobře kontrolované studie teratogenního potenciálu halobetasol-propionátu u těhotných žen. Mast Halobetasol propionát by měl být používán během těhotenství pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
Kojící Matky
Systémově podávané kortikosteroidy se objevují v mateřském mléce a může potlačit růst, interferovat s endogenní produkce kortikosteroidů, nebo způsobit jiné nežádoucí účinky. Není známo, zda by topické podávání kortikosteroidů mohlo vést k dostatečné systémové absorpci k produkci detekovatelných množství v lidském mléce. Protože mnoho léků se vylučuje do lidského mateřského mléka, je třeba opatrnosti při Halobetasol Propionát Mast je podáván kojícím ženám.
pediatrické použití
bezpečnost a účinnost masti Halobetasol propionátu u dětských pacientů nebyla stanovena a použití u dětských pacientů mladších 12 let se nedoporučuje. Vzhledem k vyššímu poměru plochy povrchu kůže k tělesné hmotnosti jsou pediatričtí pacienti vystaveni většímu riziku suprese osy HPA a Cushingova syndromu, pokud jsou léčeni topickými kortikosteroidy. Proto jsou také vystaveni většímu riziku adrenální insuficience během nebo po ukončení léčby. Nežádoucí účinky včetně striae byly hlášeny při nevhodném použití lokálních kortikosteroidů u kojenců a dětí.u dětí užívajících topické kortikosteroidy byla hlášena suprese osy HPA, Cushingův syndrom, lineární retardace růstu, opožděný přírůstek hmotnosti a intrakraniální hypertenze. Projevy adrenální suprese u dětí zahrnují nízké hladiny kortizolu v plazmě a nepřítomnost odpovědi na stimulaci ACTH. Projevy intrakraniální hypertenze zahrnují vypouklé fontanely, bolesti hlavy a bilaterální papilém.
geriatrické použití
z 850 pacientů léčených mastí Halobetasol propionátu v klinických studiích bylo 21% 61 let a více a 6% 71 let a více. Žádné celkové rozdíly v bezpečnosti nebo účinnosti nebyly pozorovány mezi těmito pacienty a mladšími pacienty, a další hlášeny klinické zkušenosti nejsou zjištěny rozdíly v odpovědích mezi staršími a mladšími pacienty, ale větší citlivost některých starších jedinců nelze vyloučit.
nežádoucí účinky
v kontrolovaných klinických studiích zahrnovaly nejčastější nežádoucí účinky hlášené u masti Halobetasol propionátu bodání nebo pálení u 1,6% pacientů. Méně často hlášené nežádoucí účinky byly pustulace, erytém, kožní atrofie, leukoderma, akné, svědění, sekundární infekce, telangiektázie, kopřivka, suchá kůže, miliaria, parestézie a vyrážka.
následující další lokální nežádoucí účinky jsou hlášeny zřídka u lokálních kortikosteroidů a mohou se vyskytovat častěji u kortikosteroidů s vysokou účinností, jako je mast Halobetasol propionát. Tyto reakce jsou uvedeny v přibližně sestupném pořadí výskytu: folikulitidy, hypertrichózy, acneiform erupce, hypopigmentace, periorální dermatitida, alergická kontaktní dermatitida, sekundární infekce, strie a miliaria.
Chcete-li nahlásit podezření na nežádoucí účinky, kontaktujte Teligent Pharma, Inc. na 1-856-697-1441, nebo FDA na 1-800-FDA-1088 nebo www.fda.gov / medwatch.
Předávkování
Lokálně aplikované, Halobetasol Propionát Mast mohou být absorbovány v dostatečném množství produkovat systémové účinky (viz UPOZORNĚNÍ)h
Halobetasol Propionát Mast Dávkování a způsob Podání
Naneste tenkou vrstvu Halobetasol Propionát Mast na postiženou kůži jednou nebo dvakrát denně, podle pokynů lékaře, a vetřete jemně a úplně.
Halobetasol Propionátová mast je topický kortikosteroid s vysokou účinností; léčba by proto měla být omezena na dva týdny a neměla by se používat množství vyšší než 50 g/wk. Stejně jako u jiných kortikosteroidů by měla být léčba po dosažení kontroly přerušena. Pokud během 2 týdnů nedojde ke zlepšení, může být nutné přehodnotit diagnózu.
Halobetasol propionát mast by neměl být používán s okluzivními obvazy.
Jak je Halobetasol Propionát Mast Dodávané
Halobetasol Propionát Mast, 0.05% se dodává v následující velikosti trubek:
50 g (NDC 63739-998-67)
UKLÁDÁNÍ
Obchod Halobetasol Propionát Mast mezi 15°C a 30°C (59°F a 86°F).
výrobce:
Teligent Pharma, Inc.
Buena, NJ 08310
distribuováno:
McKesson Corporation
DBA Sky Packaging
4971 Southridge Blvd., Suite 101
Memphis, TN 38141
PI-073-00
C101430 Rev 02/2020
označení obalu.Hlavní zobrazovací PANEL 50 gram krabička
NDC 63739-998-67
Halobetasol propionát
mast, 0,05%
pouze pro lokální použití.
nepoužívat do očí.
Net Wt. 50 grams
Rx Only

| HALOBETASOL PROPIONATE Halobetasol Propionate Ointment |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – McKesson Corporation (140529962)
Registrant – Teligent Pharma, Inc. (011036910)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Teligent Pharma, Inc. | 011036910 | manufacture(63739-998) | |
Frequently asked questions
- Halobetasol vs. clobetasol – how do they compare?
- lze to použít pro jedovatý břečťan?
- lze jej použít na pokožku hlavy?
Více o halobetasol aktuální
- Nežádoucí Účinky
- Během Těhotenství nebo Kojení
- Dávkování Informací
- lékové Interakce
- Porovnat Alternativy
- Ceny & Kupóny
- 25 Recenze
- třídy Drog: topical steroids
Consumer resources
- Patient Information
- Halobetasol Topical application (Advanced Reading)
Professional resources
- Prescribing Information
- Halobetasol (FDA)
- Halobetasol Cream (FDA)
- Halobetasol Foam (FDA)
Other brands Ultravate, Lexette, Bryhali, Halonate
Related treatment guides
- Plaque Psoriasis
- Eczema
- Psoriasis
- Atopic Dermatitis
- Granuloma Annulare
- Dermatitis
Medical Disclaimer
Leave a Reply