Hranic, v Farmakologie
Úvod
Liposomy jsou typem nanocarrier, které byly široce zkoumány pro drogové účely doručování. Jsou složeny z fosfolipidových dvojvrstv, které obklopují zřetelný vodný prostor, což umožňuje zapouzdření hydrofilních i hydrofobních sloučenin (Metselaar and Storm, 2005). Liposomy jsou schopny stabilizovat terapeutické sloučeniny a překonat bariéry absorpce buněk a tkání (Ding et al., 2006; Hua a Wu, 2013). To jim umožňuje zlepšit cílení sloučenin na místa onemocnění a následně snížit akumulaci v necílových orgánech (Bakker-Woudenberg et al., 1994; Mastrobattista a kol., 1999; Hua, 2013; Hua a kol., 2015; Sercombe et al., 2015; Zununi Vahed et al., 2017). Tam jsou čtyři hlavní typy liposomů na základě jejich povrchové vlastnosti – konvenční liposomy, Pegylované lipozomy, ligand-cílené liposomy, a theranostic liposomy (Obrázek 1; Sercombe et al., 2015). Ligand-cílené liposomy poskytují potenciál pro site-specific dodávky léků do určitých tkáních nebo orgánech, které selektivně express cílené ligand (Willis a Forssen, 1998; Bendas, 2001; Sawant a Torchilin, 2012), vzhledem k tomu, že Pegylované lipozomy poradit stérické překážky pro zvýšení oběhu half-life systému doručování po systémovém podávání (Torchilin, 1994; Wang et al., 2015). Liposomy zahrnující kombinaci různých dodacích platforem mohou dále zlepšit dodávání zapouzdřených sloučenin v závislosti na způsobu podání a místě onemocnění.
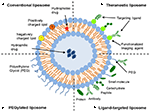
obrázek 1. Schematické znázornění různých typů liposomů drug delivery systems – (A) Konvenční liposom, (B) Pegylovaný liposom, (C) Ligand-cílené liposom, a (D) Theranostic liposom (Sercombe et al., 2015).
v Návaznosti na výrobní proces, lipozomy jsou charakterizovány, aby byla zajištěna homogenita celé řady parametrů, včetně drog zapouzdření, ligand-konjugace, lipidové složení, náboj, a morfologických vlastností (např. velikost, tvar a počet lamel) (Kuntsche et al., 2011). Tyto charakteristiky jsou důležité, protože mohou mít významný dopad na chování liposomů jak in vitro, tak in vivo (Sawant a Torchilin, 2012; Sercombe et al., 2015). Uznání a schválení liposomy o obranyschopnost organismu, včetně retikuloendoteliálního systému (RES) a adsorpce opsonins s následnou integraci na mononukleární fagocytární systém, jsou hlavními přispěvateli do clearance a odbourávání liposomy (Senior, 1987; Cullis et al., 1998; Ishida a kol., 2001). Proto je schopnost určit fyzikálně-chemické vlastnosti vyráběných liposomů důležitá pro optimalizaci formulace pro další translační hodnocení.
hlavním aspektem fyzikálně-chemického hodnocení liposomů je vizualizace morfologie nanočástic pomocí mikroskopie. Pro zobrazování lipozomů a dalších nanočástic je k dispozici řada technik, které lze široce rozdělit do mikroskopie světla, elektronu nebo atomové síly (Bibi et al., 2011). Každá technika má své vlastní výhody a omezení, které je třeba vzít v úvahu při hodnocení studií systémů podávání léčiv na bázi nanočástic (Tabulka 1). Tento přehled vyhodnotí každou zobrazovací techniku použitou k posouzení morfologických charakteristik liposomů.

tabulka 1. Shrnutí současných zobrazovacích technik pro charakterizaci morfologie lipozomů.
Světelné Mikroskopie
Světlo nebo optické mikroskopie se týká mikroskopy, které využívají viditelné světlo a uspořádání čoček ke zvětšení zorného pole (Murphy a Davidson, 2012c). Základní světelná mikroskopie sám je schopen poskytnout komplexní informace o lipidové dvojvrstvy oproti detail nabízené jinými mikroskopie. Může se však použít k rychlému získání obrazu vezikul pomocí základního laboratorního vybavení (Bibi et al., 2011). Tato technika může být zvláště užitečná při shromažďování obecných informací o velikosti, tvaru, homogenitě a stupni agregace vzorku liposomu (Nallamothu et al., 2006). Světelné mikroskopy mají maximální rozlišení ∼250 nm (řídí nejmenší difrakce-omezená velikost spotu, který může být dosaženo prostřednictvím nástroje) a jako takové jsou obvykle schopny poskytovat podrobné informace týkající se struktury small unilamellar vesicles (Suv) a lamellarity vezikul (Bibi et al., 2011). Obecně může světelná mikroskopie poskytnout významné informace pouze o obřích unilamelárních váčcích (GUVs), které se mohou pohybovat od jednoho do stovek mikrometrů v průměru (Bagatolli, 2009). Inkorporace fluorescenčních sond, polarizace techniky a aplikace s vysokým rozlišením konfokální mikroskopie může poskytnout další informace o 3D struktuře a lamellarity váčků (Bagatolli, 2009).
Polarizační Mikroskopie
Tento typ světelné mikroskopie využívá jedinečné schopnosti polarizovaného světla komunikovat s polarizable dluhopisy objednat molekuly (Murphy a Davidson, 2012d). Zvýšená absorpce světla nastává, když jsou molekulární dipóly ve vzorku zarovnány s polarizačním vektorem dopadající světelné vlny; což vede k fázové rozdíly mezi odběru světelných paprsků, které na oplátku produkují rušení závislé změny v amplituda v obrazové rovině (Murphy a Davidson, 2012d). Kontrast obrazu pak vzniká nejen z účinků interference a difrakce, ale také z přítomnosti uspořádaných molekulárních uspořádání (Murphy a Davidson, 2012d). Může být použit ke studiu formy a dynamiky mnoha uspořádaných buněčných struktur, včetně lipidových dvojvrstv plazmatických membrán (Bibi et al., 2011; Murphy a Davidson, 2012d). Obrázky lze získat buď monochromaticky, nebo barevně. Tato technika poskytuje alternativní metodu pro vizualizaci liposomů, zejména pro potvrzení tvorby vezikul. Neposkytuje přesvědčivé pozorování týkající se dvouvrstvých charakteristik nebo lamelarity vezikul (Bibi et al., 2011). Kromě toho je polarizační mikroskopie také omezena velikostí vezikul, které lze vizualizovat, přičemž velké vezikuly v mikrometrovém rozsahu mají optimální jasnost. Tato technika neposkytuje jasné obrazy částic v rozsahu nanometrů.
Fluorescenční Mikroskopie
Fluorescenční nebo „epifluorescence“ mikroskopie je speciální forma světelné mikroskopie, která využívá schopnost fluorochromes vyzařovat světlo poté, co byl nadšený, že se světlo o určité vlnové délce (Murphy a Davidson, 2012b). Tato technika je široce používána v biofyzice k poskytování základních informací o struktuře a dynamice membránových složek (Bouvrais et al., 2010). V těchto studiích jsou fluorescenční sondy specificky začleněny do zkoumané membrány, což umožňuje vizualizaci struktury. Široká škála fluorescenčních barviv s různými chemickými a fotonickými vlastnostmi je komerčně dostupná, obstarávat různé výzkumné otázky. Například některá fluorescenční barviva mohou upřednostňovat specifická membránová prostředí vykazující různá uspořádání a boční balení (Bouvrais et al ., 2010). Jako takový, fluorescenční mikroskopie umožňuje potenciál současně aplikovat více sond ve vzorku, aby poskytla informace o samotné membránové struktuře. Fluorescenční sondy mohou být umístěny ve vodném kompartmentu, stejně jako lipidová dvojvrstva liposomů (Bibi et al., 2011). Toto uspořádání může být zvláště užitečné při prohlížení GV, kde lze získat informace o tvaru, velikosti a tekutosti lipidových váčků (Klymchenko et al., 2009; Bouvrais a kol., 2010). Začlenění sond, jako jsou lipidy značené rhodaminem, přímo do lipidové dvojvrstvy může také umožnit vizualizaci lamelarity liposomů (Bibi et al., 2011).
nevýhodou fluorescenční mikroskopie je, že kromě sond a barviva, aby se membránový systém může potenciálně interferovat s vlastnostmi lipozomální systém doručování (Bouvrais et al., 2010; Bibi a kol., 2011; Murphy a Davidson, 2012b). Ukázalo se však, že použití nízkých koncentrací barviva (≤1 mol%) má minimální dopad na fyzikální vlastnosti membrány (Bouvrais et al ., 2010). Je také důležité všimněte si, že volba fluorescenční barvivo je zásadní krok, protože některé barvy mohou vyvolat velké změny v hostitelské membrány a/nebo způsobit experimentální artefakty, což vede k nepřesné interpretaci dat (Bouvrais et al., 2010). Kromě toho může foto-indukovaná peroxidace lipidů také vést k tvorbě domén i v jednoduchých systémech barviva. Tento proces může mít za následek tvorbu velkých vorů a spontánní formování fazet (Bouvrais et al., 2010). Dlouhodobé vystavení fluorescenčnímu světlu může také vést k bělení a ztrátě intenzity fluorescence. Proto je volba fluorescenčního barviva a vývoj nových membránových sond důležitými úvahami při použití fluorescenční mikroskopie (Klymchenko et al ., 2009).
konfokální mikroskopie
konfokální skenovací mikroskopie je pokrokem v oblasti fluorescenční mikroskopie. Spíše než osvětlení celého vzorku je obraz vytvořen skenováním jednoho (nebo více) zaměřených paprsků světla napříč vzorkem. Světlo vracející se z osvětleného vzorku prochází clonou, která odmítá zaostřené světlo shora a pod rovinou zájmu; zajištění toho, aby byly získány pouze snímky z malé hloubky ostrosti, což výrazně zlepšuje rozlišení mimo rovinu (Bibi et al., 2011; Murphy a Davidson, 2012a). Pomocí této techniky, „z-stack“ z obrazů jsou shromažďovány, počínaje od horní části váčku následovaný snímky pořízené v definovanými z-přírůstky do spodní části vzorku, což má za následek composite 3D obraz vzorku (Bibi et al., 2011; Murphy a Davidson, 2012a). Konfokální skenovací mikroskopie se stala více atraktivní techniky nad epifluorescent světelné mikroskopy vzhledem k jeho vynikající obraz srozumitelnost. V případě GUVs je tato technika schopna vizualizovat vnitřní strukturu lipidových systémů,což často není možné u jiných mikroskopických metod (Ruozi et al ., 2011; Mertins a Dimova, 2013). Například oddělení vodné a lipidové dvojvrstvé fáze může být jasně vizualizováno ve větších vezikulech(Mertins a Dimova, 2013). Konfokální mikroskopie je však stále difrakčně omezená, a proto není schopna produkovat obrazy SUV nebo Oligolamelárních liposomů s vysokým rozlišením (Ruozi et al ., 2011).
techniky elektronové mikroskopie
elektronová mikroskopie je metoda pro vizualizaci vezikul při velmi vysokém zvětšení (Henry, 2005). To je široce používán v charakterizaci lipidových váčků jako elektron vlnovou délku (a tedy difrakce-omezené rozlišení), je o mnoho řádů nižší než u optické mikroskopie, a proto poskytuje super-rozlišení pro jasné zobrazení malých lipozomů (Bibi et al., 2011; Ruozi a kol., 2011). Tato technika používá paprsek elektronů zaměřený na povrch vzorku různými elektromagnetickými čočkami. Elektrony jsou pak rozptýlené vzorkem, a jsou pak přeorientovat a umocněn další série elektromagnetických čoček v zobrazovací sloupec vyrábět promítaného obrazu (Henry, 2005). Existuje řada různých typů elektronových mikroskopů, z nichž každý vyžaduje jinou metodu přípravy vzorku.
Skenovací Elektronové Mikroskopie (SEM)
Skenovací elektronové mikroskopy (Sem) využívají elektronový paprsek, který je snímán přes nebo přes vzorek (spíše než přes vzorek) vytvořit zvětšený obraz objektu (Adler a Schiemann, 1985). Alder et al. první pokus o použití SEM k charakterizaci liposomů v roce 1984 (Adler a Schiemann, 1985). Ukázali, že pomocí lyofilizace metoda pro přípravu liposom vzorků pro SEM měl za následek velký podíl viditelných hrudek a ztvrdlý materiál (Adler a Schiemann, 1985). Novější studie ukázaly, že samotná struktura liposomu může trpět poruchami v důsledku podmínek vysokého vakua a procesů barvení potřebných pro tuto techniku přípravy (Ruozi et al ., 2011). SEM se nyní běžně nepoužívá pro analýzu liposomů, protože vyžaduje, aby byl vzorek před zobrazením vysušen nebo fixován (Ruozi et al., 2011). SEM však může poskytnout obecné informace o soustředné struktuře různých lipidových vrstev a také poskytnout podrobnosti o velikosti a sférické morfologii přípravku (Nirale et al., 2009).
Transmisní Elektronové Mikroskopie (TEM)
Transmisní elektronové mikroskopie (TEM) je nejčastěji používaná zobrazovací metoda pro hodnocení struktury nanočástic (Henry, 2005; Kuntsche et al., 2011). Zahrnuje přípravu tenkého vzorku (< 100 nm tlustý), který je umístěn ve vakuové komoře. Elektronový paprsek prochází vzorkem, kde je pak zaostřen objektivem, aby vytvořil obraz. TEM může snadno zobrazovat vzorky měkké hmoty s prostorovým rozlišením až hluboko pod 1 nm (Henry, 2005; Kuntsche et al ., 2011; Ruozi a kol., 2011). Tato technika může být dále kategorizována na základě použité metody přípravy vzorku-zejména negativní barvení, zmrazení-zlomenina a kryogenní TEM. Může poskytnout informace o povrchových modifikacích nanočástic, protože poskytuje lepší kontrast a obrys obrazů než jiné mikroskopické techniky. Například, časování transferinu na povrch DSPC/cholesterol liposomy vykazovaly částic povrchu povlak s negativní-skvrny TEM, který byl přítomen v nekonjugovaný liposom přípravky (Anabousi et al., 2005). V samostatném experimentu, specifické protilátky zvýšil proti lidskému transferinu byly přidány před negativní skvrna postup potvrzení totožnosti částic, povrchové úpravy (Anabousi et al., 2005). Proto TEM poskytuje možnost dosáhnout mnohem lepšího rozlišení při hodnocení konjugace ligandů na povrch liposomů.
technika negativního barvení
u tem s negativním barvením zahrnuje příprava vzorku malé množství hydratovaného vzorku umístěného na mřížku. Jako váčky jsou v přímém kontaktu s mřížkou, jejich orientace a morfologie může být ovlivněna, a proto by měly být vzaty v úvahu (Bibi et al., 2011). Je také nutné vložit liposomy do vhodného elektronově hustého materiálu (např., solí těžkých kovů, jako uranyl acetát nebo fosfowolframové kyseliny), který poskytuje vysoký kontrast, takže váčků může být viděn na tmavě-barevné pozadí (Ruozi et al., 2011). Negativní-barvení technika je poměrně rychlá a jednoduchá; nicméně, bylo prokázáno, že příčinou změny do původní struktury liposomu a může vést k vytvoření světla a temné třásně, které mohou být zaměněny za lamelární struktury (Bibi et al., 2011; Ruozi a kol., 2011). Kromě toho může umístění vzorku do vakua způsobit další dehydrataci vzorku, což může opět způsobit změny ve struktuře vezikul (Bibi et al., 2011). Zatímco negativní-skvrny TEM technika může poskytnout mnohem vyšší zvětšení pro zobrazování nanočástic, poškození struktury liposomu je obtížné přesně zhodnotit morfologické charakteristiky vzorku. Proto jsou pro potvrzení výsledků obecně vyžadovány jiné zobrazovací techniky.
Freeze–Zlomenina Technika
freeze–zlomenina technika nevyžaduje žádné sušení a může poskytnout další informace o vnitřní struktuře nanočástic (Kuntsche et al., 2011). Tato metoda zahrnuje umístění vzorku na mřížku TEM, která je vložena mezi dva držáky mědi nebo zlata (Severs, 2007). Vzorek se vitrifikuje rychlým zmrazením, obvykle kapalným propanem nebo kapalným dusíkem, před zlomením podél oblastí vzorku se slabými molekulárními interakcemi. Tato zlomenina povrch může být dále leptané a stínu v tenké platinové nebo uhlíkové vrstvy poskytují „negativní“ replika lomu vzorku letadla (Servery, 2007; Kuntsche et al., 2011). Replika je poté vyčištěna organickým rozpouštědlem, aby se odstranily všechny zbytky před vizualizací pod mikroskopem TEM. Protože jsou tyto repliky tak stabilní, mohou být uloženy a zobrazeny později (Kuntsche et al., 2011). Hlavní výhodou této techniky je, že repliky úzce odrážet nativním stavu vzorku, a může poskytnout podrobné informace o 3D struktuře váčků a dvojvrstvy organizace (Bibi et al., 2011; Kuntsche a kol., 2011). Tyto informace zahrnují multilamelární konstrukci a dvojvrstvé balení multilamelárních váčků. Tato technika může také posoudit velikost agregátu a může být zvláště užitečná pro zkoumání interakce kationtových liposomů s DNA (Bibi et al ., 2011). Artefakty se však mohou ve vzorku během přípravy stále vyskytovat kvůli nedostatečné rychlosti zmrazení, opětovnému ukládání molekul rozpouštědla a / nebo mechanickému namáhání (Severs, 2007; Kuntsche et al., 2011). Například na SUV ve vzorku se může objevit“ vlnící se efekt “ (Bibi et al., 2011). Jedná se o běžnou dvouvrstvou deformaci, která je způsobena poruchou přechodů acylových řetězců před zmrazením. Inkubační váčky mezi pre-přechodem a skutečnou teplotou přechodu mohou také způsobit vlnky (Bibi et al., 2011). Je zajímavé, že to může být použito k poskytnutí informací o lipidových fázových přechodech, ke kterým dochází s různou povahou lipidů používaných pro lipozomální přípravky (Bibi et al ., 2011).
Kryogenní TEM
Kryogenní TEM (cryo-TEM) je variace TEM, kde tenké vodné hydratované filmy, které jsou glazované v kapalném ethanu jsou použity před imaging. Tato technika umožňuje analýzu liposomů v jejich nejpřirozenějším stavu a je cenným nástrojem pro určení velikosti, tvaru, vnitřní struktury a lamelarity liposomů (Weisman et al., 2004; Bibi a kol., 2011; Kuntsche a kol., 2011). Hlavní výhodou rychlého zmrazení liposom vzorků minimalizuje tvorbu ledových krystalů a zachování proteinů nebo jiných materiálů (Bibi et al., 2011; Kuntsche a kol., 2011). To je výhodné tam, kde byly proteiny nebo DNA zapouzdřeny v nanočásticích (Weisman et al ., 2004; Kuntsche et al., 2011). Cryo-TEM je nejužitečnější forma mikroskopie, která je v současné době k dispozici pro studium liposomů, protože zabraňuje problémům s chemickou fixací, dehydratací, řezáním a barvením – to vše může ovlivnit morfologii vezikul (Bibi et al., 2011). Rozsah rozlišení je ∼5 až 500 nm, jak je definováno tloušťkou filmu (Almgren et al ., 2000). U této techniky je však třeba poznamenat několik omezení, včetně skutečnosti, že z 3D objektů je získán pouze 2D obraz (což obecně platí i pro většinu ostatních mikroskopických technik). K překonání tohoto omezení je možná rekonstrukce 3D tvarů z dostatečně velkého počtu 2D obrazů náhodně orientovaných nesférických částic (Orlova et al ., 1999), stejně jako prohlížení vzorku v různých úhlech náklonu k získání informací o 3D tvaru (Van Antwerpen and Gilkey, 1994). Kryogenní elektronová tomografie (cryo-ET) může být také použita místo toho k dosažení 3D obrazů (Le Bihan et al., 2009). Cryo-TEM také využívá nižší dávky elektronů, což znamená, že má často nižší rozlišení ve srovnání s jinými metodami (Bibi et al., 2011; Kuntsche a kol., 2011). Artefakty jsou stále možné v důsledku tvorby tenké vrstvy amorfního ledu a použití blotting na vzorku použití smykové síly během tvorby filmu (Almgren et al., 2000; Bibi a kol., 2011).
Environmentální Rastrovací Elektronová Mikroskopie (ročníku esem)
Environmentální rastrovací elektronová mikroskopie (ročníku esem) je zobrazovací systém, který nevyžaduje použití fixace, barvení nebo zmrazení váčků, a může umožnit zobrazování dynamických změn mokrých systémů bez předchozí přípravy vzorku (Muscariello et al., 2005; Ruozi a kol., 2011). Hlavním rysem ESEM je přítomnost vodní páry v komoře mikroskopu. Schopnost udržovat vodu-obsahující atmosféry kolem vzorku, které může být částečně nebo dokonce plně hydratovaná, je možné pomocí více-clony, absolvoval vakuový systém, který umožňuje zobrazování komory udržet na tlaky až 55 hPa (Bibi et al., 2011; Ruozi a kol., 2011). Primární elektronový paprsek může generovat sekundární elektrony, které pak narazíte na par molekul, což vede k kaskáda amplifikace signálu před dosažením detektoru. Z tohoto důvodu ESEM nevyžaduje přípravu vzorku (Muscariello et al ., 2005). Tato technika umožňuje variaci v prostředí vzorku prostřednictvím řady tlakových, teplotních a plynových kompozic (Mohammed et al., 2004), což je užitečné při určování toho, jak změny prostředí ovlivňují vezikuly. To platí pro studie nanofarmaceutické formulace a stability (Bibi et al., 2011). ESEM byl také použit k analýze zatížení léčiva do dvojvrstvy liposomů (Mohammed et al ., 2004), stejně jako určení velikosti a tvaru vezikul. Omezení ESEM spočívá v tom, že nemůže poskytnout podrobné informace týkající se lamelarity a vnitřní architektury struktur nanoměřítka (Ruozi et al ., 2011).
mikroskopie atomové síly (AFM)
mikroskopie atomové síly (AFM), známá také jako mikroskopie skenovací síly (SFM), je typ techniky mikroskopu skenovací sondy. Funguje to tím, že běží ostrý hrot připevněný na konzolové a senzor po povrchu vzorku a měření povrchové síly mezi sondou a vzorkem (Sitterberg et al., 2010). Jako konzolové běží podél povrchu vzorku, to se pohybuje nahoru a dolů vzhledem k povrchu funkce a konzolový vychyluje podle toho. Tato deformace je obvykle kvantifikována pomocí optického snímače, se laserový paprsek odráží na zadní konzolový na detektor světla (Sitterberg et al., 2010). AFM nemusí pracovat ve vakuu a může pracovat v okolním vzduchu nebo pod kapalinou; proto se stále více používá k zobrazování biologických vzorků i nanočástic (Liang et al., 2004a, b; Ruozi et al., 2005, 2009). AFM má vynikající rozlišení v řádu frakcí nanometru a může poskytnout 3D obraz liposomů spolu s podrobnostmi o morfologii, distribuci velikosti, homogenitě a stabilitě (Liang et al., 2004a, b; Ruozi et al., 2005, 2007, 2009). Důležité je, že AFM lze použít k charakterizaci povrchových modifikací liposomů a detekci ligand (např. protilátek a polymerů) konjugovaných na povrchu liposomální membrány (Bendas et al ., 1999; Moutardier et al., 2003; Anabousi et al., 2005; Liang et al., 2005). Například Bendas et al. používá se AFM zvětšit liposomální membrány hranice a byli schopni obrázek trimerní struktur, přibližně 8-10 nm v průměru, které představovaly spojení IgG protilátek na povrch liposomu (Bendas et al., 1999). Zjištění ukázala, že účinnost technika byla velmi závislá na časování metody použité protilátky konjugované přímo na liposomální povrchu jsou viditelné s AFM (omezeno bílkovin mobility), ve srovnání se protilátky připojené k PEG řetězců. Bylo sugestivní, že řetězce PEG způsobily vysokou mobilitu bílkovin, a proto nemohly být skenovány (Bendas et al., 1999). Naopak, Anabousi et al ukázala, že začlenění Pegylovaný lipidů do liposomy vyvolané stérické stabilizace s liposomy udržení kulovitý tvar (Anabousi et al., 2005). AFM snímky povrchu nekonjugovaný liposomy byly hladké a bez struktury by mohl být pozorován, vzhledem k tomu, že časování transferin na povrchu Pegylovaných lipozomech jsou zobrazeny jako malé kulovité struktury (Anabousi et al., 2005). Podobně, Moutardier et al vyrobeny liposomy s polymerní jader (LSP), který se skládal z léků načten do polymerní částice, které tvořily jádro lipidové vezikuly (Moutardier et al., 2003). Snímky pořízené pomocí AFM ukázala přítomnost polymerní síť na vnější povrch, který navrhl, že kolagen polymerní jádro vyzářeného ven a tvoří povrchovou vrstvu na LSP (Moutardier et al., 2003). Kromě povrchových konstrukčních detailů může AFM poskytnout informace o mechanických a chemických vlastnostech povrchu vzorku pomocí měření síly (Ruozi et al ., 2007). Například Mao et al. používá se tato technika k posouzení elasticity a adhezivních vlastností liposomů (Mao et al., 2004). Jedním z omezení AFM je potřeba adsorbovat nanočástice na nosné povrchy, jako jsou slídy nebo křemíkové destičky. Adsorpce liposomů na pevný substrát má potenciál změnit velikost a tvar vezikul a způsobit jejich zploštění. (Ruozi et al., 2007). Kromě toho může periodický kontakt sondovacího hrotu táhnout liposomy, když se pohybuje přes vezikuly ve vzorku (Jass et al., 2000). Navzdory tomu je AFM stále užitečným nástrojem při hodnocení liposomů.
závěr
k dispozici je široká škála zobrazovacích technik pro hodnocení morfologie liposomů, přičemž každá má své vlastní výhody a nevýhody. Světelná mikroskopie může relativně rychle poskytnout obecné podrobnosti týkající se velikosti a tvaru větších váčků a homogenity vzorku. Naopak TEM je nejčastěji používanou technikou pro zkoumání morfologie liposomů mnohem podrobněji; při interpretaci výsledků je však třeba vzít v úvahu možnost strukturálních změn u každého podtypu TEM v důsledku barvení a/nebo vystavení vakuovým podmínkám. ESEM je nejužitečnější při určování lipozomálních změn v reakci na životní prostředí, zatímco AFM se objevuje jako užitečná metoda v morfologické analýze nanočástic a poskytuje maximální rozlišení lipozomálního povrchu. AFM i TEM jsou schopny zobrazovat ligandy konjugované s povrchem liposomů a poskytovat doplňkové informace o povrchových modifikacích. Celkově je výběr techniky závislý na tom, jaké morfologické vlastnosti a stupeň detailu jsou vyžadovány. Kromě toho je v procesu výběru důležité pochopení potenciálních účinků metody přípravy vzorku každé zobrazovací techniky.
autorské příspěvky
vypracování rukopisu: A-LR a SH. Kritická revize článku pro důležitý intelektuální obsah: SH, PD, JF, WP, AM, DS a AW.
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.
Poděkování
autoři chtějí poděkovat Lékárna Research Trust of New South Wales, Rebecca L. Cooper Medical Research Foundation, Gladys M. Brawn Přátelství, ausEE Research Foundation a University of Newcastle pro poskytování finanční podpory pro náš výzkum.
Adler, K., and Schiemann, J. (1985). Charakterizace liposomů skenovací elektronovou mikroskopií a technikou freeze-fracture. Micron Microsc. Acta 16, 109-113. doi: 10.1016/0739-6260(85)90039-5
CrossRef Plný Text | Google Scholar
Almgren, M., Edwards, K., a Karlsson, G. (2000). Kryo transmisní elektronová mikroskopie liposomů a příbuzných struktur. Koloidy Surfují. Fyzikochém. Inženýrství. Aplikace. 174, 3–21. doi: 10.1016/S0927-7757(00)00516-1
CrossRef Plný Text | Google Scholar
Anabousi, S., Laue, M., Lehr, C. M., Bakowsky, ny, Spojené státy, a Ehrhardt, C. (2005). Hodnocení transferinové modifikace liposomů mikroskopií atomárních sil a transmisní elektronovou mikroskopií. Euro. J. Pharm. Biopharm. 60, 295–303. doi: 10.1016 / j. ejpb.2004.12.009
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Bagatolli, L. a. (2009). Membrány a fluorescenční mikroskopie. Recenze v fluorescenci 2007. Springer, 33: 51. doi: 10.1007/978-0-387-88722-7_2
CrossRef Plný Text | Google Scholar
Bakker-Woudenberg, I. a., Storm, v. G., a Woodle, M.C. (1994). Liposomy v léčbě infekcí. J. Drogový Cíl. 2, 363–371. doi: 10.3109/10611869408996811
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Bendas, G. (2001). Imunoliposomy: slibný přístup k cílení na léčbu rakoviny. Biodrugy 15, 215-224. doi: 10.2165/00063030-200115040-00002
CrossRef Plný Text | Google Scholar
Bendas, G., Krause, A., Bakowsky, U., Vogel, J., a Rothe, U. (1999). Cílenost nových imunolipozomů připravených novou technikou konjugace protilátek. Int. J. Pharm. 181, 79–93. doi: 10.1016/S0378-5173(99)00002-2
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Bibi, S., Kaur, R., Henriksen-Lacey, M., McNeil, S. E., Wilkhu, J., Lattmann, E., et al. (2011). Mikroskopické zobrazování liposomů: od krytek po environmentální SEM. Int. J. Pharm. 417, 138–150. doi: 10.1016 / j. ijpharm.2010.12.021
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Bouvrais, H., Pott, T., Bagatolli, L. a., Ipsen, J. H., a Meleard, P. (2010). Vliv membránově ukotvených fluorescenčních sond na mechanické vlastnosti lipidových dvojvrstv. Biochim. Biophys. Acta 1798, 1333-1337. doi: 10.1016 / j. bbamem.2010.03.026
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Cullis, P. R., Chonn, A., a Semple, S. C. (1998). Interakce liposomů a nosných systémů na bázi lipidů s krevními proteiny: vztah k chování clearance in vivo. ADV. Drogové Deliv. Rev. 32, 3-17. doi: 10.1016/S0169-409X(97)00128-2
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Ding, B. S., Dziubla, T., Shuvaev, V. V., Muro, S., a Muzykantov, V. R. (2006). Pokročilé systémy podávání léků, které se zaměřují na vaskulární endotel. Molo. Interv. 6, 98–112. doi: 10.1124 / m.6.2.7
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Henry, C. R. (2005). Morfologie podporovaných nanočástic. Pořada. Surf. Věda. 80, 92–116. doi: 10.1016 / j. progsurf.2005.09.004
CrossRef Plný Text | Google Scholar
Hua, S. (2013). Cílení na místa zánětu: mezibuněčná adhezní molekula-1 jako cíl pro nové zánětlivé terapie. Před. Farmakol. 4:127. doi: 10.3389 / fphar.2013.00127
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Hua, S., Marek, E., Schneider, j. J., a Keely, S. (2015). Pokroky v orálních nano-dodacích systémech pro cílené podávání léků v střevě při zánětlivém onemocnění střev: selektivní cílení na nemocné versus zdravé tkáně. Nanomedicína 11, 1117-1132. doi: 10.1016 / j. nano.2015.02.018
PubMed Abstract / CrossRef Full Text / Google Scholar
Hua, s., and Wu, s. y. (2013). Použití nanonosičů na bázi lipidů pro cílené terapie bolesti. Před. Farmakol. 4:143. doi: 10.3389 / fphar.2013.00143
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Ishida, T., Harashima, H., a Kiwada, H. (2001). Interakce liposomů s buňkami in vitro a in vivo: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L., Duportail, G., et al. (2009). Vizualizace lipidových domén v obřích unilamelárních váčcích pomocí membránové sondy citlivé na životní prostředí založené na 3-hydroxyflavonu. Biochim. Biophys. Acta 1788, 495-499. doi: 10.1016 / j. bbamem.2008.10.019
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Kuntsche, J. Horst, J. C., a Bunjes, H. (2011). Kryogenní transmisní elektronová mikroskopie (cryo-TEM) pro studium morfologie systémů dodávání koloidních léčiv. Int. J. Pharm. 417, 120–137. doi: 10.1016 / j. ijpharm.2011.02.001
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Le Bihan, O., Bonnafous, P., Marák, L., Bickel, T., Trepout, S., Mornet, S., et al. (2009). Kryo-elektronová tomografie transmigrace nanočástic do liposomu. J.Struct. Biol. 168, 419–425. doi: 10.1016 / j. jsb.2009.07.006
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Liang, X., Mao, G, Ng, K. Y. (2004a). Mechanické vlastnosti a měření stability liposomu obsahujícího cholesterol na slídě mikroskopií atomárních sil. J.Koloidní Rozhraní Sci. 278, 53–62.
PubMed Abstraktní | Google Scholar
Liang, X., Mao, G, Ng, K. Y. (2005). Vliv délek řetězce PEO-PPO-PEO na morfologii a stabilitu malého unilamelárního liposomu: vyšetřování AFM. J.Koloidní Rozhraní Sci. 285, 360–372. doi: 10.1016 / j. jcis.2004.11.042
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Liang, X., Mao, G., a Simon Ng, K. Y. (2004b). Sondování malých unilamelárních váčků EggPC na povrchu slídy mikroskopií atomárních sil. Koloidy Surfují. Biointerfaces 34, 41-51.
PubMed Abstraktní | Google Scholar
Mao, G., Liang, X, a Ng, K. Y. S. (2004). Encyklopedie nanověd a nanotechnologií. New York, NY: Marcel Dekker.
Google Scholar
Mastrobattista, E., Koning, G. a., a Bouře, G. (1999). Imunoliposomy pro cílené podávání protinádorových léků. ADV. Drogové Deliv. Rev. 40, 103-127. doi: 10.1016/S0169-409X(99)00043-5
CrossRef Plný Text | Google Scholar
Mertins, O., a Dimova, R. (2013). Poznatky o interakcích chitosanu s fosfolipidovými vezikuly. Část II: ztužení membrány a tvorba pórů. Langmuir 29, 14552-14559. doi: 10.1021/la4032199
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Metselaar, J. M., a Bouře, G. (2005). Liposomy při léčbě zánětlivých poruch. Expert Opin. Drogové Deliv. 2, 465–476. doi: 10.1517/17425247.2.3.465
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Mohammed, A. R., Weston, j. N., Coombes, a. G., Fitzgerald, M., and Perrie, y. (2004). Lipozomová formulace špatně rozpustných léčiv: optimalizace zatížení léčivem a ESEM analýza stability. Int. J. Pharm. 285, 23–34. doi: 10.1016 / j. ijpharm.2004.07.010
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Moutardier, V., Tosini, F., Vlieghe, P., Caro, L., Delpero, J. R., a Clerc, T. (2003). Biologická dostupnost koloidních protinádorových léčiv v modelech perorálního podání. Int. J. Pharm. 260, 23–38. doi: 10.1016/S0378-5173(03)00231-X
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Murphy, D. B., a. Davidson, M. W. (2012a). Konfokální Laserová Skenovací Mikroskopie. Základy světelné mikroskopie a elektronického zobrazování, 2.Edn. Hoboken, NJ: John Wiley & Sons, 265-305. doi: 10.1002/9781118382905.ch13
CrossRef Plný Text | Google Scholar
Murphy, D. B., a. Davidson, M. W. (2012b). Fluorescenční Mikroskopie. Základy světelné mikroskopie a elektronického zobrazování. Weinheimu: John Wiley & Sons, 199-231. doi: 10.1002/9781118382905.ch11
CrossRef Plný Text | Google Scholar
Murphy, D. B., a. Davidson, M. W. (2012c). Základy světelné mikroskopie a elektronického zobrazování. Hoboken, NJ: John Wiley & Sons, 1-19. doi: 10.1002/9781118382905
CrossRef Plný Text | Google Scholar
Murphy, D. B., a. Davidson, M. W. (2012d). Polarizační Mikroskopie. Základy světelné mikroskopie a elektronického zobrazování. Hoboken, NJ: John Wiley & Sons, 153-171. doi: 10.1002/9781118382905.ch9
CrossRef Plný Text | Google Scholar
Muscariello, L., Rosso, F., Marino, G., Giordano, A., Barbarisi, M., Cafiero, G., et al. (2005). Kritický přehled aplikací ESEM v biologické oblasti. J.Cell. Fyziol. 205, 328–334. doi: 10.1002 / jcp.20444
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Nallamothu, R., Wood, G. C., Pattillo, C. B., Scott, R. C., Kiani, M. F., Moore, B. M., et al. (2006). Nádor cévní cílené liposomálních systém pro combretastatin A4: konstrukce, charakterizace a in vitro hodnocení. AAPS PharmSciTech 7:E32. doi: 10.1208/pt070232
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Nirale, N. M., Vidhate, R. D., a Nagarsenker, M. S. (2009). Flutikason-propionátové liposomy pro plicní podání. Indián J. Pharm. Věda. 71, 709–711.
Google Scholar
Orlova, E. V., Sherman, M. B., Chiu, W., Mowri, H., Smith, L. C., a Tak a. M. Jr. (1999). Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Forni, F., Fresta, M., and Vandelli, m. a. (2005). Mikroskopie atomárních sil a fotonová korelační spektroskopie: dvě techniky pro rychlou charakterizaci liposomů. Euro. J. Pharm. Věda. 25, 81–89. doi: 10.1016 / j. ejps.2005.01.020
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Ruozi, B., Tosi, a. G., Leo, E., a Vandelli, M. a. (2007). Aplikace mikroskopie atomové síly k charakterizaci liposomů jako nosičů léčiv a genů. Talanta 73, 12: 22. doi: 10.1016 / j. talanta.2007.03.031
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Ruozi, B., Tosi, a. G., Tonelli, M., Bondioli, L., Mucci, A., Forni, F., et al. (2009). AFM fázové zobrazování měkkých hydratovaných vzorků: všestranný nástroj k dokončení chemicko-fyzikálního studia liposomů. J. Liposome Res.19, 59-67. doi: 10.1080/08982100802584071
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Sawant, R. R., a Torchilin, V. P. (2012). Výzvy ve vývoji cílených lipozomálních terapeutik. AAPS J. 14, 303-315. doi: 10.1208/s12248-012-9330-0
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Senior, J. H. (1987). Osud a chování liposomů in vivo: přehled kontrolních faktorů. Zásah. Reverende There. Nosič Léků Syst. 3, 123–193.
PubMed Abstraktní | Google Scholar
Sercombe, L., Veerati, T., Moheimani, F., Wu, S. Y., Sood, a. K., a Hua, S. (2015). Pokroky a výzvy liposomem asistované dodávky léků. Před. Farmakol. 6:286. doi: 10.3389 / fphar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Torchilin, V. P. (1994). Imunoliposomy a pegylované imunoliposomy: možné použití pro cílené podávání zobrazovacích látek. Imunometody 4, 244-258. doi: 10.1006 / immu.1994.1027
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Van Antwerpen, R., a Gilkey, J. C. (1994). Kryo-elektronová mikroskopie odhaluje spodní strukturu lipoproteinů s nízkou hustotou. J. Lipid Res.35, 2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Willis, M., a Forssen, E. (1998). Liposomy zaměřené na Ligand. ADV. Drogové Deliv. Rev. 29, 249-271. doi: 10.1016/S0169-409X(97)00083-5
CrossRef Plný Text | Google Scholar
Zununi Vahed, S., Salehi, R., Davaran, a. S., a Sharifi, a. S. (2017). Systémy souběžného podávání léků na bázi liposomu v rakovinných buňkách. Matry. Věda. Inženýrství. C Mater. Biol. Appl. 71, 1327–1341. doi: 10.1016 / j. ms.2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply