Organická Chemie II

experimentálně se však pozoruje, že existuje významná bariéra rotace kolem vazby C2-C3 a že celá molekula je rovinná. Kromě toho je vazba C2-C3 dlouhá 148 pm, kratší než typická jednoduchá vazba uhlík-uhlík (asi 154 pm), i když delší než typická dvojná vazba (asi 134 pm).
molekulární orbitální teorie odpovídá za tato pozorování konceptem delokalizovaných pí vazeb. Na tomto obrázku se čtyři atomové orbitaly 2p matematicky kombinují a vytvářejí čtyři pi molekulární orbitaly rostoucí energie. Dva z nich – vazebné orbitaly pi-mají nižší energii než atomové orbitaly p, ze kterých jsou vytvořeny, zatímco dva-antibondingové orbitaly pi* – mají vyšší energii.

nejnižší energetický molekulární orbital, pi1, má pouze konstruktivní interakci a nulové uzly. Vyšší energie, ale stále nižší než izolovaný p-orbitaly, pi2 orbital má jeden uzel, ale dva konstruktivní interakcí – což je stále lepení orbitální celkově. Při pohledu na dva antibondingové orbitaly má pi3 * dva uzly a jednu konstruktivní interakci, zatímco pi4 * má tři uzly a nulové konstruktivní interakce.
aufbau princip, čtyři elektrony z izolovaných atomových orbitalů 2pz jsou umístěny v lepení pi1 a pi2 MO. Protože pi1 zahrnuje konstruktivní interakce mezi C2 a C3, k dispozici je stupeň, v 1,3-butadienu molekuly, pi-lepení interakce mezi těmito dvěma uhlíky, které tvoří její kratší délka a bariéra do rotace. Obraz valenční vazby 1,3-butadienu ukazuje dvě vazby pi jako izolované od sebe navzájem, přičemž každá dvojice pi elektronů „uvízla“ ve své vlastní vazbě pi. Molekulární orbitální teorie však předpovídá (přesně), že čtyři pi elektrony jsou do jisté míry delokalizovány nebo „rozloženy“ v celém systému pi.

1,3-butadien je nejjednodušším příkladem systému konjugovaných vazeb pi. Považovat za konjugovaný, dva nebo více pi dluhopisů musí být od sebe odděleny pouze jeden jediný bond – jinými slovy, že nemůže být zapojené sp3-hybridizovaný uhlík, protože to by rozbít překrývání systém, paralelní p-orbitaly. Ve sloučenině níže jsou například konjugovány dvojné vazby C1-C2 a C3-C4, zatímco dvojná vazba C6-C7 je izolována od ostatních dvou vazeb pi SP3-hybridizovaným C5.

velmi důležitý koncept, který je třeba mít na paměti, je, že s konjugací je spojena inherentní termodynamická stabilita. Tuto stabilitu lze experimentálně měřit porovnáním tepla hydrogenace dvou různých dienů. (Hydrogenace je typ reakce, o kterém se dozvíme mnohem více v kapitole 15: v podstatě jde o proces přidávání molekuly vodíku-dvou protonů a dvou elektronů – do vazby p). Když dvě konjugované dvojné vazby 1,3-pentadienu jsou „ztužený“ vyrábět pentan, o 225 kJ je propuštěn na mol pentan tvořil. Porovnejte to s přibližně 250 kJ / mol uvolněným, když jsou dvě izolované dvojné vazby v 1,4-pentadienu hydrogenovány a také tvoří pentan.
tvorba syntetických polymerů z dienů, jako je 1,3-butadien a isopren, je popsána v oddíle 18.5. Syntetické polymery jsou velké molekuly tvořené menšími opakujícími se jednotkami. Pravděpodobně jste poněkud obeznámeni s řadou těchto polymerů; například polyethylen, polypropylen, polystyren a poly(vinylchlorid).

Obrázek 13.6: Energetický diagram pro hydrogenace 1,3-butadienu (není v měřítku).
Jako hydrogenace 1,3-butadien uvolní méně než předpokládané množství energie, energetický obsah 1,3-butadienu musí být nižší, než bychom očekávali. Jinými slovy, 1,3-butadien je stabilnější, než naznačuje jeho vzorec.
konjugovaný Dien má nižší energii: jinými slovy, je stabilnější. Obecně jsou konjugované vazby pi stabilnější než izolované vazby pi.
Tady je energetický diagram porovnávající různé druhy dluhopisů s jejich zahřívá hydrogenací (na mol) ukázat relativní stabilitu každé molekule (1 kcal = 4.18 kJ). (Čím nižší je teplo hydrogenace (na vazbu pi), tím stabilnější je struktura.)
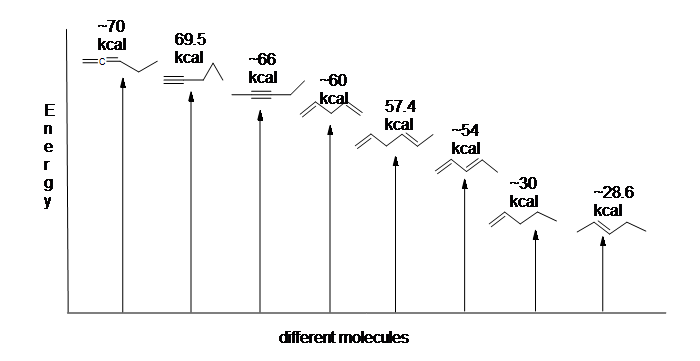
stabilizace dienů konjugací je méně dramatická než aromatická stabilizace benzenu. Nicméně podobné rezonanční a molekulární orbitální popisy konjugace mohou být napsány.
Syntéza dienů
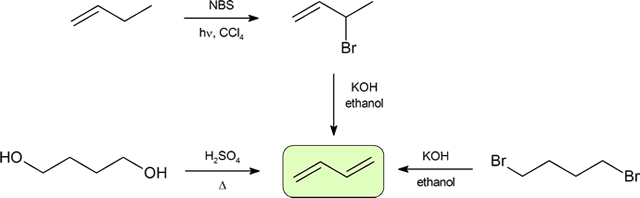
dva nejčastější způsoby, jak syntetizovat konjugované dieny jsou dehydratace alkoholů a dehydrohalogenation z organohalides, které byly zavedeny v přípravě alkenů (Sekce 9.9). Následující schéma ilustruje některé cesty k přípravě konjugovaného dienu.
Konjugované pi systémy mohou zahrnovat kyslíku a atomy dusíku i uhlíku. V metabolismu molekul tuku zahrnují některé klíčové reakce alkeny, které jsou konjugovány s karbonylovými skupinami.

MO teorie je velmi užitečná při vysvětlování, proč organické molekuly, které obsahují rozšířené systémy konjugovaných vazeb pi, mají často výrazné barvy. beta-karoten, sloučenina zodpovědná za oranžovou barvu mrkve, má rozšířený systém 11 konjugovaných vazeb pi.

cvičení
cvičení 2.9: Identifikujte všechny konjugované a izolované dvojné vazby ve strukturách níže. Pro každý konjugovaný pi systém zadejte počet překrývajících se p orbitalů a kolik pi elektronů je mezi nimi sdíleno.

cvičení 2.10: identifikujte všechny izolované a konjugované vazby pi v lykopenu, červeně zbarvené sloučenině v rajčatech. Kolik pi elektronů je obsaženo v konjugovaném pi systému?
Leave a Reply