Phosphofructokinase (PFK)
Obsah
- 1 Úvod
- 2 Role v procesu Glykolýzy a
- 3 Mechanismu a Regulace Phosphofructokinase
- 4 Nařízení
- 5 Konformační Změny v Dimerní Jednotka PFK
- 6 Hlavní Konformační Změny v Podjednotku PFK.
- 7 Site-Directed Mutageneze
- 8 Onemocnění
- 9 3D struktur PFK
Úvod
Phosphofructokinase-1 (PFK-1) je glycolytic enzym, který katalyzuje přenos fosforylové skupiny z výnosu a . Viz Enzymy Glykolýzy. Mg2+ je také důležitý v této reakci (). Fosfofruktokináza-2 (PFK-2) působí na stejné substráty za vzniku ADP a . . PFK reakce je za fyziologických podmínek silně exergonická (nevratná), a proto je jedním z kroků glykolytické dráhy určujících rychlost. Ve většině organismů/tkání, PFK je glycolytic pathway to hlavní tok-regulaci enzymů; jeho činnost je řízena koncentrace neobvykle velké množství metabolitů, včetně ATP, ADP, AMP, PEP a fruktóza-2,6-bisphosphate.
je tetramer identických podjednotek 320 reziduí. Jedná se o alosterický enzym, který je popsán pomocí symetrického modelu allosterismu, přičemž dochází ke společnému přechodu ze stavu r s vysokou aktivitou do stavu T s nízkou aktivitou. Byly hlášeny rentgenové struktury R I T stavů enzymu. Vazba jedné molekuly substrátu F6P, který se váže k R stavu enzymu s vysokou afinitou, ale do T stavu enzymu s nízkou afinitou, způsobuje PFK, aby se R státu, který podle pořadí, zvyšuje vazebnou afinitu enzymu pro další F6P (homotropic efekt). Aktivátory, jako je například ADP a AMP vázat na tzv. allosterická místa, vazebná místa odlišné od aktivního místa, kde se rovněž usnadnit vznik R státu, a tedy aktivaci enzymu (heterotropic účinek; ADP, že produkt PFK reakce, také se váže na aktivní místo enzymu). Podobně, inhibitory jako je PEP vázat na allosterická místa (což v případě PFK překrývá aktivace alosterické místo), kde se podporují tvorbu T státě, čímž inhibuje enzym.
dvě aktivní místa enzymu jsou umístěna na rozhraní s aktivním místem rozhraní v purpurové se substráty v azurové barvě. Další dvě aktivní místa jsou na rozhraní podjednotek B (zelená) A C (růžová). Detail z podjednotky D (Žlutá) ukazuje, že aminokyseliny z obou podjednotek A (světle modrá) a D (Žlutá) přispívají k vázání F6P. Dvě allosterická místa se nachází na rozhraní a dva na rozhraní podjednotek C a D. Opět rozhraní jsou magenta s allosterickým ligand v azurové. Detailní záběr podjednotky a ukazuje příspěvky obou podjednotek k vazbě ADP. Konformační změny v přechodu mezi stavy R A T PFK jsou ilustrovány níže.
atomové souřadnice R státní PFK byly získány z 4pfk; ty, pro T stav PFK byly získány z Philip Evans, MRC Laboratory of Molecular Biology, Cambridge, U. K., ale jsou nyní k dispozici jako 6pfk.
Roli v procesu Glykolýzy a
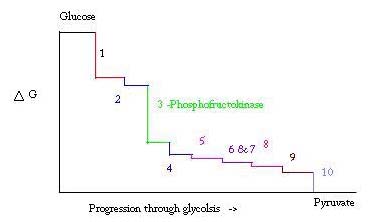
Glykolýza je proces přípravy, a rozebrat, glukózy, aby se kyselina pyrohroznová, která se používá v anaerobní dýchání nebo jako jeden z výchozích reaktantů v cyklu kyseliny citrónové. Tři body v procesu glykolýzy se vyskytují s velkou negativní volnou energií, a proto jsou nevratné. Tyto tři body jsou hexokináza, phosphofructokinase, a pyruvát kinázy; z těchto tří PFK je považován za hlavní regulační bod pro glykolýzy ve svalu s ΔG= -25.9 kJ/mol.
Mechanismus a Regulace Phosphofructokinase
Phosphofructokinase váže oba Mg2+-ATP a fruktóza-6-fosfát (F6P), aby se fruktóza-1,6-bisfosfát, čímž Mg2+-ADP. Ačkoli obraz s oběma těmito produkty nebyl stanoven, vázaný na enzym byl. Na podjednotku jsou tři vazebná místa ligandu. Dva tvoří aktivní místo, které váže F6P a ATP, zatímco třetí je alosterické vazebné místo. Některá navrhovaná rezidua v aktivním místě zahrnují . PFK existují ve dvou konformačních stavech, oba jsou v rovnováze. ATP váže aktivní i alosterická místa v obou konformacích. Zatímco ATP se váže na aktivní místo stejně dobře, to přednostně váže na alosterické místo T stav v Této preferenční vazba způsobí posun od rovnováhy obou států, aby větší množství T stát , který snižuje afinitu pro F6P. také se váže na alosterické místo zvýšení poměru R státní phosphofructokinase. Spolu s ADP, AMP A F2, 6P inhibují regulační roli ATP. Km PFK pro ATP je.020 mm a .032mM.
regulace
glykolýza je nezbytný metabolický proces pro přežití. Proto musí být při jeho aktivaci a potlačení vysoce regulována. Tři body v procesu glykolýzy se vyskytují s velkou negativní volnou energií, a proto jsou nevratné. Tyto tři body jsou hexokináza, fosfofruktokináza a pyruvát kináza. Tyto tři reakce jsou kandidáty na hlavní body regulace kvůli jejich vysokým negativním volným energiím. Ze tří, PFK je považován za hlavní regulační bod pro glykolýzy (#3 na obrázku níže) ve svalu, s ΔG= -25.9 kJ/mol, protože to je závazný krok. Jednou PFK převádí F6P do F1,6P, reakce nebude snadno zvrátit, protože vysoké množství energie, které je třeba překonat, aby šel dozadu. . Tato energetická bariéra má smysl, protože pyruvát kináza katalyzuje konečnou reakci (#10) a hexokináza (#1) se vůbec nepodílí na glykolýze, když je proces zahájen z glykogenu.
PFK je regulován ATP, AMP a ADP. Zatímco ATP se váže v aktivním místě stejně dobře v obou R a T státech, a to přednostně váže na alosterické místo T stav v Této preferenční vazba způsobí posun od rovnováhy obou států, aby větší množství T stát , který snižuje afinitu pro F6P. Alosterický aktivátor ADP se také váže na alosterické místo zvýšení poměru R státní phosphofructokinase. Jak je vidět z níže uvedeného grafu, grafy aktivity PFK jsou sigmoidní. To dále demonstruje kooperativní povahu enzymu. Původní vazba substrátu na enzym je obtížné, ale jakmile je povinen a síly změnu stavu z T -> R, jiné substráty se váží mnohem snadněji. Graf také ukazuje, že přidání ATP posune graf doprava (tj. snižuje afinitu k F6P), zatímco přidání AMP jej přesune doleva.
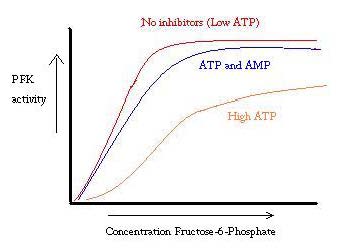
systém regulace dobře odpovídá funkci PFK. Když je PFK aktivní, ATP se z něj vyrábí dolů, protože další produkty se rozpadají úplněji. Pokud jsou tedy hladiny ATP nízké a je třeba provést více, aktivita PFK se zvýší, protože ADP bude ve vysoké koncentraci. Opak platí také, protože vysoká koncentrace ATP inhibuje aktivitu bílkovin. A přesto, toto vysvětlení nemůže zcela zohlednit nařízení PFK, protože hladina ATP se velmi liší dost mezi aktivní a svalech. Musí být nalezen další prostředek alosterické regulace.
PFK Km pro ATP je .020 mm a .032mM.
Tento Kinemage cvičení se skládá ze dvou kinemage scén, které ilustrují některé z allosterically indukované konformační změny, které se vyskytují v PFK z Bacillus stearothermophilus.
Konformační Změny v Dimerní Jednotka PFK
Tento kinemage ukazuje, dvou podjednotek tetramer, jehož rozhraní obsahuje dvě aktivní místa. (KineMage v současné době nejsou podporovány)první pohled, 1: PFK dimer, ukazuje dvě podjednotky v jejich R státní konformaci reprezentované jejich Ca páteř s Podjednotku 1 v růžové odstín a Podjednotky 2 v růžové. Dvě boční řetězce v každé podjednotky jsou zobrazeny, ty Glu 161 (červená) a Arg 162 (azurová), které jsou součástí F6P vazebné místo v T a R států, srespectively(viz níže). F6P (hotpink) a ADP (zelená; „ADP-active“) jsou vázány v aktivním místě každé podjednotky. Další ADP (žlutá; „ADP-allo“) je vázán v samostatném takzvaném allosterickém místě každé podjednotky. ADP mají každý přidružený Mg2+, který je zde reprezentován koulí stejné barvy jako ADP, ke kterému se váže.
kliknutím na tlačítko „animovat“ přepnete dimer mezi jeho stavy R A T. Ve stavu T je podjednotka 1 bluetint a podjednotka 2 skyblue. Boční řetězce Glu 161 a Arg 162 v obou podjednotkách jsou červené a azurové jako dříve (pouze atomy Ca a Cb postranního řetězce Arg 162 v podjednotce 1 jsou pozorovány v rentgenové struktuře stavu T; všechny podjednotky 2 jsou pozorovány). Enzym T státu váže inhibitor 2-fosfoglykolátu (zlato; „PGC“), nefyziologický analog glykolytického meziproduktu fosfoenolpyruvátu (PEP). Všimněte si, že vazebné místo PGC ve stavu T překrývá alosterické vazebné místo ADP ve stavu R („ADP-allo“), a proto se jejich vazba vzájemně vylučuje. Aktivní místa ve stavu T, která neobsahují F6P, jsou označena „ghost“ F6Ps (šedá; „F6P místo“), které mají stejné polohy jako F6Ps ve stavu enzymu R.
druhý pohled, 2: stránky Allo/Act, je Detailní záběr horní části prvního pohledu zobrazující jak aktivní místo, tak alosterické místo v této oblasti. Všimněte si, že aktivní místo se nachází na rozhraní mezi dvěma podjednotkami a že alosterické místo interaguje přímo s aktivním místě na sousední podjednotky. Porovnejte konformace stavu R a stavu T zobrazením obou najednou nebo kliknutím na „animovat“. Můžete identifikovat ionty Mg2+ spojené s každým ADP vázaným na enzym ve stavu R? Které atomy ADP koordinují tyto ionty Mg2+?
fosfátové skupiny PGC se váže na alosterické místo v T stavu, v téměř stejné pozici, že beta fosfátové skupiny „ADP-allo“ se váže k R stavu alosterické místo; oba fosfátové skupiny se váží na postranních řetězců tři stejné zbytky (2 arg a 1 Lys; není zobrazeno).
V high-činnost R státu, pozitivně nabitý postranní řetězec Arg 162 tvoří vodík vázán sůl most s negativně nabitými 6-fosfát skupina F6P (bílé přerušované čáry), interakci, která pravděpodobně stabilizuje R států v poměru k T stavu a je tedy částečně zodpovědný za F6P je homotropic efekt.
Hlavní konformační změny v podjednotce PFK.
Tento KINEMAGE ukazuje ty segmenty v blízkosti alosterického místa (rezidua 53-60 zde nejsou zobrazena). Stejně jako v KINEMAGE 1, polypeptid je zastoupena Ca řetěz s R státní Podjednotky 1 a 2 v redtint a růžové, a T státní Podjednotky 1 a 2 v bluetint a skyblue. (KineMage v současné době nejsou podporovány)KINEMAGE 2 přijde v zobrazení 1: Alosterické Místo, v R stav ukazuje fosfátové skupiny F6P (hotpink) vázán do aktivního místa enzymu v vodík vázán sůl most (přerušované bílé čáry) s postranní řetězec Arg 162 (cyan). ADP (žlutá; „ADP-allo“) zabírá sousední allosterickou lokalitu. Klikněte jednou na „animovat“ pro přepnutí do stavu T. To nahrazuje ADP v alosterickém místě R stavu inhibitorem a Pep analogem PGC (gold). F6P již nezabírá aktivní web, ale jeho poloha ve stavu R je označena „duchem“ F6P (šedá; zobrazeno kliknutím na „web F6P“).
Co se stane s centrálním polypeptidovým spirálovým segmentem (zbytky 149-164) v přechodu R na T? Co to dělá s relativními polohami záporně nabitého Glu 161 a kladně nabitého Arg 162? Klikněte na „web F6P“. Jaký vliv by měla absence kladného náboje Arg 162 na vazbu F6P? Vysvětluje to, alespoň částečně, proč T stát PFK má nízkou afinitu k F6P? Přejít na zobrazení 2: Detailní, pro Detailní záběr interakcí F6P-sidechain. Vycentrujte molekuly výběrem “ pickcenter „z nabídky“ Nástroje “ a kliknutím na atomu, který chcete být ve středu. Posunutím posuvníku „zoom“ zvětšíte pohled.
Site-Directed Mutageneze
najednou, záporný náboj, Glu 161 bylo vidět, že mají negativní vliv na F6P závazné v T stavu. Tato myšlenka nebyla podporována experimenty s mutagenezí zaměřenými na místo. Bylo vyrobeno několik mutantních PFK, včetně R162A, E161A a R162A/E161A. mutace R162A způsobila 30násobné snížení vazby F6P. Mutace E161A však měla malý vliv na schopnost PEP inhibovat vazbu F6P.
onemocnění
dědičné erytrocyty deficit PFK je spojen s myopatií a hemolýzou (Taruiho choroba).
3D struktury PFK
3D struktury Fosfofruktokinázy
Leave a Reply