7.2: Chymotrypsin
Einleitung
Chymotrypsin ist aufgrund seiner Zweiphasenkinetik eines der am meisten untersuchten Enzyme: Pre-Steady-State und Steady State. Die Untersuchung dieser beiden kinetischen Zustände gibt Hinweise auf den „Ping-Pong“ -Mechanismus, die Bildung kovalenter Komplexe, die zu kovalenten Hydrolysereaktionen führen, und die Geschwindigkeit der katalysierten Reaktionen. Die Synthese von Chymotrypsin erfolgt hauptsächlich in der Bauchspeicheldrüse. Anstelle der aktiven Form wird es jedoch als inaktives Zymogen namens Chymotrypsinogen produziert, um zu verhindern, dass seine Proteaseaktivität die Bauchspeicheldrüse verdaut. Bei der Sekretion in das Lumen des Dünndarms wird es durch ein anderes Enzym namens Trypsin in seine aktive Form umgewandelt. Diese Abhängigkeit eines anderen Enzyms für die Aktivierung einer Protease ist ein üblicher Weg für den Körper, die Verdauung von Organen und andere schädliche enzymatische Nebenwirkungen zu verhindern.
Chymotrypsin arbeitet durch einen allgemeinen Mechanismus, der als Ping-Pong-Mechanismus bekannt ist (Abbildung \(\pageIndex{1}\)), wobei das Enzym mit einem Substrat reagiert, um ein Enzymzwischenprodukt zu bilden. Um die anfängliche enzymatische Aktivität zu regenerieren, muss es mit einem sekundären Substrat reagieren. Dieser Vorgang ist unten dargestellt:

Genauer gesagt arbeitet Chymotrypsin durch eine bestimmte Art von Ping-Pong-Mechanismus, der als kovalente Hydrolyse bezeichnet wird. Dies bedeutet, dass das Enzym zuerst eine kovalente Bindung mit dem Zielsubstrat eingeht und die stabilere Einheit in Lösung verdrängt. Dieser Enzym-Substrat-Komplex wird als Enzym-Intermediat bezeichnet. Das Zwischenprodukt reagiert dann mit Wasser, das den verbleibenden Teil des Ausgangssubstrats verdrängt und das Ausgangsenzym reformiert.

Chymotrypsin ist wie die meisten Enzyme spezifisch für die Arten von Substraten, mit denen es reagiert. Als Protease spaltet es Polypeptide und seine inhärente Spezifität ermöglicht es ihm, nur auf das Carboxyterminal aromatischer Reste einzuwirken. Es ist ein etwas komplizierter Mechanismus und wird am besten in einer Reihe von Schritten erklärt.
1. Das Ziel tritt in das aktive Zentrum von Chymotrypsin ein und wird dort durch hydrophobe Wechselwirkungen zwischen exponierten unpolaren Gruppen von Enzymresten und der unpolaren aromatischen Seitenkette des Substrats gehalten. Es ist wichtig, die Wasserstoffbindung zwischen dem Schiff-Stickstoff auf Histidin-57 und der Sauerstoffseitenkette von Serin-195 zu beachten.
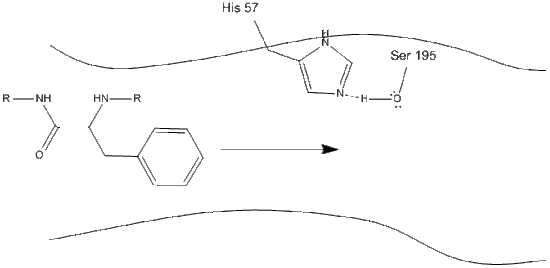
2. Unterstützt durch die Histidin-Serin-Wasserstoffbindung führt die Hydroxylgruppe auf Serin-195 einen nukleophilen Angriff auf den Carbonylkohlenstoff einer aromatischen Aminosäure durch, während gleichzeitig der Hydroxylwasserstoff auf den Histidin-Schiff-Stickstoff übertragen wird. Dieser Angriff drückt die pi-Carbonylelektronen auf den Carbonylsauerstoff und bildet ein kurzlebiges Zwischenprodukt, das aus einem c-terminalen Kohlenstoff mit vier Einfachbindungen besteht: ein Sauerstoffanion, der Beta-Kohlenstoff der aromatischen Aminosäure, der n-Terminus der nachfolgenden Aminosäure des Substratproteins und der Serin-195-Seitenkettensauerstoff.
.gif?revision=1&size=bestfit&width=720&height=192)
3. Dieses Zwischenprodukt ist kurzlebig, da die Oxyanion-Elektronen die Pi-Bindung mit dem c-Terminus der aromatischen Aminosäure reformieren. Die Bindung zwischen dem Carboxyterminus der aromatischen Aminosäure und dem n-Terminus des nachfolgenden Restes wird gespalten, und seine Elektronen werden verwendet, um den Wasserstoff des protonierten Schiff-Stickstoffs auf Histidin-57 zu extrahieren. Die Bindungen zwischen dem Carbonylkohlenstoff und dem Serin-195-Sauerstoff bleiben in einer Esterkonfiguration. Dies wird als Acyl-Enzym-Intermediat bezeichnet. Die c-terminale Seite des Polypeptids ist nun frei, sich vom aktiven Zentrum des Enzyms zu dissoziieren.

4. Wassermoleküle können nun durch Wasserstoffbindung zwischen den Wasserstoffatomen des Wassers und dem Histidin-57-Schiff-Stickstoff in das aktive Zentrum eintreten und daran binden.

5. Der Wassersauerstoff führt nun einen nukleophilen Angriff auf den Carbonylkohlenstoff des Acylenzym-Intermediats durch und drückt die Pi-Elektronen des Carbonyls auf den Carbonylkohlenstoff, während Histidin-57 ein Proton aus Wasser extrahiert. Dies bildet einen weiteren quartären Kohlenstoff, der kovalent mit Serin, einer Hydroxylgruppe, einem Oxyanion und der aromatischen Aminosäure gebunden ist. Das Proton auf dem kürzlich protonierten Histidin-57 kann nun eine Wasserstoffbindung mit dem Serinsauerstoff eingehen.

6. Die Oxyanion-Elektronen reformieren die Carbonyl-Pi-Bindung und spalten die Bindung zwischen dem Carbonylkohlenstoff und dem Serinhydroxyl. Die Elektronen in dieser Bindung werden vom Serinsauerstoff verwendet, um den Histidin-Schiff-Stickstoff zu deprotonieren und das ursprüngliche Enzym zu reformieren. Das Substrat hat keine Affinität mehr zum aktiven Zentrum und dissoziiert bald vom Komplex.
Leave a Reply