8.5: Rezeptor-Tyrosinkinasen (RTKs)
Rezeptor-Tyrosinkinasen vermitteln Reaktionen auf eine große Anzahl von Signalen, einschließlich Peptidhormonen wie Insulin und Wachstumsfaktoren wie epidermal Growth factor. Wie die GPCRs binden Rezeptor-Tyrosinkinasen ein Signal und leiten die Nachricht dann durch eine Reihe intrazellulärer Moleküle weiter, von denen das letzte auf Zielproteine einwirkt, um den Zustand der Zelle zu verändern.
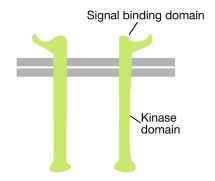
Wie der Name schon sagt, ist eine Rezeptor-Tyrosinkinase ein Zelloberflächenrezeptor, der auch eine Tyrosinkinase-Aktivität aufweist. Die Signalbindungsdomäne der Rezeptor-Tyrosinkinase befindet sich auf der Zelloberfläche, während die enzymatische Aktivität der Tyrosinkinase im zytoplasmatischen Teil des Proteins liegt (siehe Abbildung oben). Eine Transmembran-Alpha-Helix verbindet diese beiden Regionen des Rezeptors.
Was passiert, wenn Signalmoleküle an Rezeptor-Tyrosinkinasen binden?
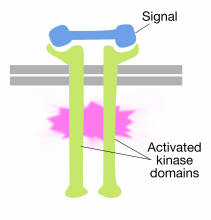
Die Bindung von Signalmolekülen an die extrazellulären Domänen von Rezeptor-Tyrosinkinase-Molekülen verursacht zwei rezeptormoleküle zu dimerisieren (zusammenkommen und assoziieren). Dies bringt die zytoplasmatischen Schwänze der Rezeptoren nahe aneinander und bewirkt, dass die Tyrosinkinaseaktivität dieser Schwänze eingeschaltet wird. Die aktivierten Schwänze phosphorylieren sich dann an mehreren Tyrosinresten. Dies nennt man Autophosphorylierung.
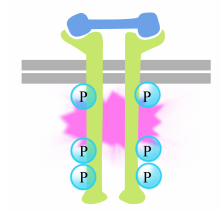
Die Phosphorylierung von Tyrosinen an den Rezeptorschwänzen löst den Aufbau eines intrazellulären Signalkomplexes an den Rezeptorschwänzen schwänze. Die neu phosphorylierten Tyrosine dienen als Bindungsstellen für Signalproteine, die die Botschaft dann an weitere Proteine weitergeben. Ein wichtiges Protein, das anschließend durch die Signalkomplexe an den Rezeptor-Tyrosinkinasen aktiviert wird, heißt Ras.
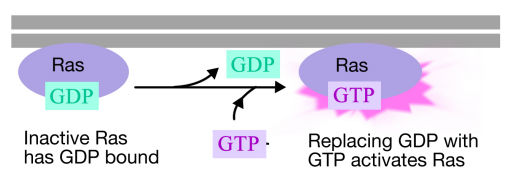
Das Ras-Protein ist ein monomeres Guaninnukleotid-bindendes Protein, das mit der cytosolischen Oberfläche der Plasmamembran assoziiert ist (tatsächlich ähnelt es der Alpha-Untereinheit von trimeren G-Proteinen). Genau wie die Alpha-Untereinheit eines G-Proteins ist Ras aktiv, wenn GTP daran gebunden ist, und inaktiv, wenn GDP daran gebunden ist.Wie die Alpha-Untereinheit kann Ras auch das GTP zu BIP hydrolysieren.
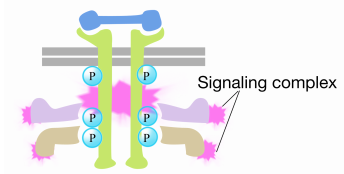
Wenn ein Signal an der Rezeptor-Tyrosinkinase ankommt, kommen die Rezeptormonomere zusammen und phosphorylieren die Tyrosine der anderen, wodurch der Aufbau eines Proteinkomplexes am zytoplasmatischen Schwanz des Rezeptors ausgelöst wird. Eines der Proteine in diesem Komplex interagiert mit Ras und stimuliert den Austausch des an das inaktive Ras gebundenen GDP gegen ein GTP. Dadurch wird das Ras aktiviert.
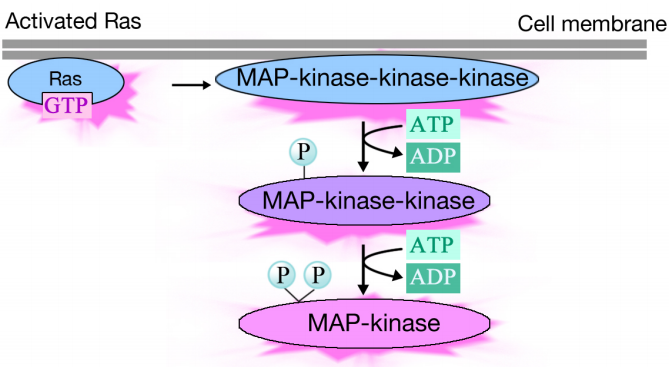
Aktiviertes Ras löst eine Phosphorylierungskaskade von drei Proteinkinasen aus, die das Signal weiterleiten und verteilen. Diese Proteinkinasen sind Mitglieder einer Gruppe namens MAP-Kinasen (Mitogen Activated Protein Kinases). Die letzte Kinase in dieser Kaskade phosphoryliert verschiedene Zielproteine, einschließlich Enzyme und Transkriptionsaktivatoren, die die Genexpression regulieren.Die Phosphorylierung verschiedener Enzyme kann ihre Aktivitäten verändern und neue chemische Reaktionen in der Zelle auslösen, während die Phosphorylierung transkriptioneller Aktivatoren die Expression von Genen verändern kann. Der kombinierte Effekt von Veränderungen der Genexpression und der Proteinaktivität verändert den physiologischen Zustand der Zelle.
Noch einmal, wenn man dem Weg der Signaltransduktion folgt, der durch RTKs vermittelt wird, ist es möglich, das gleiche grundlegende Muster von Ereignissen zu erkennen: ein Signal wird von den extrazellulären Domänen der Rezeptor-Tyrosinkinasen gebunden, was zu einer Rezeptordimerisierung und Autophosphorylierung der cytosolischen Schwänze führt, wodurch die Botschaft in das Innere der Zelle übertragen wird.
Die Nachricht wird über einen Signalkomplex an Ras weitergeleitet, das dann eine Reihe von Kinasen stimuliert. Die terminale Kinase in der Kaskade wirkt auf Zielproteine und bewirkt Veränderungen der Proteinaktivitäten und der Genexpression.
Die obigen Beschreibungen geben eine sehr einfache Skizze einiger der Hauptklassen von Rezeptoren und befassen sich hauptsächlich mit den mechanistischen Details der Schritte, mit denen Signale, die von verschiedenen Arten von Rezeptoren empfangen werden, Veränderungen in Zellen bewirken. Eine wichtige Lektion zum Mitnehmen ist die wesentliche Ähnlichkeit der verschiedenen Wege.
Ein weiterer zu beachtender Punkt ist, dass, während wir jeden einzelnen Signalweg isoliert betrachtet haben, eine Zelle zu einem bestimmten Zeitpunkt mehrere Signale empfängt, die eine Vielzahl unterschiedlicher Reaktionen gleichzeitig auslösen. Die oben beschriebenen Wege zeigen ein beträchtliches Maß an „Übersprechen“ und die Reaktion auf ein bestimmtes Signal wird durch die anderen Signale beeinflusst, die die Zelle gleichzeitig empfängt. Die Vielzahl unterschiedlicher Rezeptoren, Signale und deren Kombinationen sind die Mittel, mit denen Zellen auf eine enorme Vielfalt unterschiedlicher Umstände reagieren können.
Mitwirkende
-
Dr. Kevin Ahern und Dr. Indira Rajagopal (Oregon State University)
Leave a Reply