Die GINA-Richtlinien 2019 für die Asthmabehandlung bei Erwachsenen
US Pharm. 2020;45(7/8):18-24.ZUSAMMENFASSUNG: Die Etablierung einer Asthmasymptomkontrolle mit pharmakologischen und nicht-pharmakologischen Interventionen verbessert die Lebensqualität und beugt Exazerbationen bei Patienten mit Asthma vor. Die Richtlinien der Global Initiative for Asthma 2019 enthalten Empfehlungen für die Asthmabehandlung, die in fünf Schritte unterteilt sind, die mit dem Schweregrad der Erkrankung korrelieren. Zu den Medikamentenoptionen gehören inhalative Kortikosteroide (ICS), langwirksame Beta2-Agonisten, kurzwirksame Beta2-Agonisten (SABAs), Leukotrienrezeptorantagonisten und orale Kortikosteroide. Jüngste Daten zeigen ungünstige Ergebnisse für SABAs allein zur bedarfsgerechten Behandlung von Symptomen von leichtem Asthma. Richtlinienänderungen umfassen die Verwendung eines niedrig dosierten ICS mit Formoterol zur bedarfsgerechten Behandlung bei Erwachsenen mit leichtem Asthma oder zur Verwendung bei Verwendung eines SABA. Geeignete, wirksame Medikationsschemata in Kombination mit einer Beratung zur richtigen Inhalationstechnik helfen den Patienten, Asthma-Management-Ziele zu erreichen.Asthma, eine chronisch entzündliche Atemwegserkrankung, die durch eine Überempfindlichkeit der Atemwege gekennzeichnet ist, kann Symptome wie Keuchen, Atemnot, Engegefühl in der Brust und Husten aufweisen.1 Diese Symptome können im Laufe der Zeit und in der Intensität variieren, was eine wirksame Behandlung von Asthma wichtig macht. Symptomauslöser können Bewegung, virale Infektionen der Atemwege und Umweltfaktoren wie Rauchen sein. Unbehandelte Symptome können zu Exazerbationen führen. Eine Exazerbation ist eine akute Episode, in der sich die Symptome drastisch verschlechtern und die Lungenfunktion progressiv abnimmt. Jedes Auftreten einer Exazerbation rechtfertigt eine Diskussion über das aktuelle Asthmabehandlungsschema des Patienten aufgrund der Risiken von Krankenhausaufenthalten, Notfallbesuchen und asthmabedingtem Tod.
Die Richtlinien der Global Initiative for Asthma (GINA) von 2019 empfehlen nicht die Verwendung eines kurzwirksamen Beta2-Agonisten (SABA) -Inhalators allein zur Behandlung von leichtem Asthma; stattdessen empfehlen sie niedrig dosiertes inhalatives Kortikosteroid (ICS) -Formoterol nach Bedarf und zur Erhaltungstherapie.2 Bei Patienten mit schwerem oder schwer behandelbarem Asthma können andere Optionen als Zusatz zur Inhalationstherapie in Betracht gezogen werden, z. B. Leukotrienrezeptorantagonisten (LTRAs), Tiotropium, Biologika, Azithromycin und orale Kortikosteroide (OCS).
Asthmakontrolle bezeichnet das Ausmaß, in dem Asthmamerkmale beim Patienten beobachtet werden können oder durch Behandlung reduziert oder beseitigt wurden.2 Die Asthmakontrolle sollte in den letzten 4 Wochen überprüft werden. Dem Patienten sollten folgende Fragen gestellt werden: „Hatten Sie in den letzten 4 Wochen: 1) Asthmasymptome tagsüber mehr als zweimal pro Woche? 2) nächtliches Erwachen aufgrund von Asthma? 3) um ein Asthma-Mittel für Symptome mehr als zweimal pro Woche zu verwenden? 4) irgendwelche Aktivitätseinschränkungen aufgrund von Asthma?“ Wenn der Patient alle vier Fragen mit „Nein“ beantwortet, ist sein Asthma gut kontrolliert. Wenn der Patient eine oder zwei der Fragen mit „Ja“ beantwortet, ist das Asthma teilweise kontrolliert, aber wenn die Antwort auf drei bis vier der Fragen mit „Ja“ lautet, ist das Asthma nicht gut kontrolliert.2 Zu den Risikofaktoren, die eine Verschlimmerung verursachen können, gehören unkontrolliertes Asthma, Rauchen, Allergenexposition, Luftverschmutzung, Begleiterkrankungen wie Fettleibigkeit und hoher SABA-Konsum.
Die Beurteilung der Einhaltung der inhalativen Medikation des Patienten ist ein weiterer wichtiger Schritt. Es gibt eine Vielzahl von Gründen, dass ein Patient möglicherweise nicht an Asthmamedikamenten festhält, einschließlich Schwierigkeiten bei der Verwendung von Inhalationsgeräten, Medikamentenkosten, Vergesslichkeit, Nichtverstehen der vorgeschriebenen Anweisungen und der Wahrnehmung, dass das Medikament nicht erforderlich ist.2
MANAGEMENT UND BEHANDLUNG
Zu den Zielen der Asthmatherapie gehört die Kontrolle der Symptome zur Aufrechterhaltung eines normalen Aktivitätsniveaus, die Verhinderung einer anhaltenden Einschränkung des Luftstroms und die Verringerung der Nebenwirkungen der in TABELLE 1 beschriebenen Medikamente. Pharmakologische und nicht-pharmakologische Interventionen reduzieren das Risiko zukünftiger Exazerbationen, die zu Krankenhausaufenthalten oder asthmabedingten Todesfällen führen.2
Nonpharmacologic Management
Nonpharmacologic Interventionen für alle Asthmapatienten umfassen Atemübungen, erhöhte körperliche Aktivität, die Einbeziehung einer gesunden Ernährung und die Vermeidung der Exposition gegenüber Rauch und anderen Substanzen.2 Die Praxis von Yoga und Atemmethoden wie den Buteyko- und Papworth-Techniken verändert die Atemmuster, um die Hyperventilation zu reduzieren, wodurch die freiwillige Reduzierung des Reliever-Einsatzes gefördert und die Asthmasymptome verbessert werden.3 Bei adipösen Patienten ist Gewichtsverlust in Kombination mit zweimal wöchentlichen Aerobic- und Kraftübungen wirksamer als körperliche Aktivität allein zur Symptomkontrolle.2 Die Beratung zur richtigen Inhalationstechnik hilft den Patienten, Asthma-Management-Ziele zu erreichen.
Pharmakologisches Management
Durch den kontrollbasierten Asthma-Managementzyklus, der in ABBILDUNG 1 dargestellt ist, werden Anpassungen an Asthma-Medikationsschemata vorgenommen.2
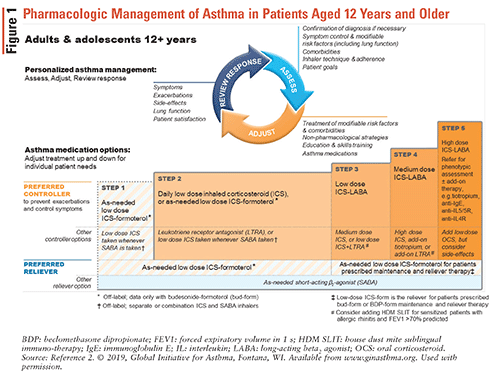
Sobald eine Diagnose von Asthma gestellt wurde, sollte eine ICS-haltige Controller-Behandlung eingeleitet werden, da sich die Lungenfunktion stärker verbessert als wenn keine ICS-Controller-Behandlung angewendet wird. Dies ist eine wichtige Änderung in den GINA-Richtlinien von 2019, da zuvor empfohlen wurde, neu diagnostizierten Patienten nur eine SABA zu verabreichen. Der ICS-Formoterol-Kombinationsinhalator ist die bevorzugte bedarfsgerechte Reliever-Therapie, unabhängig von der Schwere des Asthmas. Die alternative Reliever-Therapie ist ein SABA; es muss jedoch mit einem zweiten Inhalator gepaart werden, der ICS enthält. ICS-Formoterol-Inhalatoren sind sicher und wirksam, und ihre Fähigkeit, sowohl bei Bedarf als auch für die Erhaltungstherapie verwendet zu werden, macht sie für Patienten einfach zu verwenden.2
GINA empfiehlt die folgenden Asthma-Behandlungsschritte2:
• Schritt 1: Dieser Schritt wird für Patienten mit leichtem Asthma empfohlen, die weniger als zweimal im Monat Symptome haben und kein Risiko für Exazerbationen haben. Wie bereits erwähnt, empfehlen die GINA-Richtlinien von 2019 aufgrund neuer Erkenntnisse nicht mehr die alleinige Anwendung von SABA zur Behandlung von Asthma.
* Schritt 2: Das bevorzugte Kontrollregime ist nach Bedarf niedrig dosiertes ICS-Formoterol oder täglich niedrig dosiertes ICS plus nach Bedarf SABA. Das ICS-Formoterol-Regime vermeidet den Bedarf an täglichem ICS und bietet ähnliche Vorteile für belastungsinduzierte Bronchokonstriktion wie tägliches ICS mit bedarfsgerechtem SABA.
• Schritt 3: Bevorzugte Controller-Behandlungen umfassen einen niedrig dosierten ICS-langwirksamen Beta2-Agonisten (LABA) plus nach Bedarf SABA oder niedrig dosiertes ICS-Formoterol sowohl für die Erhaltungs- als auch für die Reliever-Therapie.
* Schritt 4: Die bevorzugte Controller-Behandlung ist niedrig dosiertes ICS-Formoterol als Erhaltungs- und Reliever-Therapie oder mitteldosiertes ICS-LABA als Erhaltungs- plus bedarfsgesteuertes SABA. Beachten Sie, dass ICS-Formoterol nicht mit einem ICS-LABA kombiniert werden sollte, das ein anderes LABA enthält.
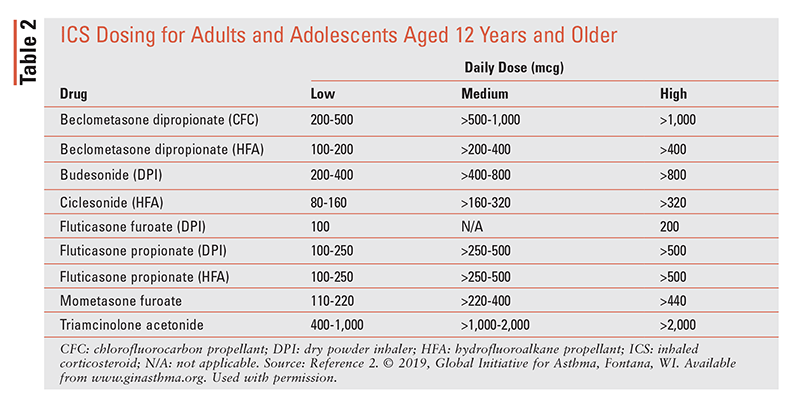
• Schritt 5: Anhaltende Exazerbationen oder Symptomverschlechterungen treten trotz Einhaltung und korrekter Inhalationstechnik auf. Diese Patienten gelten als schweres oder schwer zu behandelndes Asthma und sollten an einen Lungenarzt überwiesen werden.Eine Intensivierung der oben beschriebenen Stadien ist angebracht, wenn Patienten trotz niedrig dosierter ICS-Behandlung für 2 bis 3 Monate anhaltend schlechte Symptomkontrolle oder Exazerbationen haben. Ein Absetzen ist angebracht, wenn der Patient eine gute Symptomkontrolle und eine stabile Lungenfunktion für mindestens 3 Monate hat. Optionen für das Absetzen hängen davon ab, welche Medikamente der Patient einnimmt und welchen Schritt der Patient macht, aber für die meisten Patienten ist das Ergebnis schlechter, wenn das ICS oder LABA vollständig gestoppt wird.2 Die ICS-Dosierung ist in TABELLE 2 dargestellt.
Die Symptome können mit Tools wie dem Asthma Control Questionnaire, dem Asthma Control Test und den drei Fragen des Royal College of Physicians beurteilt werden.2 Diese Fragebögen ermöglichen die Zuordnung eines Scores zu Symptomen und fragen die Patienten nach Häufigkeit und Arten von Symptomen wie nächtlichem Erwachen und Einschränkungen bei täglichen Aktivitäten.
Exazerbationen
Der Begriff Asthma-Exazerbation bezieht sich auf die akute Verschlechterung der Lungenfunktion und der Symptome, die über das hinausgehen, was der Patient normalerweise erlebt. Die bevorzugte Reliever-Behandlung während einer Exazerbation ist niedrig dosiertes ICS-Formoterol, das bei Bedarf erhöht werden kann, wenn sich die Symptome verschlimmern. Die Verwendung eines ICS-LABA (Beclomethason oder Budesonid und Formoterol) als Reliever- und Controller-Medikament verbessert die Symptomkontrolle und reduziert Krankenhausaufenthalte und OCS-Einsatz im Vergleich zur gleichen oder höheren Dosis eines Controllers plus nach Bedarf SABA.4
Ein kurzer OCS-Kurs ist eine Behandlungsoption während einer Exazerbation, wenn der Patient nach 2 bis 3 Tagen nicht auf eine erhöhte Dosis von Reliever und Controller anspricht, plötzliche schwere Exazerbationen in der Vorgeschichte aufweist oder sich die Lungenfunktion schnell verschlechtert (maximaler Exspirationsfluss oder erzwungenes Exspirationsvolumen in 1 Sekunde <60% der persönlichen Bestleistung oder des vorhergesagten Wertes).4
Nebenwirkungen von Asthmamedikamenten
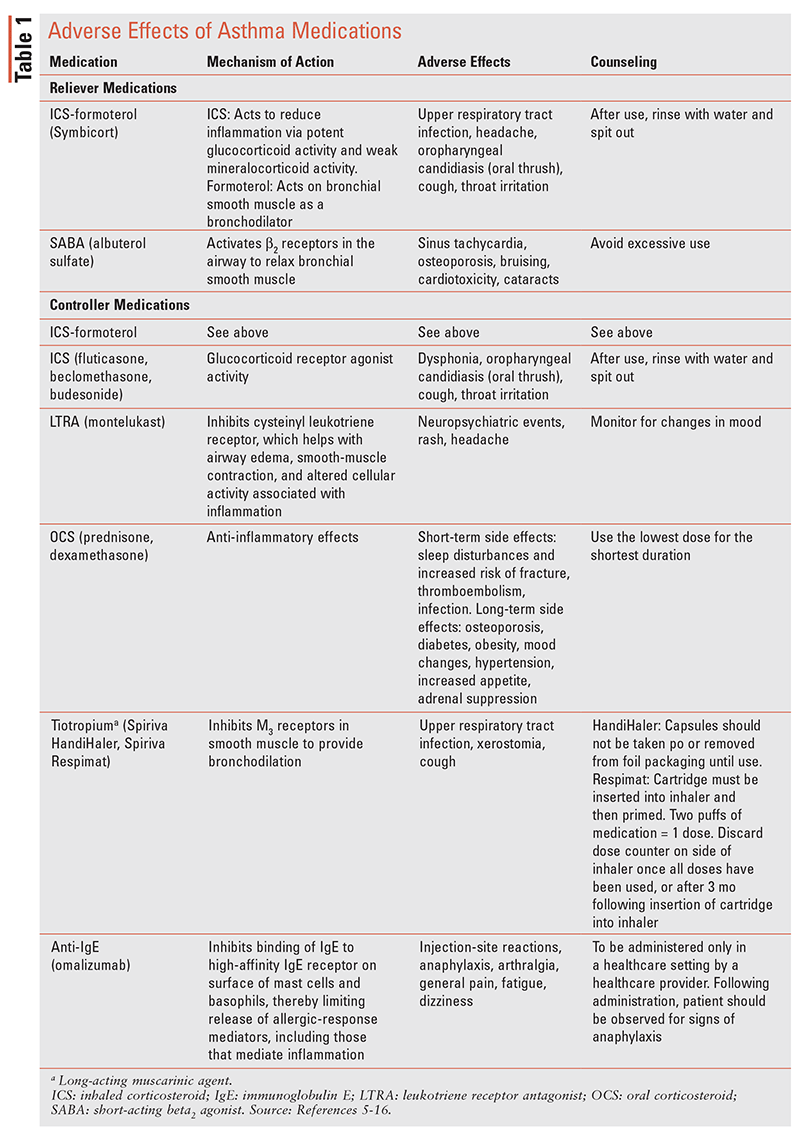
Eine Zusammenfassung der Nebenwirkungen verschiedener Asthmamedikamente finden Sie in TABELLE 1.5-16
SCHWERES ODER SCHWER zu BEHANDELNDES ASTHMA
Schweres oder schwer zu behandelndes Asthma bezieht sich auf unkontrolliertes Asthma in den Behandlungsschritten 4 und 5 trotz angemessener Einhaltung der Behandlung und Behandlung von beitragenden Faktoren. Nach der ersten Beurteilung werden Patienten ab 12 Jahren mit unzureichend kontrolliertem Asthma, die ein mitteldosiertes ICS plus LABA und / oder einen dritten Controller wie LTRA oder Theophyllin mit verzögerter Freisetzung einnehmen, für 3 bis 6 Monate auf eine Studie mit einem hochdosierten ICS umgestellt. Zusätzlich zur Erhöhung des ICS kann ein Versuch mit einem nicht-biologischen Zusatz wie Tiotropium, einem Leukotrien-Modifikator oder OCS in Betracht gezogen werden. Für erwachsene Patienten, die trotz moderater oder hochdosierter ICS und LABA anhaltende Asthmasymptome haben, empfehlen die GINA-Richtlinien 2019 Azithromycin als Add-On.17
Wenn Nichtbiologika wie LABA-, Tiotropium- und Leukotrien-Modifikatoren die Asthmasymptome eines Patienten nicht bewältigen können, können Biologika je nach Preis und Ressourcen des Patienten in Betracht gezogen werden. Eine Anti-Immunglobulin-E-Therapie wie Omalizumab kann bei Patienten mit allergischem Asthma in Betracht gezogen werden. Für den Fall, dass Biologika für einen Patienten keine Option sind, kann ein OCS in einer Dosierung von 7,5 mg oder weniger pro Tag Prednisonäquivalent in Betracht gezogen werden. OCS sind jedoch mit erheblichen Nebenwirkungen wie Osteoporose, Fettleibigkeit, Diabetes, Katarakten, Bluthochdruck und Nebennierensuppression verbunden und sollten daher als letzte Zeile betrachtet werden.17
STUDIEN
Eine von O’Byrne und Kollegen durchgeführte Doppelblindstudie untersuchte den Nutzen der Verwendung eines ICS plus eines SABA im Vergleich zur konventionellen Behandlung.18 Insgesamt 3.849 Patienten im Alter von 12 Jahren oder älter mit leichtem Asthma wurden randomisiert Terbutalin (zweimal täglich Placebo plus Terbutalin 0,5 mg prn), Budesonid-Formoterol (zweimal täglich Placebo plus Budesonid-Formoterol 200 mcg / 6 mcg prn) oder Budesonid-Wartung (zweimal täglich Budesonid 200 mcg plus Terbutalin prn). Das Hauptziel bestand darin, festzustellen, ob Budesonid-Formoterol nach Bedarf dem Terbutalin nach Bedarf zur Symptomkontrolle überlegen war. Dieses Ergebnis wurde anhand von Daten aus einem elektronischen Symptomtagebuch gemessen.
Budesonid-Formoterol nach Bedarf war in Bezug auf die Kontrolle der Asthmasymptome im Vergleich zu Terbutalin nach Bedarf bei Patienten mit leichtem Asthma überlegen. Budesonid-Formoterol-Patienten zeigten für 34,4% der Wochen ein gut kontrolliertes Asthma gegenüber 31,1% der Wochen in der Terbutalin-Gruppe (P = .046). Terbutalin war mit der höchsten jährlichen Rate schwerer Exazerbationen assoziiert (0.20) im Vergleich zu Budesonid-Formoterol (0,07) und Budesonid-Wartung (0,09). Ein Vorteil der Anwendung von Budesonid-Formoterol bestand darin, dass die Exposition gegenüber Kortikosteroiden aufgrund der um 17% niedrigeren Budesoniddosis in dieser Gruppe im Vergleich zur Budesonid-Erhaltungsgruppe (57 mcg vs. 340 mcg) reduziert wurde.18
Bateman und Kollegen untersuchten die Wirksamkeit einer inhalativen Glukokortikoidkomponente mit einem schnell wirkenden Mittel gegen leichtes Asthma.5 Diese 52-wöchige, doppelblinde, multizentrische Studie umfasste 4.215 Patienten mit leichtem Asthma im Alter von 12 Jahren und älter, die für eine Behandlung mit regelmäßig inhalierten Glukokortikoiden in Frage kamen. Die Teilnehmer wurden in zwei Gruppen eingeteilt, um zu beurteilen, ob die zweimal tägliche Budesonid-Formoterol- oder Budesonid-Erhaltungstherapie bei Bedarf eine bessere Wirksamkeit in Bezug auf die jährlichen Raten schwerer Exazerbationen aufweist. Die Budesonid-Formoterol-Gruppe war der Budesonid-Erhaltungsgruppe bei schweren Exazerbationen nicht unterlegen. Darüber hinaus war die mediane tägliche Dosierung von inhalativem Glucocorticoid in der Budesonid-Formoterol-Gruppe (66 mcg) niedriger als in der Budesonid-Erhaltungsgruppe (267 mcg). Die Zeit bis zur ersten Exazerbation war zwischen den Gruppen ähnlich; Es gab jedoch einen Unterschied von 0, 11 U zugunsten der Budesonid-Erhaltungsgruppe, die im Vergleich zur Budesonid-Formoterol-Gruppe niedrigere Werte im Asthma Control Questionnaire-5 (ACQ-5) aufwies. Der minimale klinisch wichtige Unterschied in den ACQ-5-Scores beträgt 0,5 U. Darüber hinaus gab es keinen Unterschied in Bezug auf unerwünschte Ereignisse, asthmabedingte Abbrüche oder Mortalitätsraten zwischen den beiden Gruppen. Diese Studie und die O’Byrne-Studie unterstützen die aktuelle GINA-Empfehlung von 2019 gegen die Verwendung eines SABA allein und für die Verwendung von ICS-Formoterol stattdessen.Eine Studie von Gibson und Kollegen untersuchte die Wirksamkeit und Sicherheit von oralem Azithromycin als Add-on-Therapie bei Patienten mit unkontrolliertem persistierendem Asthma, die auch ein mittel- oder hochdosiertes ICS plus ein LABA einnahmen.17 In dieser randomisierten, doppelblinden, placebokontrollierten Parallelgruppenstudie wurden 420 Patienten randomisiert einer von zwei Behandlungsgruppen zugeordnet (Azithromycin 500 mg oder Placebo dreimal pro Woche für 48 Wochen). Zu den primären Wirksamkeitsendpunkten gehörten die Rate der gesamten (schweren und mittelschweren) Asthma-Exazerbationen und die allgemeine asthmabedingte Lebensqualität über den Studienzeitraum.
In der Gibson-Studie wurde festgestellt, dass Azithromycin Asthma-Exazerbationen reduziert; 44% der Azithromycin-Patienten erlebten mindestens eine Exazerbation, verglichen mit 61% der Placebo-Patienten (P <.0001). Darüber hinaus hat die Verwendung von Azithromycin die asthmabedingte Lebensqualität signifikant verbessert, was durch eine Verbesserung in allen Kategorien der Bewertungsskala (d. H. Aktivität, Symptom, Emotion und Umweltdomänen) für die asthmabedingte Lebensqualität gekennzeichnet ist. Der einzige andere bemerkenswerte Unterschied zwischen den Studiengruppen bestand im Auftreten von Durchfall, der bei Azithromycin-Patienten signifikant höher war (34% gegenüber 19% der Placebo-Patienten). Zur Sicherheitsüberwachung wurden EKGs beim Screening, nach 6-wöchiger Behandlung und am Ende der Behandlung durchgeführt. Eine QTc-Verlängerung von mehr als 480 ms führte bei zwei Patienten (einer aus jeder Gruppe) zum Abbruch der Studie.17
ÄNDERUNGEN IN DEN LEITLINIEN 2019
Die Leitlinien 2019 enthalten fünf bemerkenswerte Änderungen in Bezug auf die Asthmabehandlung bei Erwachsenen. Die erste Änderung ist der Wechsel von einer SABA-Only-Behandlung zu einer ICS-haltigen Behandlung zur bedarfsgerechten Behandlung von Symptomen bei leichtem Asthma.4 Die zweite Änderung ist die Verwendung von niedrig dosiertem Azithromycin dreimal pro Woche zur Langzeitbehandlung von Patienten mit symptomatischem Asthma trotz moderater oder hochdosierter ICS-LABA-Behandlung; mögliche unerwünschte Ereignisse sollten jedoch berücksichtigt werden.17
Die dritte Änderung ist die Empfehlung für Dupilumab, einen monoklonalen Anti–Interleukin-4-Rezeptor-Alpha-Antikörper, als zusätzliche Behandlungsoption für Patienten ab 12 Jahren mit schwerem Typ-2-Asthma oder OCS-abhängigem Asthma.19 Eine Studie von Wenzel und Kollegen zeigte, dass Dupilumab die Lungenfunktion erhöhte und schwere Exazerbationen bei Patienten mit unkontrolliertem persistierendem Asthma reduzierte.20
Die vierte Änderung besteht darin, die Behandlung mit hochdosiertem ICS-LABA nur in Schritt 5 aufzunehmen, während sie zuvor in Schritt 4 mit moderat dosiertem ICS-LABA aufgenommen wurde; Dies liegt an der Empfehlung, dass hochdosiertes ICS nur für einige Monate verschrieben werden sollte, basierend auf der Berücksichtigung damit verbundener unerwünschter Ereignisse.17 Die fünfte Änderung ist die Umstellung des Erhaltungs-OCS von einer „bevorzugten“ Behandlungsoption auf eine „andere Behandlungsoption“ in Schritt 5, basierend auf dem hohen Risiko unerwünschter Ergebnisse.19
SCHLUSSFOLGERUNG
Basierend auf neuen Daten empfehlen die aktualisierten GINA-Richtlinien von 2019 nicht die Verwendung eines SABA-Inhalators allein zur Behandlung von leichtem Asthma; Stattdessen wird niedrig dosiertes ICS-Formoterol für die Bedarfs- und Erhaltungstherapie empfohlen. Für Patienten mit schwerem oder schwer zu behandelndem Asthma können andere Optionen als Zusatzbehandlung zur Inhalationstherapie in Betracht gezogen werden, einschließlich LTRA, Tiotropium, Biologika, Azithromycin und OCS. Um eine bessere Einhaltung der Medikamente zu gewährleisten, sollten Asthma-Therapieschemata patientenspezifisch sein, wobei ein schrittweiser Ansatz verfolgt wird, um ein Regime zu finden, das die Asthmasymptome des Patienten kontrolliert und gleichzeitig den Patienten auf der niedrigstmöglichen Dosis hält.
1. Asthma und Allergie-Stiftung von Amerika. Asthma. www.aafa.org/asthma-symptoms . Zugriff am 8. April 2020.
2. Globale Initiative für Asthma. Globale Strategie für Asthma-Management und Prävention, 2019. www.ginasthma.org . Zugriff am 8. April 2020.
3. Santino TA, Chaves GS, Freitas DA, et al. Atemübungen für Erwachsene mit Asthma. Cochrane Database Syst Rev. 2020;3(3):CD001277.
4. O’Byrne PM, FitzGerald JM, Bateman ED, et al. Inhaliertes kombiniertes Budesonid-Formoterol nach Bedarf bei leichtem Asthma. In: N Engl J Med. 2018;378(20):1865-1876.
5. Bateman ED, Reddel HK, O’Byrne PM, et al. Bei Bedarf Budesonid-Formoterol versus Erhaltungsbudesonid bei leichtem Asthma. In: N Engl J Med. 2018;378(20):1877-1887.
6. Symbicort (Budesonid-Formoterol) Packungsbeilage. Wilmington, DE: AstraZeneca Pharmaceuticals LP; Januar 2017.
7. Reed CE. Asthma bei älteren Menschen: Diagnose und Behandlung. In: J Allergy Clin Immunol. 2010;126(4):681-687.
8. ProAir HFA (Albuterol) Packungsbeilage. Frazer, PA: Teva Respiratory, LLC; Februar 2019.
9. Flovent HFA (Fluticason) Packungsbeilage. Research Triangle Park, NC: GlaxoSmithKline; Januar 2019.
10. Singulair (montelukast) Packungsbeilage. Whitehouse Station, NJ: Merck & Co, Inc; April 2020.
11. Waljee AK, Rogers MA, Lin P, et al. Kurzfristige Verwendung von oralen Kortikosteroiden und damit verbundenen Schäden bei Erwachsenen in den Vereinigten Staaten: populationsbasierte Kohortenstudie. BMJ. 2017;357:j1415.
12. Foster JM, McDonald VM, M Guo, Reddel HK. „Ich habe in jeder Facette meines Lebens verloren“: die verborgene Last von schwerem Asthma. Eur bzw. J. 2017;50(3):1700765.
13. Rayos (Prednison) Packungsbeilage. Deerfield, IL: Horizon Pharma, Inc; 2012.
14. Spiriva HandiHaler (Tiotropium) Packungsbeilage. Ridgefield, CT: Boehringer Ingelheim Pharmaceuticals, Inc; Februar 2018.
15. Spiriva Respimat (Tiotropium) Packungsbeilage. Ridgefield, CT: Boehringer Ingelheim Pharmaceuticals, Inc; März 2019.
16. Xolair (Omalizumab) Packungsbeilage. South San Francisco, Kalifornien: Genentech, Inc; Mai 2019.
17. Gibson PG, Yang IA, Upham JW, et al. Wirkung von Azithromycin auf Asthma-Exazerbationen und Lebensqualität bei Erwachsenen mit persistierendem unkontrolliertem Asthma (AMAZES): eine randomisierte, doppelblinde, placebokontrollierte Studie. Lancet. 2017;390(10095):659-668.
18. O’Byrne PM, Barnes PJ, Rodriguez-Roisin R, et al. Niedrig dosiertes inhaliertes Budesonid und Formoterol bei leicht anhaltendem Asthma: die randomisierte OPTIMA-Studie. In: Am J Respir Crit Care Med. 2001;164(8):1392-1397.
19. Castro M, Corren J, Pavord ID, et al. Dupilumab Wirksamkeit und Sicherheit bei mittelschwerem bis schwerem unkontrolliertem Asthma. In: N Engl J Med. 2018;378(26):2486-2496.
20. Wenzel S, Castro M, Corren J, et al. Wirksamkeit und Sicherheit von Dupilumab bei Erwachsenen mit unkontrolliertem persistierendem Asthma trotz Anwendung von mittel- bis hochdosierten inhalativen Kortikosteroiden plus einem langwirksamen Beta2-Agonisten: eine randomisierte, doppelblinde, placebokontrollierte pivotale Phase-2b-Dosisänderungsstudie. Lancet. 2016;388(10039):31-44.
Der Inhalt dieses Artikels dient nur zu Informationszwecken. Der Inhalt soll keine professionelle Beratung ersetzen. Das Vertrauen auf die in diesem Artikel enthaltenen Informationen erfolgt ausschließlich auf eigenes Risiko.
Leave a Reply