Frontiers in Oncology
Introduction
Bei etwa 25% der Brustkrebspatientinnen im Frühstadium kommt es nach aktiver Behandlung immer noch zu Lokalrezidiven und Fernmetastasen (1), und fast 10% der Patientinnen befinden sich bei der Erstdiagnose in den Industrieländern im Stadium IV, das als de novo metastasierter Brustkrebs (MBC) bezeichnet wird (2). Trotz der Fortschritte in der Behandlung bleibt MBC unheilbar, und bis zu 70-80% der MBC-Patienten sterben innerhalb von 5 Jahren an Krebs (2). Aufgrund der Heterogenität von MBC werden mehrere prognostische Modelle entwickelt, die auf prognostischen Faktoren oder Scores basieren, um ihre klinischen Ergebnisse vorherzusagen und Kliniker anzuweisen, geeignete therapeutische Entscheidungen zu treffen (3-5). Darüber hinaus gibt es auch eine Vielzahl von Prognosemodellen für Brustkrebs mit Hirnmetastasen (BCBM), mit denen Kliniker das Überleben bei diesen Patienten genau vorhersagen können (6, 7).Brustkrebs kann überall im Körper metastasieren, metastasiert jedoch hauptsächlich in Lunge, Knochen, Leber, nicht-axillären Lymphknoten und Gehirn (8). Insbesondere Lebermetastasen (LM) sind nicht nur eine häufige Metastasierungsstelle, sondern auch mit einem signifikant erhöhten Sterberisiko verbunden, ähnlich wie Hirnmetastasen, eine überproportional höhere Mortalität im Vergleich zu Lungen- oder Knochenmetastasen (5, 8). Da die Graded Prognostic Assessment (GPA) bei BCBM-Patienten weit verbreitet ist, regen uns die oben genannten Prognosemodelle dazu an, ein praktisches Modell für BCLM vorzuschlagen (3-7). Unser Ziel war es, ein zuverlässiges und benutzerfreundliches Prognosemodell für BCLM zu erstellen und dessen Konkordanz und Genauigkeit durch interne und externe Validierung zu bewerten. Das Prognosemodell könnte Klinikern helfen, das Todesrisiko von BCLM-Patienten abzuschätzen und eine optimale Behandlung auszuwählen.
Patienten und Methoden
Auswahl der Patienten
Die vorliegende Studie wurde von den unabhängigen Ethikkommissionen der FUSCC genehmigt. Konsekutive MBC-Patienten, die von Januar 2007 bis Dezember 2018 bei FUSCC diagnostiziert wurden, wurden identifiziert (n = 9.062). Die Zulassungskriterien waren wie folgt: (1) histologisch bestätigter Brustkrebs, (2) weibliche Patienten, (3) die Leber als erste Stelle metastasierter Erkrankungen bei de novo metastasiertem oder rezidivierendem Brustkrebs und (4) vollständige und detaillierte Aufzeichnungen. Patienten mit bilateralem Brustkrebs, anderen invasiven Neoplasmen oder unbekanntem Follow-up wurden ausgeschlossen. Schließlich wurden 1.022 geeignete Patienten für die weitere Analyse ausgewählt. Die vollständigen Auswahlschritte sind in Abbildung S1 dargestellt.
Untersuchung von Variablen und Auswahl von Cutoff-Werten
Es wurden Informationen zu den folgenden klinisch-pathologischen Variablen gesammelt: alter, molekulare Subtypen, vorherige Behandlungsinformationen (Operation und systemische Chemotherapie), MFI, Stellen extrahepatischer Metastasen (Gehirn, Lunge, Knochen und Lymphknoten), Merkmale der Lebermetastasen (Verteilung, Anzahl, maximaler Durchmesser), Hämoglobin (HB), Leberfunktionstests und Überlebenszeit. Zu den molekularen Subtypen gehörten der Hormonrezeptor (HR) und der humane epidermale Wachstumsfaktorrezeptor 2 (HER2). Wir definierten MFI als das Intervall zwischen dem Datum der Diagnose von primärem Brustkrebs und dem Datum der ersten Fernmetastasierung. Die in dieser Studie verwendeten Cutoff-Punkte von MFI waren 3 und 24 Monate gemäß Referenz (9). Daher konnten die Patienten in drei Gruppen eingeteilt werden: Patienten mit de novo MBC (MFI < 3 Monate), Patienten mit einem kurzen MFI (≤ 24 Monate) und Patienten mit einem langen MFI > 24 Monate. Entfernte Lymphknotenmetastasen wurden definiert als Metastasen aus ipsilateralen axillären, supraklavikulären, infraklavikulären oder inneren Brustlymphknoten. Die Diagnose von LM basierte auf der radiologischen Bildgebung oder pathologischen Beweisen. Merkmale der Lebermetastasen wurden mit Hilfe von abdominaler Computertomographie (CT), Magnetresonanztomographie (MRT) oder chirurgischen Resektionsproben bewertet. In der vorliegenden Studie wurden auch Leberfunktionstests analysiert, einschließlich Gesamtbilirubin, Alaninaminotransferase (ALT), Aspartataminotransferase (AST), alkalische Phosphatase (ALP), Lactatdehydrogenase (LDH) und γ-Glutamyltransferase zu Albumin Verhältnis (GAR). Blutproben wurden innerhalb von 1 Woche nach der Diagnose von LM für Labortests entnommen. Klassifikationen der Verteilung, Anzahl oder des maximalen Durchmessers von Lebermetastasen und LDH basierten auf anderen Studien (10-13). Die Cutoff-Werte für HB, Gesamtbilirubin, ALT, AST und ALP wurden gemäß den Common Terminology Criteria for Adverse Events (CTCAE) bestimmt, da moderate oder Grad-II-Anomalien des Hämoglobinspiegels oder der Leberfunktion die therapeutische Wahl beeinflussen können (14). Der Wert von GAR wurde als einfaches Verhältnis zwischen dem Serumy-Glutamyltransferase (GGT, U / L) -Spiegel und dem Serumalbumin (ALB g / L) -Spiegel definiert. OS ab dem Zeitpunkt der Metastasierung wurde vom Zeitpunkt der Diagnose von LM bis zum Tod aus irgendeinem Grund gemessen. Der letzte Nachbeobachtungszeitraum war November 2019 mit einer medianen Nachbeobachtungszeit von 18,63 Monaten. Wenn Patienten für die Nachsorge verloren gingen, wurde dies am letzten Tag der Nachsorge zensiert.
Statistische Analyse
Die Patienten wurden in das Training (2007-2016, n = 715) und die Validierung (2016-2018, n = 307) im Verhältnis 7:3 eingeteilt. Der optimale Grenzwert für GAR wurde durch die Berechnung des Youden-Index und der ROC-Analyse (Receiver Operating Characteristic Curve) ausgewählt (Abbildung S2). Pearson Chi-Quadrat-Test oder Fisher exakter Test wurde verwendet, um einen Vergleich zwischen kategorialen Variablen zu machen. Cox Proportional Hazards Regressionsmodelle mit der Rückwärtsauswahlmethode wurden für die multivariate Analyse und zur Berechnung von Hazard Ratios verwendet. Die Regressionskoeffizienten wurden durch multivariate Regressionsanalyse berechnet und dann mit 10 multipliziert und gerundet, um die endgültigen prognostischen Werte darzustellen. Bootstrapping wurde für die interne Validierung verwendet. Anschließend wurden zeitabhängige ROC-Kurven und Kalibrierungsdiagramme verwendet, um die Diskriminierung und Kalibrierung dieses Prognosemodells im Validierungssatz zu bewerten. Die Grenzwerte der Risikogruppen wurden durch Röntgenbilder bestimmt (15). Die Überlebensanalyse wurde unter Verwendung von Kaplan-Meier-Überlebenskurven durchgeführt, und Log-Rank-Tests wurden verwendet, um Überlebenskurven zu vergleichen. Alle P-Werte waren zweiseitig und Werte von P < 0,05 wurden als statistisch signifikant angesehen. Die statistische Analyse wurde mit der SPSS-Software (SPSS 20, Chicago, IL, USA) und der R-Software Version 4.0.1 durchgeführt.
Ergebnisse
Merkmale und Beziehung zur Risikostratifizierung
Insgesamt 1.022 in dieser Studie ausgewählte Patienten wurden in Trainings- (n = 715) und Validierungssätze (n = 307) unterteilt. Eine Beschreibung der klinisch-pathologischen Merkmale ist in Tabelle 1 und Tabelle S1 angegeben. In der Trainingsgruppe wurden 126 Patienten (17, 6%) mit de novo MBC und 589 Patienten (82, 4%) mit rezidivierendem MBC diagnostiziert, von denen 297 Patienten (50, 4%) ein kurzes MFI und 292 Patienten (49, 6%) hatten ein langes MFI. Medianes Alter bei der Diagnose von LM war 50 (Bereich 21-87) Jahre mit 617 Patienten (86.3%) jünger als 60 Jahre. Von diesen Patienten betrug der Anteil der HR-positiven und HER2-positiven Patienten 62,2 bzw. 38,0%. Bei rezidivierenden MBC-Patienten wurden fast alle Patienten am Primärtumor operiert (584, 99, 2%) und erhielten eine (neo-) adjuvante Chemotherapie (569, 96, 6%). Muster von Fernmetastasen zeigten, dass die häufigste Stelle extrahepatischer Metastasen Knochen (42,7%) war, gefolgt von entfernten Lymphknoten (36,1%), Lunge (25,6%) und Gehirn (2,9%). Die Lebermetastasen waren durch diffuse Verteilung und kleine Knötchen gekennzeichnet, von denen die meisten multipel waren (≥3 Metastasen, 77, 3%), aber kleine Knötchen (≤3 cm, 59, 4%) und den rechten und linken Lappen betrafen (74, 4%). Im frühen Stadium der LM war die Leberfunktion in unterschiedlichem Maße beeinträchtigt, aber im Allgemeinen mild. Der Anstieg von LDH (36,1%) und GAR (35,9%) schien empfindliche Leberfunktionsindikatoren zu sein, und gemäßigte oder höhere Abnormalitäten bei HB (2,9%), Gesamtbilirubin (2,7%), ALT (3,6%), AST (9,5%) und ALP (3,9%) waren laut CTCAE ungewöhnlich. Im Vergleich zur Niedrigrisikogruppe wiesen die Intermediär- und Hochrisikogruppe eine höhere Rate an HR- und HER2-Negativität, einen kurzen MFI, extrahepatische Metastasen, Lebermetastasen auf Tumorlast und Anomalien des Hämoglobinspiegels oder der Leberfunktion (alle Ps ≤ 0,001), was darauf hindeutet, dass diese Faktoren die Prognose von BCLM beeinflussen könnten.
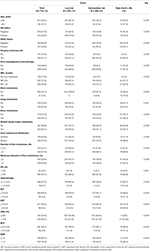
Tabelle 1. Baseline-Merkmale und ihre Beziehung zur Risikostratifizierung des Trainingssatzes.
Prognostisches Modell und Validierung
Im multivariaten Cox-Regressionsmodell wurden molekulare Subtypen (HR- und HER2-Status), MFI, Stellen extrahepatischer Metastasen (Gehirn-, Lungen- und Knochenmetastasen) und Leberfunktionstests (Gesamtbilirubin, LDH und GAR) mit OS assoziiert (Tabelle 2). Insbesondere das Sterberisiko von HR–negativen (HR 1.740, 95% CI 1.424–2.127, P < 0.001) und HER2-negativen (HR 1.615, 95% CI 1.316-1.983, P < 0.001) Patienten stieg im Vergleich zu HR- oder HER2-positiven Gegenstücken an. Die Länge des MFI hatte auch einen signifikanten Einfluss auf das Überleben von BCLM–Patienten, und daher wurde das Überleben von Patienten mit einem langen MFI (HR 1.612, 95% CI 1.195–2.174, P < 0.001) im Vergleich zu Patienten mit de novo MBC und Patienten mit einem kurzen MFI (HR 2.563, 95% CI 1.904-3.449 , P < 0.001) hatte im Vergleich zu ihnen mehr als das doppelte Todesrisiko. Darüber hinaus korrelierten extrahepatische Metastasen (Gehirn-, Lungen- und Knochenmetastasen) und abnormale Leberfunktionen (Gesamtbilirubin, LDH und GAR) mit einem ungünstigen prognostischen Einfluss auf das OS. Dieses prognostische Modell hatte die Fläche unter der Kurve (AUC) des zeitabhängigen ROC bei 1 Jahr OS mit 0,78 im Trainingssatz und 0,80 im Validierungssatz, was darauf hinweist, dass dieses Modell eine gute Diskriminierung aufwies (Abbildung 1). Die Bootstrapping-Methode wurde verwendet, um die Stabilität unseres Prognosemodells im Trainingssatz zu bestätigen, und die Endergebnisse waren ziemlich robust (Tabelle S2). Kalibrierungskurven des prognostischen Modells für 1 Jahr und 3 Jahre OS im Trainingsset sowie 1 Jahr OS im Validierungsset zeigten seine gute Konkordanz (Abbildung 2).

Tabelle 2. Multivariates Cox-Regressionsmodell (Trainingssatz).
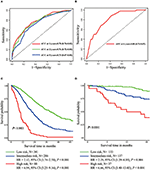
Abbildung 1. Zeitabhängige ROC-Kurven des Prognosemodells im Trainingssatz (A) und im Validierungssatz (B). Gesamtüberleben nach Metastasierung der drei Prognosegruppen im Trainings- (C) und Validierungsset (D).
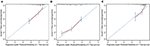
Abbildung 2. Die Kalibrierungskurve zur Vorhersage des Patientenüberlebens nach 1 Jahr (A) und 3 Jahren (B) im Trainingssatz und nach 1 Jahr (C) im Validierungssatz.
Risikostratifizierung und Überleben

Tabelle 3. Berechnung der Score- und Cutoff-Punkte der Prognosegruppen.
Diskussion
In der vorliegenden Analyse von 1.022 Patienten, die von 2007 bis 2018 in unserer Einrichtung behandelt wurden, haben wir gezeigt, dass molekulare Subtypen (HR- und HER2-Status), MFI, Stellen extrahepatischer Metastasen (Gehirn-, Lungen- und Knochenmetastasen), Leberfunktionstests (Gesamtbilirubin, LDH und GAR) unabhängige prognostische Faktoren von BCLM patienten. Daher wurde ein Prognosemodell für BCLM-Patienten unter Verwendung von Prognosefaktoren erstellt.
In Bezug auf molekulare Subtypen kann HR positiv darauf hinweisen, dass das Wachstum und die Proliferation von Brustkrebs immer noch durch Hormone reguliert werden, die als hormonabhängige Tumoren bezeichnet werden. Gleichzeitig hat die endokrine Therapie Vorteile, darunter wenige Nebenwirkungen und lang anhaltende Wirkungen, die HR-positiven Patienten häufig langfristige Überlebensvorteile bringen können. Daher wurde HR-positiv als signifikanter Faktor angesehen, der auf eine günstige Prognose bei frühem und metastasiertem Brustkrebs hindeutet (1, 3-5, 8-10, 16). Obwohl die HER2-Amplifikation und –überexpression als Prädiktor für das Risiko einer Fernmetastasierung und eines brustkrebsbedingten Todes angesehen wird, haben später entwickelte Anti-HER2-Wirkstoffe das Überleben von HER2-positiven Brustkrebspatientinnen bemerkenswert verbessert (2, 9, 17). Im Zeitalter der gezielten Therapie ergab eine Studie im Südosten der Niederlande, dass das Mortalitätsrisiko von HER2-negativen Patienten im Vergleich zu HER2–positiven Patienten um 44% (95% -KI 1, 13-1, 83, P = 0, 003) erhöht war (9). In unserer Studie erhöhte sich das Sterberisiko von HR-negativen und HER2-negativen Patienten im Vergleich zu HR- oder HER2-positiven Patienten, was mit diesen Beobachtungen übereinstimmt. Patienten mit einem kurzen MFI, normalerweise definiert als ≤24 Monate, hatten eine schlechtere Prognose (3, 5, 9). Darüber hinaus schienen de novo MBC-Patienten im Vergleich zu rezidivierenden MBC-Patienten eine signifikant bessere Prognose zu haben, obwohl dieser Unterschied mit der Verlängerung des krankheitsfreien Intervalls (DFI) oder MFI allmählich verringert wurde (9, 18, 19). Lobbezoo et al. gefunden, dass Patienten mit MFI ≤24 Monate hatten signifikant kürzere Überlebenszeit (9,1 vs. 29.4 Monate, P < 0,001) als Patienten mit De-novo-Erkrankungen im Stadium IV, aber Patienten mit einem längeren MFI (>24 Monate) hatten eine ähnliche Prognose (27,9 vs. 29,4 Monate, P = 0,73) (9). Der mögliche Grund für dieses Phänomen ist, dass Patienten mit rezidiviertem MBC, die sich zuvor einer systematischen Therapie unterzogen haben, möglicherweise resistenter gegen Chemotherapie sind als Therapie-naive Patienten mit de novo MBC, aber eine weitere Untersuchung ist gerechtfertigt (9, 18, 19). Diese Studie bestätigte, dass die Überlebenszeit von Patienten mit einem langen MFI im Vergleich zu de novo MBC mit Patienten mit einem kurzen MFI verkürzt war, was zu einem signifikant schlechteren Ergebnis führte.
Das MBC-Überleben unterschied sich signifikant nach Metastasierungsstellen und Patienten mit viszeraler Metastasierung waren mit einem erhöhten Mortalitätsrisiko assoziiert im Vergleich zu Patienten mit nicht-viszeraler Metastasierung (3-5, 9, 18). Darüber hinaus hatte das Vorhandensein von Hirnmetastasen einen größeren Einfluss auf das Überleben als alle anderen metastasierten Stellen (3, 5, 9, 18). Es war nicht überraschend, dass multiple Metastasen die Prognose ungünstiger beeinflussten (3, 5, 9, 17, 18). In dieser Analyse könnte die extrahepatische Metastasierung mit Ausnahme der entfernten Lymphknotenmetastasierung zu einer Verkürzung des Überlebens führen, wahrscheinlich weil die Lebermetastasierung im Vergleich zur Lymphknotenmetastasierung der lebensbedrohlichste Faktor war.Es sollte beachtet werden, dass Patienten mit höheren Bilirubinspiegeln ein viel geringeres Risiko für mehrere Krankheiten hatten, teilweise aufgrund ihrer antioxidativen und entzündungshemmenden Eigenschaften (20). Eine kürzlich durchgeführte Studie berichtete auch, dass bei Brustkrebspatientinnen im Frühstadium mit höherem Gesamtbilirubinspiegel eine Verringerung des Todesrisikos um fast 40% gezeigt wurde (21). Hyperbilirubinämie war jedoch mit einer schlechten Prognose bei BCLM-Patienten verbunden (22). Es ist möglich, dass im Gegensatz zu relativ höherem Gesamtbilirubin bei nicht metastasierendem Brustkrebs Patienten, ein erhöhtes Bilirubin 1,5 mal mehr als die obere Grenze des normalen (ULN) bei BCLM-Patienten kann eine schwere Leberschädigung vorhersagen und somit zum Absetzen des Arzneimittels oder zur hepatischen Enzephalopathie beitragen.Der Warburg-Effekt treibt Krebszellen dazu, auf aerobe Glykolyse angewiesen zu sein, selbst wenn die Sauerstoffversorgung ausreichend ist, was im Gegensatz zu normalen Geweben das Markenzeichen des Krebsstoffwechsels ist (23). LDH spielt aufgrund seiner Fähigkeit, Pyruvat unter anaeroben Bedingungen in Lactat umzuwandeln, eine unverzichtbare Rolle bei der Glykolyse (24). Deregulierte LDH-Spiegel könnten eine höhere Tumorlast, ein schlechteres Ansprechen auf die Behandlung und eine schlechtere Prognose widerspiegeln, die zuvor bei mehreren Tumoren berichtet worden waren (21, 24-26). Eine Metaanalyse zur prognostischen Wirkung von LDH bei Brustkrebspatientinnen zeigte, dass höhere LDH-Spiegel zu einem unbefriedigenden OS und einem progressionsfreien Überleben führten, die 11 Studien mit 6.102 Patienten umfasste (27).
GGT, das wichtigste endogene Antioxidans, macht Vorläuferaminosäuren assimiliert und beteiligt sich an der Glutathionsynthese (28). GGT in Tumoren ermöglicht es Zellen, Glutathion nach einer prooxidativen Krebstherapie schnell wieder aufzufüllen, und korreliert daher mit Arzneimittelresistenz und schlechtem Überleben (29). Interessanterweise haben Fentiman et al. berichtet, dass eine signifikant positive Beziehung zwischen erhöhter GGT und Brustkrebsrisiko identifiziert wurde (30). ALB, das von der Leber synthetisiert wird, fungiert als Antioxidans, Transporter von Nährstoffen und ist aufgrund seiner einzigartigen strukturellen Eigenschaften an Signalwegen beteiligt (31). Hypoalbuminämie tritt normalerweise bei fortgeschrittenen Krebspatienten auf und wird verschiedenen Mechanismen zugeschrieben, einschließlich einer gestörten Lebersynthese, eines erhöhten Katabolismus und einer Kachexie (21, 31). Hypoalbuminämie ist ein unabhängiger Indikator für eine schlechte Prognose verschiedener Tumoren (21, 22, 32, 33). Im Gegensatz zu verringerten Serumalbuminspiegeln sind die GGT-Spiegel im Serum tendenziell erhöht, wenn die Leberfunktion beeinträchtigt ist. Daher kann GAR basierend auf den beiden oben genannten Parametern den Vorteil haben, die Leberreservefähigkeit widerzuspiegeln und die Prognose vorherzusagen (32, 33). In der aktuellen Studie korrelierten abnormale Leberfunktionen (Gesamtbilirubin, LDH und GAR) alle mit einem ungünstigen prognostischen Einfluss auf das OS.
Nach Analyse der Prognose von 123 BCLM-Patienten haben Duan et al. gefunden, dass Patienten mit drei oder mehr Lebermetastasen durchgeführt 2.26-fach erhöhtes Sterberisiko im Vergleich zu Patienten mit <3 Lebermetastasen in multivariater Analyse (10). Die Merkmale der Lebermetastasen in dieser Studie schienen jedoch keinen Unterschied zu machen. Es gibt zwei mögliche Gründe, die zu dieser Diskrepanz beitragen. Zunächst unterschieden sich Verteilung, Anzahl und maximaler Durchmesser der Lebermetastasen in den drei Risikogruppen signifikant, was darauf hindeutet, dass das Mortalitätsrisiko mit der Ausdehnung der Lebermetastasen in der univariaten Analyse anstieg. Danach war eine abnormale Leberfunktion eng mit der Tumorlast der Lebermetastase verbunden, wodurch die Rolle dieser Faktoren in der multivariaten Analyse angepasst wurde.
Es gibt viele Studien zu prognostischen Faktoren bei der Einstellung von BCLM. Eine Analyse von 145 BCLM-Patienten zeigte, dass Hypoalbuminämie, älteres Alter und ER-Negativität unabhängige Prädiktoren für ein schlechtes Überleben waren (22). Eine griechische Registeranalyse ergab ähnliche Ergebnisse, bei denen HR-Positivität, niedriger histologischer Grad, Fehlen extrahepatischer Metastasen und guter Leistungsstatus signifikante prognostische Faktoren für eine günstige Prognose in der univariaten Analyse waren (34). Eine kürzlich durchgeführte populationsbasierte Studie mit mehr als 4.000 Patienten mit de novo BCLM hat demografische und sozioökonomische Faktoren, den pathologischen Grad, die Gesamtzahl der extrahepatischen Metastasen, die Behandlung und den molekularen Subtyp als Parameter identifiziert, die das Gesamtüberleben signifikant beeinflussen (17). Regierer et al. entwicklung eines prognostischen Scores für MBC basierend auf HR-Status, MFI und Metastasenstellen, um ihre Prognose vorherzusagen und eine optimale Behandlung zu individualisieren, die intern und extern validiert wurde (5). Leider wurde der HER2-Status nicht in den prognostischen Score einbezogen und beschränkte daher seine Anwendbarkeit. Der modifizierte Breast-GPA für BCBM-Patienten, der vier einfache klinische Parameter integrierte, spielte eine unmittelbare Rolle bei der Vorhersage ihres Überlebens, war jedoch für BCLM-Patienten nicht anwendbar (7). Unseres Wissens gibt es kein prognostisches Modell, das diese prognostischen Faktoren für BCLM-Patienten integriert, daher ist unser Modell pragmatisch sinnvoll.
Es gab auch einige Einschränkungen in dieser Forschung. Erstens führte eine einzelzentrische und retrospektive Studie unweigerlich zu einer Auswahlverzerrung, obwohl unser Prognosemodell intern und extern validiert wurde. Zweitens wurden Patienten, die später im Krankheitsverlauf Lebermetastasen entwickelten, ausgeschlossen, so dass wir diese Patienten nicht bewerten konnten. Drittens lagen in dieser Studie keine detaillierten Informationen zum Leistungsstatus und zur Behandlung vor.
Schlussfolgerungen
Trotz dieser Einschränkungen kann diese Forschung ein einfaches und zuverlässiges Prognosemodell liefern. Der große Vorteil unserer Studie ist die Einbeziehung von Parametern leicht zugänglich in der klinischen Praxis auf der Grundlage der großen Stichprobe von BCLM-Patienten. Neben der Klassifizierung von Tumoren nach Sequenzierungsmethoden der nächsten Generation kann unser Modell helfen, Untergruppen mit unterschiedlicher Prognose zu identifizieren und die nachfolgende Therapie zu leiten.
Erklärung zur Datenverfügbarkeit
Die in der Studie vorgestellten Originalbeiträge sind im Artikel / Ergänzungsmaterial enthalten, weitere Anfragen können an die entsprechenden Autoren gerichtet werden.
Ethikerklärung
Die vorliegende Studie wurde von den unabhängigen Ethikkommissionen der FUSCC genehmigt. Die Patienten / Teilnehmer gaben ihre schriftliche Einverständniserklärung zur Teilnahme an dieser Studie ab.
Autorenbeiträge
LJ schlug die Studie vor. XZ und YG sammelten die Daten. LJ und LF analysierten die Daten und schrieben den ersten Entwurf. ZW überprüfte das Manuskript kritisch. Alle Autoren haben zu dem Artikel beigetragen und die eingereichte Version genehmigt.
Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir danken Lei Cheng für die Durchführung der Datenanalyse.
Ergänzendes Material
Abkürzungen
BCLM, Brustkrebs mit Lebermetastasen; FUSCC, Fudan University Shanghai Cancer Center; ROC, Empfänger-Betriebskennlinie; MFI, metastasierendes freies Intervall; HR, Hazard Ratio; CI, Konfidenzintervall; OS, Gesamtüberleben; MBC, metastasierter Brustkrebs; BCBM, Brustkrebs mit Hirnmetastasen; LM, Lebermetastasen; GPA, abgestufte prognostische Beurteilung; HB, Hämoglobin; HR, Hormonrezeptor; HER2, Human epidermal Growth factor receptor 2; CT, Computertomographie; MRT, Magnetresonanztomographie; ALT, Alaninaminotransferase; AST, Aspartataminotransferase; ALP, alkalische phosphatase; LDH, Lactatdehydrogenase; GAR, γ-Glutamyltransferase zu Albumin-Verhältnis; GGT, γ-Glutamyltransferase; ALB, Albumin; CTCAE, Gemeinsame Terminologiekriterien für unerwünschte Ereignisse; ULN, obere Grenze des Normalwerts.
4. Puente J, Lopez-Tarruella S, Ruiz A, Lluch A, Pastor M, Alba E, et al. Praktischer prognostischer Index für Patienten mit metastasiertem rezidivierendem Brustkrebs: Retrospektive Analyse von 2.322 Patienten aus dem spanischen GEICAM El Alamo Register. Brustkrebs Res behandeln. (2010) 122:591–600. doi: 10.1007/s10549–009-0687–4
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Regierer AC, Wolters R, Ufen MP, Weigel A, Novopashenny I, Kohne CH, et al. An internally and externally validated prognostic score for metastatic breast cancer: analysis of 2269 patients. Ann Oncol. (2014) 25:633–8. doi: 10.1093/annonc/mdt539
PubMed Abstract | CrossRef Full Text
6. Marko NF, Xu Z, Gao T, Kattan MW, Weil RJ. Vorhersage des Überlebens bei Frauen mit Brustkrebs und Hirnmetastasen: Ein Nomogramm übertrifft aktuelle Überlebensvorhersagemodelle. Krebs. (2012) 118:3749–57. ursprungsbezeichnung: 10.1002/cncr.26716
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
7. Subbiah IM, Lei X, Weinberg JS, Sulman EP, Chavez-MacGregor M, Tripathy D, et al. Validierung und Entwicklung einer modifizierten Brust abgestuft prognostische Beurteilung als Instrument für das Überleben bei Patienten mit Brustkrebs und Hirnmetastasen. In: J Clin Oncol. (2015) 33:2239–45. doi: 10.1200/JCO.2014.58.8517
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
9. Lobezoo DJ, van Kampen RJ, Voogd AC, Dercksen MW, van den Berkmortel F, Smilde TJ, et al. Prognose von metastasiertem Brustkrebs: Gibt es Unterschiede zwischen Patienten mit de novo und rezidivierendem metastasiertem Brustkrebs? Br J Cancer. (2015) 112:1445–51. doi: 10.1038/bjc.2015.127
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Duan XF, Dong NN, Zhang T, Li Q. The prognostic analysis of clinical breast cancer subtypes among patients with liver metastases from breast cancer. Int J Clin Oncol. (2013) 18:26–32. doi: 10.1007/s10147–011-0336-x
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dueck AC, Mendoza TR, Mitchell SA, Reeve BB, Castro KM, Rogak LJ, et al. Validität und Zuverlässigkeit der Patient-Reported Outcomes-Version des US National Cancer Institute der Common Terminology Criteria for Adverse Events (PRO-CTCAE). JAMA Oncol. (2015) 1:1051–9. doi: 10.1001/bioncol.2015.2639
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
17. Xie J, Xu Z. Eine populationsbasierte Studie über Lebermetastasen bei Frauen mit neu diagnostiziertem Brustkrebs. Krebs Epidemiol Biomarker Prev. (2019) 28:283–92. doi: 10.1158/1055–9965.EPI-18–0591
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dawood S, Broglio K, Ensor J, Hortobagyi GN, Giordano SH. Survival differences among women with de novo stage IV and relapsed breast cancer. Ann Oncol. (2010) 21:2169–74. doi: 10.1093/annonc/mdq220
PubMed Abstract | CrossRef Full Text
19. den Brok WD, Speers CH, Gondara L, Baxter E, Tyldesley SK, Lohrisch CA. Überleben mit metastasiertem Brustkrebs basierend auf der Erstpräsentation, de novo versus rezidivierend. Brustkrebs Res behandeln. (2017) 161:549–56. ust-IDNR.: 10.1007/s10549–016-4080–9
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
20. Fujiwara R, Haag M, Schaeffeler E, Nies AT, Zanger UM, Schwab M. Systemische Regulation der Bilirubin-Homöostase: potenzielle Vorteile von Hyperbilirubinämie. Hepatologie. (2018) 67:1609–19. doi: 10.1002/hep.29599
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Liu X, Meng QH, Ye Y, Hildebrandt MAT, Gu J, Wu X. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer. Carcinogenesis. (2015) 36:243–8. doi: 10.1093/carcin/bgu247
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Vander Heiden MG, Cantley LC, Thompson CB. Den Warburg-Effekt verstehen: die metabolischen Anforderungen der Zellproliferation. Wissenschaft. (2009) 324:1029–33. doi: 10.1126/Wissenschaft.1160809
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
24. Mishra D, Banerjee D. Lactatdehydrogenasen als metabolische Verbindungen zwischen Tumor und Stroma in der Tumormikroumgebung. Krebs. (2019) 11:750. doi: 10.3390/cancers11060750
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Pelizzari G, Basile D, Zago S, Lisanti C, Bartoletti M, Bortot L, et al. Lactate dehydrogenase (ldh) response to first-line treatment predicts survival in metastatic breast cancer: first clues for a cost-effective and dynamic biomarker. Cancers. (2019) 11:1243. doi: 10.3390/cancers11091243
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Hopkins AM, Rowland A, McKinnon RA, Sorich MJ. Predictors of long-term disease control and survival for HER2-positive advanced breast cancer patients treated with pertuzumab, trastuzumab, and docetaxel. Front Oncol. (2019) 9:789. doi: 10.3389/fonc.2019.00789
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Pentheroudakis G, Fountzilas G, Bafaloukos D, Koutsoukou V, Pectasides D, Skarlos D, et al. Metastasierter Brustkrebs mit Lebermetastasen: eine Registeranalyse der klinisch-pathologischen, Management- und Ergebnismerkmale von 500 Frauen. Brustkrebs Res behandeln. (2006) 97:237–44. ust-IDNR.: 10.1007/s10549–005-9117–4
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Leave a Reply