Grenzen in der Pharmakologie
Einleitung
Liposomen sind eine Art nanocarrier, die zu den Medikamentenverabreichungszwecken weit nachgeforscht worden sind. Sie bestehen aus Phospholipid-Doppelschichten, die einen deutlichen wässrigen Raum einschließen, wodurch sowohl hydrophile als auch hydrophobe Verbindungen eingekapselt werden können (Metselaar und Storm, 2005). Liposomen sind in der Lage, therapeutische Verbindungen zu stabilisieren und Barrieren für die Zell- und Gewebeaufnahme zu überwinden (Ding et al., 2006; Hua und Wu, 2013). Dies ermöglicht es ihnen, das Targeting von Verbindungen auf Krankheitsstellen zu verbessern und folglich die Akkumulation in Nichtzielorganen zu reduzieren (Bakker-Woudenberg et al., 1994; Mastrobattista et al., 1999; Hua, 2013; Hua et al., 2015; Sercombe et al., 2015; Zununi Vahed et al., 2017). Es gibt vier Haupttypen von Liposomen, die auf ihren Oberflächeneigenschaften basieren – konventionelle Liposomen, pegylierte Liposomen, Liganden-gezielte Liposomen und theranostische Liposomen (Abbildung 1; Sercombe et al., 2015). Ligand-gezielte Liposomen bieten das Potenzial für die ortsspezifische Abgabe von Arzneimitteln an bestimmte Gewebe oder Organe, die den Zielligand selektiv exprimieren (Willis und Forssen, 1998; Bendas, 2001; Sawant und Torchilin, 2012), während pegylierte Liposomen eine sterische Behinderung verleihen, um die Zirkulationshalbwertszeit des Verabreichungssystems nach systemischer Verabreichung zu erhöhen (Torchilin, 1994; Wang et al., 2015). Liposomen, die eine Kombination der verschiedenen Verabreichungsplattformen enthalten, können die Abgabe von verkapselten Verbindungen je nach Verabreichungsweg und Krankheitsort weiter verbessern.
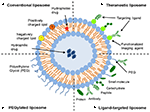
ABBILDUNG 1. Schematische Darstellung der verschiedenen Arten von liposomalen Wirkstoffabgabesystemen – (A) Konventionelles Liposom, (B) Pegyliertes Liposom, (C) Ligandengerichtetes Liposom und (D) Theranostisches Liposom (Sercombe et al., 2015).
Im Anschluss an den Herstellungsprozess werden Liposomen charakterisiert, um die Homogenität über eine Reihe von Parametern hinweg sicherzustellen, einschließlich Arzneimittelverkapselung, Ligandenkonjugation, Lipidzusammensetzung, Oberflächenladung und morphologische Eigenschaften (z. B. Größe, Form und Anzahl der Lamellen) (Kuntsche et al., 2011). Diese Eigenschaften sind wichtig, da sie das Verhalten von Liposomen sowohl in vitro als auch in vivo stark beeinflussen können (Sawant und Torchilin, 2012; Sercombe et al., 2015). Die Erkennung und Clearance von Liposomen durch die körpereigenen Abwehrkräfte, einschließlich des retikuloendothelialen Systems (RES), und die Adsorption von Opsoninen mit anschließender Aufnahme durch das mononukleäre Phagozytensystem tragen wesentlich zur Clearance und zum Abbau von Liposomen bei (Senior, 1987; Cullis et al., 1998; Ishida et al., 2001). Daher ist es wichtig, die physikalisch-chemischen Eigenschaften von hergestellten Liposomen bestimmen zu können, um eine Formulierung für die weitere translationale Bewertung zu optimieren.
Ein wichtiger Aspekt bei der physikalisch-chemischen Beurteilung von Liposomen ist die mikroskopische Darstellung der Morphologie der Nanopartikel. Für die Abbildung von Liposomen und anderen Nanopartikeln stehen eine Reihe von Techniken zur Verfügung, die grob in die Licht-, Elektronen- oder Rasterkraftmikroskopie eingeteilt werden können (Bibi et al., 2011). Jede Technik hat ihre eigenen Vorteile und Einschränkungen, die bei der Bewertung von Studien zu Nanopartikel-basierten Wirkstoffabgabesystemen berücksichtigt werden sollten (Tabelle 1). In diesem Review wird jede bildgebende Technik bewertet, die zur Beurteilung der morphologischen Eigenschaften von Liposomen verwendet wird.

TABELLE 1. Zusammenfassung der aktuellen bildgebenden Verfahren zur Charakterisierung der Liposomenmorphologie.
Lichtmikroskopie
Licht- oder optische Mikroskopie bezieht sich auf Mikroskope, die sichtbares Licht und eine Anordnung von Linsen verwenden, um ein Sichtfeld zu vergrößern (Murphy und Davidson, 2012c). Die grundlegende Lichtmikroskopie selbst kann im Vergleich zu anderen Mikroskopietechniken keine umfassenden Informationen über die Lipiddoppelschicht liefern. Es kann jedoch verwendet werden, um schnell ein Bild von Vesikeln mit grundlegenden Laborgeräten zu erhalten (Bibi et al., 2011). Diese Technik kann besonders nützlich sein, wenn allgemeine Informationen über Größe, Form, Homogenität und Aggregationsgrad einer Liposomenprobe gesammelt werden (Nallamothu et al., 2006). Lichtmikroskope haben eine endgültige Auflösung von ∼250 nm (bestimmt durch die kleinste beugungsbegrenzte Spotgröße, die mit dem Instrument erreicht werden kann) und sind daher typischerweise nicht in der Lage, detaillierte Informationen über die Strukturen kleiner unilamellarer Vesikel (SUVs) und die Lamellarität von Vesikeln bereitzustellen (Bibi et al., 2011). Im Allgemeinen kann die Lichtmikroskopie nur signifikante Informationen über riesige unilamellare Vesikel (GUVs) liefern, deren Durchmesser von einem bis zu Hunderten von Mikrometern reichen kann (Bagatolli, 2009). Der Einbau von Fluoreszenzsonden, Polarisationstechniken und die Anwendung hochauflösender konfokaler Mikroskopie können weitere Informationen über die 3D-Struktur und Lamellarität der Vesikel liefern (Bagatolli, 2009).
Polarisationsmikroskopie
Diese Art der Lichtmikroskopie nutzt die einzigartige Fähigkeit von polarisiertem Licht, mit polarisierbaren Bindungen geordneter Moleküle zu interagieren (Murphy und Davidson, 2012d). Eine verbesserte Lichtabsorption tritt auf, wenn molekulare Dipole in der Probe mit dem Polarisationsvektor der einfallenden Lichtwelle ausgerichtet sind; dies führt zu Phasendifferenzen zwischen Abtastlichtstrahlen, die wiederum interferenzabhängige Amplitudenänderungen in der Bildebene erzeugen (Murphy und Davidson, 2012d). Der Bildkontrast entsteht dann nicht nur durch die Auswirkungen von Interferenz und Beugung, sondern auch durch das Vorhandensein geordneter molekularer Anordnungen (Murphy und Davidson, 2012d). Es kann verwendet werden, um die Form und Dynamik vieler geordneter zellulärer Strukturen zu untersuchen, einschließlich Lipiddoppelschichten von Plasmamembranen (Bibi et al., 2011; Murphy und Davidson, 2012d). Bilder können entweder monochrom oder farbig erhalten werden. Diese Technik bietet eine alternative Methode zur Visualisierung von Liposomen, insbesondere zur Bestätigung der Bildung von Vesikeln. Es liefert keine schlüssigen Beobachtungen bezüglich der Doppelschichteigenschaften oder der Lamellarität der Vesikel (Bibi et al., 2011). Darüber hinaus ist die Polarisationsmikroskopie auch durch die Größe der visualisierbaren Vesikel begrenzt, wobei große Vesikel im Mikrometerbereich die optimale Klarheit aufweisen. Diese Technik liefert keine klaren Bilder von Partikeln im Nanometerbereich.
Fluoreszenzmikroskopie
Die Fluoreszenz- oder „Epifluoreszenz“ -Mikroskopie ist eine spezielle Form der Lichtmikroskopie, die die Fähigkeit von Fluorochromen ausnutzt, Licht zu emittieren, nachdem sie mit Licht einer bestimmten Wellenlänge angeregt wurde (Murphy und Davidson, 2012b). Diese Technik ist in der Biophysik weit verbreitet, um wesentliche Informationen über die Struktur und Dynamik von Membrankomponenten zu liefern (Bouvrais et al., 2010). Bei diesen Untersuchungen werden Fluoreszenzsonden spezifisch in die zu untersuchende Membran eingebaut, wodurch die Struktur sichtbar gemacht werden kann. Eine große Auswahl an Fluoreszenzfarbstoffen mit verschiedenen chemischen und photonischen Eigenschaften ist im Handel erhältlich und deckt eine Vielzahl von Forschungsfragen ab. Beispielsweise können bestimmte Fluoreszenzfarbstoffe bestimmte Membranumgebungen bevorzugen, die unterschiedliche Anordnungen und laterale Packungen aufweisen (Bouvrais et al., 2010). Als solches lässt Fluoreszenzmikroskopie das Potenzial zu, mehrfache Fühler innerhalb einer Probe gleichzeitig anzuwenden, um Informationen über die Membranstruktur selbst zur Verfügung zu stellen. Die Fluoreszenzsonden können sowohl im wässrigen Kompartiment als auch in der Lipiddoppelschicht von Liposomen platziert werden (Bibi et al., 2011). Diese Anordnung kann besonders nützlich sein, wenn GUVs betrachtet werden, wo Informationen über die Form, Größe und Fluidität der Lipidvesikel erhalten werden können (Klymchenko et al., 2009; Bouvrais et al., 2010). Der Einbau von Sonden, wie Rhodamin-markierten Lipiden, direkt in die Lipiddoppelschicht kann auch die Visualisierung der Lamellarität von Liposomen ermöglichen (Bibi et al., 2011).
Der Nachteil der Fluoreszenzmikroskopie besteht darin, dass die Zugabe von Sonden und Farbstoffen zu einem Membransystem möglicherweise die Eigenschaften des liposomalen Abgabesystems beeinträchtigen kann (Bouvrais et al., 2010; Bibi et al., 2011; Murphy und Davidson, 2012b). Es hat sich jedoch gezeigt, dass die Verwendung niedriger Farbstoffkonzentrationen (≤1 mol%) die physikalischen Eigenschaften der Membran nur minimal beeinflusst (Bouvrais et al., 2010). Es ist auch wichtig zu beachten, dass die Wahl des Fluoreszenzfarbstoffs ein kritischer Schritt ist, da einige Farbstoffe große Veränderungen in der Wirtsmembran induzieren und / oder experimentelle Artefakte verursachen können, was zu einer ungenauen Dateninterpretation führt (Bouvrais et al., 2010). Darüber hinaus kann die photoinduzierte Lipidperoxidation auch in einfachen Farbstoffsystemen zur Domänenbildung führen. Dieser Prozess kann zur Bildung großer Flöße und zur spontanen Facettenbildung führen (Bouvrais et al., 2010). Längere Exposition gegenüber fluoreszierendem Licht kann auch zu Bleichen und Verlust der Fluoreszenzintensität führen. Daher sind die Wahl des Fluoreszenzfarbstoffs und die Entwicklung neuer Membransonden wichtige Überlegungen bei der Verwendung der Fluoreszenzmikroskopie (Klymchenko et al., 2009).
Konfokale Mikroskopie
Die konfokale Rastermikroskopie ist ein Fortschritt auf dem Gebiet der Fluoreszenzmikroskopie. Anstatt die gesamte Probe zu beleuchten, wird ein Bild erstellt, indem ein (oder mehrere) fokussierte Lichtstrahlen über die Probe gescannt werden. Licht, das von der beleuchteten Probe zurückkehrt, passiert eine Blende, die unscharfes Licht von oben und unten der interessierenden Ebene abweist; sicherstellen, dass nur Bilder aus einer kleinen Schärfentiefe erhalten werden, wodurch die Auflösung außerhalb der Ebene erheblich verbessert wird (Bibi et al., 2011; Murphy und Davidson, 2012a). Mit dieser Technik wird ein „Z-Stapel“ von Bildern gesammelt, beginnend von der Oberseite des Vesikels, gefolgt von Bildern, die in definierten z-Schritten bis zur Unterseite der Probe aufgenommen wurden, was zu einem zusammengesetzten 3D-Bild der Probe führt (Bibi et al., 2011; Murphy und Davidson, 2012a). Die konfokale Rastermikroskopie ist aufgrund ihrer überlegenen Bildschärfe gegenüber epifluoreszenten Lichtmikroskopen zu einer attraktiveren Technik geworden. Bei GUVs ist diese Technik in der Lage, die innere Struktur der Lipidsysteme sichtbar zu machen, was mit anderen Mikroskopiemethoden oft nicht möglich ist (Ruozi et al., 2011; Mertins und Dimova, 2013). Beispielsweise kann die Trennung der wässrigen und Lipiddoppelschichtphase in größeren Vesikeln deutlich sichtbar gemacht werden (Mertins und Dimova, 2013). Die konfokale Mikroskopie ist jedoch immer noch beugungslimitiert und daher nicht in der Lage, hochauflösende Bilder von SUVs oder oligolamellaren Liposomen zu erzeugen (Ruozi et al., 2011).
Elektronenmikroskopie-Techniken
Die Elektronenmikroskopie ist eine Methode zur Visualisierung von Vesikeln unter sehr hoher Vergrößerung (Henry, 2005). Es wird häufig bei der Charakterisierung von Lipidvesikeln verwendet, da die Elektronenwellenlänge (und damit die beugungsbegrenzte Auflösung) um viele Größenordnungen niedriger ist als die der optischen Mikroskopie und daher eine Superauflösung für die klare Visualisierung kleiner Liposomen bietet (Bibi et al., 2011; Ruozi et al., 2011). Diese Technik verwendet einen Elektronenstrahl, der von verschiedenen elektromagnetischen Linsen auf die Oberfläche der Probe fokussiert wird. Die Elektronen werden dann von der Probe gestreut und dann durch eine weitere Reihe elektromagnetischer Linsen in der Abbildungssäule neu fokussiert und vergrößert, um ein projiziertes Bild zu erzeugen (Henry, 2005). Es gibt eine Reihe von verschiedenen Arten von Elektronenmikroskopen, die jeweils eine andere Probenvorbereitungsmethode erfordern.
Rasterelektronenmikroskopie (REM)
Rasterelektronenmikroskope (SEMs) verwenden einen Elektronenstrahl, der über oder über eine Probe (anstatt durch eine Probe) gescannt wird, um ein vergrößertes Bild eines Objekts zu erzeugen (Adler und Schiemann, 1985). In: Alder et al. 1984 wurde erstmals versucht, SEM zur Charakterisierung von Liposomen zu verwenden (Adler und Schiemann, 1985). Sie zeigten, dass die Verwendung der Gefriertrocknungsmethode zur Vorbereitung der Liposomenproben für die REM zu einem großen Anteil an sichtbaren Klumpen und verkrustetem Material führte (Adler und Schiemann, 1985). Neuere Studien haben gezeigt, dass die Liposomenstruktur selbst aufgrund der für diese Präparationstechnik erforderlichen Hochvakuumbedingungen und Färbeprozesse Störungen erleiden kann (Ruozi et al., 2011). REM wird heute nicht mehr häufig zur Analyse von Liposomen verwendet, da die Probe vor der Bildgebung getrocknet oder fixiert werden muss (Ruozi et al., 2011). SEM kann jedoch allgemeine Informationen über die konzentrische Struktur der verschiedenen Lipidschichten sowie Details über die Größe und sphärische Morphologie eines Präparats liefern (Nirale et al., 2009).
Transmissionselektronenmikroskopie (TEM)
Die Transmissionselektronenmikroskopie (TEM) ist das am häufigsten verwendete bildgebende Verfahren zur Beurteilung der Struktur von Nanopartikeln (Henry, 2005; Kuntsche et al., 2011). Dabei wird eine dünne Probe (<100 nm dick) hergestellt, die in eine Vakuumkammer gegeben wird. Der Elektronenstrahl kreuzt die Probe, wo er dann von der Objektivlinse fokussiert wird, um ein Bild zu bilden. TEM kann Proben weicher Materie mit einer räumlichen Auflösung von deutlich unter 1 nm leicht abbilden (Henry, 2005; Kuntsche et al., 2011; Ruozi et al., 2011). Diese Technik kann basierend auf der verwendeten Probenvorbereitungsmethode weiter kategorisiert werden – insbesondere Negativfärbung, Gefrierbruch und kryogenes TEM. Es kann Informationen über Oberflächenmodifikationen von Nanopartikeln liefern, da es einen besseren Kontrast und eine bessere Kontur von Bildern bietet als andere Mikroskopietechniken. Beispielsweise zeigte die Konjugation von Transferrin an die Oberfläche von DSPC/Cholesterin-Liposomen eine partikuläre Oberflächenbeschichtung mit negativem Fleck TEM, die in den unkonjugierten Liposomenpräparaten fehlte (Anabousi et al., 2005). In einem separaten Experiment wurden vor der Negativfärbung spezifische Antikörper gegen humanes Transferrin zugegeben, um die Identität der partikulären Oberflächenbeschichtung zu bestätigen (Anabousi et al., 2005). Daher bietet TEM die Möglichkeit, eine deutlich verbesserte Auflösung bei der Beurteilung der Konjugation von Liganden an der Oberfläche von Liposomen zu erreichen.
Negativfärbetechnik
Bei der Negativfärbung wird bei der Probenvorbereitung eine kleine Menge hydratisierter Probe auf ein Gitter gelegt. Da die Vesikel in direktem Kontakt mit dem Gitter stehen, können ihre Orientierung und Morphologie beeinflusst werden, und daher sollte dies berücksichtigt werden (Bibi et al., 2011). Es ist auch notwendig, die Liposomen in ein geeignetes elektronendichtes Material (z.B., Schwermetallsalze wie Uranylacetat oder Phosphowolframsäure), die einen hohen Kontrast bieten, so dass Vesikel vor einem dunkel gefärbten Hintergrund betrachtet werden können (Ruozi et al., 2011). Die Negativfärbetechnik ist relativ schnell und einfach; Es hat sich jedoch gezeigt, dass sie Änderungen an der ursprünglichen Liposomenstruktur verursacht und zur Bildung von hellen und dunklen Fransen führen kann, die mit Lamellenstrukturen verwechselt werden können (Bibi et al., 2011; Ruozi et al., 2011). Darüber hinaus kann das Platzieren der Probe unter Vakuum zu einer weiteren Dehydratisierung der Probe führen, was wiederum zu Veränderungen in der Struktur der Vesikel führen kann (Bibi et al., 2011). Während die Negativ-Fleck-TEM-Technik eine viel höhere Vergrößerung für die Abbildung von Nanopartikeln bieten kann, macht es die Schädigung der Liposomenstruktur schwierig, die morphologischen Eigenschaften der Probe genau zu bewerten. Daher sind im Allgemeinen andere bildgebende Verfahren erforderlich, um die Ergebnisse zu bestätigen.
Gefrierbruch–Technik
Die Gefrierbruch–Technik benötigt keinen Trocknungsprozess und kann zusätzliche Informationen über die innere Struktur von Nanopartikeln liefern (Kuntsche et al., 2011). Bei dieser Methode wird eine Probe auf ein TEM-Gitter gelegt, das zwischen zwei Kupfer- oder Goldhaltern angeordnet ist (Severs, 2007). Die Probe wird durch schnelles Einfrieren, typischerweise mit flüssigem Propan oder flüssigem Stickstoff, verglast, bevor sie entlang von Bereichen der Probe mit schwachen molekularen Wechselwirkungen gebrochen wird. Diese Bruchfläche kann weiter geätzt und mit einer dünnen Platin- oder Kohlenstoffschicht abgeschattet werden, um eine „negative“ Nachbildung der Bruchprobenebene zu erhalten (Severs, 2007; Kuntsche et al., 2011). Das Replikat wird dann mit einem organischen Lösungsmittel gereinigt, um alle Rückstände vor der Visualisierung unter einem TEM-Mikroskop zu entfernen. Da diese Replikate so stabil sind, können sie gespeichert und später betrachtet werden (Kuntsche et al., 2011). Der Hauptvorteil dieser Technik besteht darin, dass die Repliken den nativen Zustand der Probe genau widerspiegeln und detaillierte Informationen über die 3D-Struktur der Vesikel und die Doppelschichtorganisation liefern können (Bibi et al., 2011; Kuntsche et al., 2011). Diese Informationen umfassen den multilamellaren Aufbau und die Doppelschichtpackung von multilamellaren Vesikeln. Diese Technik kann auch die Aggregatgröße bestimmen und kann besonders nützlich sein, um die Wechselwirkung von kationischen Liposomen mit DNA zu untersuchen (Bibi et al., 2011). Während der Präparation können jedoch immer noch Artefakte in der Probe auftreten, die auf eine unzureichende Gefrierrate, eine erneute Ablagerung von Lösungsmittelmolekülen und / oder mechanische Beanspruchung zurückzuführen sind (Severs, 2007; Kuntsche et al., 2011). Beispielsweise kann bei den SUVs in der Probe ein „Rippling-Effekt“ auftreten (Bibi et al., 2011). Dies ist eine häufige Doppelschichtverformung, die auf eine Störung der Übergänge der Acylketten vor dem Einfrieren zurückzuführen ist. Die Inkubation von Vesikeln zwischen der Vorübergangs- und der tatsächlichen Übergangstemperatur kann ebenfalls Wellen verursachen (Bibi et al., 2011). Interessanterweise kann dies verwendet werden, um Informationen über die Lipidphasenübergänge zu liefern, die mit der unterschiedlichen Natur der für liposomale Präparate verwendeten Lipide auftreten (Bibi et al., 2011).
Kryogenes TEM
Kryogenes TEM (Cryo-TEM) ist eine Variation von TEM, bei der dünne wässrige hydratisierte Filme, die in flüssigem Ethan verglast sind, vor der Bildgebung verwendet werden. Diese Technik ermöglicht die Analyse von Liposomen in ihrem nativsten Zustand und ist ein wertvolles Werkzeug zur Bestimmung der Größe, Form, inneren Struktur und Lamellarität von Liposomen (Weisman et al., 2004; Bibi et al., 2011; Kuntsche et al., 2011). Der Hauptvorteil des schnellen Einfrierens von Liposomenproben besteht darin, die Bildung von Eiskristallen zu minimieren und Proteine oder andere Materialien zu konservieren (Bibi et al., 2011; Kuntsche et al., 2011). Dies ist vorteilhaft, wenn Proteine oder DNA in den Nanopartikeln eingekapselt wurden (Weisman et al., 2004; Kuntsche et al., 2011). Kryotem ist die derzeit nützlichste Form der Mikroskopie zur Untersuchung von Liposomen, da Probleme mit chemischer Fixierung, Dehydratisierung, Schneiden und Färben vermieden werden, die alle die Morphologie von Vesikeln beeinflussen können (Bibi et al., 2011). Der Auflösungsbereich beträgt ∼5 bis 500 nm, definiert durch die Dicke des Films (Almgren et al., 2000). Bei dieser Technik sollten jedoch einige Einschränkungen beachtet werden, einschließlich der Tatsache, dass nur ein 2D-Bild von 3D-Objekten erhalten wird (was im Allgemeinen auch für die meisten anderen Mikroskopietechniken gilt). Um diese Einschränkung zu überwinden, ist die Rekonstruktion von 3D-Formen aus einer ausreichend großen Anzahl von 2D-Bildern von zufällig orientierten nicht-sphärischen Partikeln möglich (Orlova et al., 1999), sowie das Betrachten der Probe in verschiedenen Neigungswinkeln, um Informationen über die 3D-Form zu erhalten (Van Antwerpen und Gilkey, 1994). Stattdessen kann auch die kryogene Elektronentomographie (cryo-ET) verwendet werden, um 3D-Bilder zu erhalten (Le Bihan et al., 2009). Cryo-TEM verwendet auch niedrigere Elektronendosen, was bedeutet, dass es im Vergleich zu anderen Methoden oft eine geringere Auflösung hat (Bibi et al., 2011; Kuntsche et al., 2011). Artefakte sind aufgrund der Bildung eines dünnen Films aus amorphem Eis und der Verwendung von Blotting auf der Probe unter Anwendung von Scherkräften während der Filmbildung immer noch möglich (Almgren et al., 2000; Bibi et al., 2011).
Environmental Scanning Electron Microscopy (ESEM)
Environmental Scanning Electron microscopy (ESEM) ist ein Bildgebungssystem, das keine Fixierung, Färbung oder Einfrieren von Vesikeln erfordert und die Abbildung dynamischer Veränderungen nasser Systeme ohne vorherige Probenvorbereitung ermöglichen kann (Muscariello et al., 2005; Ruozi et al., 2011). Das Hauptmerkmal von ESEM ist das Vorhandensein von Wasserdampf in der Mikroskopkammer. Die Fähigkeit, eine wasserhaltige Atmosphäre um die Probe herum aufrechtzuerhalten, die teilweise oder sogar vollständig hydratisiert sein kann, wird durch die Verwendung eines abgestuften Vakuumsystems mit mehreren Aperturen ermöglicht, mit dem die Bildgebungskammer bei Drücken von bis zu 55 hPa aufrechterhalten werden kann (Bibi et al., 2011; Ruozi et al., 2011). Der Primärelektronenstrahl kann Sekundärelektronen erzeugen, die dann auf Dampfmoleküle treffen, was zu einer Kaskadenverstärkung des Signals führt, bevor es den Detektor erreicht. Aus diesem Grund erfordert ESEM keine Probenvorbereitung (Muscariello et al., 2005). Diese Technik ermöglicht eine Variation der Probenumgebung durch eine Reihe von Druck-, Temperatur- und Gaszusammensetzungen (Mohammed et al., 2004), was nützlich ist, um zu bestimmen, wie Umweltveränderungen die Vesikel beeinflussen. Dies gilt für nanopharmazeutische Formulierungs- und Stabilitätsstudien (Bibi et al., 2011). ESEM wurde auch verwendet, um die Wirkstoffbeladung in die Doppelschicht von Liposomen zu analysieren (Mohammed et al., 2004), sowie die Bestimmung der Größe und Form von Vesikeln. Eine Einschränkung von ESEM besteht darin, dass es keine detaillierten Informationen über die Lamellarität und die interne Architektur der nanoskaligen Strukturen liefern kann (Ruozi et al., 2011).
Rasterkraftmikroskopie (AFM)
Rasterkraftmikroskopie (AFM), auch bekannt als Rasterkraftmikroskopie (SFM), ist eine Art von Rastersondenmikroskop-Technik. Es funktioniert, indem eine scharfe Spitze, die an einem Cantilever und Sensor befestigt ist, über die Oberfläche einer Probe geführt wird und die Oberflächenkräfte zwischen der Sonde und der Probe gemessen werden (Sitterberg et al., 2010). Wenn der Cantilever entlang der Probenoberfläche läuft, bewegt er sich aufgrund der Oberflächenmerkmale auf und ab und der Cantilever lenkt entsprechend aus. Diese Auslenkung wird üblicherweise mit einem optischen Sensor quantifiziert, wobei der Laserstrahl auf der Rückseite des Cantilevers auf den Lichtdetektor reflektiert wird (Sitterberg et al., 2010). Flughandbuch braucht nicht, in einem Vakuum zu funktionieren und kann in der Umgebungsluft oder unter Flüssigkeit funktionieren; folglich wird es in zunehmendem Maße verwendet, um biologische Proben sowie nanoparticles abzubilden (Liang et al., 2004a,b; Ruozi et al., 2005, 2009). Flughandbuch hat hervorragende Entschließung in der Größenordnung von Bruchteilen eines Nanometers und kann ein Bild 3D von Liposomen zusammen mit Details auf Morphologie, Größenverteilung, Homogenität und Stabilität zur Verfügung stellen (Liang et al., 2004a,b; Ruozi et al., 2005, 2007, 2009). Wichtig ist, dass AFM verwendet werden kann, um die Oberflächenmodifikationen von Liposomen zu charakterisieren und Liganden (z. B. Antikörper und Polymere) nachzuweisen, die an der liposomalen Membranoberfläche konjugiert sind (Bendas et al., 1999; Moutardier et al., 2003; Anabousi et al., 2005; Liang et al., 2005). Zum Beispiel, Bendas et al. benutztes Flughandbuch, zum der liposomalen Membrangrenze zu vergrößern und waren in der Lage, trimere Strukturen, ungefähr 8-10 Nanometer im Durchmesser darzustellen, die die Kopplung von IgG-Antikörpern zur Liposomenoberfläche darstellten (Bendas et al., 1999). Die Ergebnisse zeigten, dass die Wirksamkeit der Technik in hohem Grade von der Konjugationsmethode abhängig war, die, mit den Antikörpern verwendet wurde, die direkt zur liposomalen Oberfläche konjugiert wurden, die mit Flughandbuch (eingeschränkte Proteinmobilität) sichtbar ist, im Vergleich zu den Antikörpern, die zu KLAMMER-Ketten befestigt werden. Es wurde vermutet, dass die PEG-Ketten eine hohe Proteinmobilität verursachten und daher nicht gescannt werden konnten (Bendas et al., 1999). Umgekehrt zeigten Anabousi et al., dass der Einbau von pegylierten Lipiden in die Liposomen eine sterische Stabilisierung induzierte, wobei die Liposomen eine Kugelform beibehielten (Anabousi et al., 2005). Flughandbuch-Bilder der Oberfläche von unkonjugierten Liposomen waren glatt und keine Strukturen konnten beobachtet werden, während Konjugation des Transferrins zur Oberfläche von pegylierten Liposomen als kleine kugelförmige Strukturen sichtbar gemacht wurden (Anabousi et al., 2005). In ähnlicher Weise stellten Moutardier et al. Liposomen mit polymeren Kernen (LSP) her, die aus Arzneimitteln bestanden, die in polymere Partikel geladen waren, die den Kern von Lipidvesikeln bildeten (Moutardier et al., 2003). Bilder, die unter Verwendung Flughandbuchs genommen wurden, zeigten das Vorhandensein eines Polymernetzwerks auf der Außenfläche, die vorschlug, dass der Kollagenpolymerkern ausstrahlte und eine Oberflächenschicht auf dem LSP bildete (Moutardier et al., 2003). Zusätzlich zu oberflächenstrukturellen Details kann Flughandbuch Informationen über die mechanischen und chemischen Eigenschaften einer Beispieloberfläche durch Kraftmessungen zur Verfügung stellen (Ruozi et al., 2007). Zum Beispiel Mao et al. verwendete diese Technik, um die Elastizität und die Hafteigenschaften von Liposomen zu beurteilen (Mao et al., 2004). Eine Beschränkung von Flughandbuch ist der Bedarf an den nanoparticles, auf den Stützoberflächen, wie Glimmer- oder Silikonscheiben adsorbiert zu werden. Die Adsorption von Liposomen an ein festes Substrat kann die Größe und Form der Vesikel verändern und deren Abflachung verursachen. (Ruozi et al., 2007). Darüber hinaus kann der periodische Kontakt der Sondenspitze die Liposomen ziehen, wenn sie sich über die Vesikel in einer Probe bewegen (Jass et al., 2000). Trotz dieses ist Flughandbuch noch ein nützliches Werkzeug in der Bewertung von Liposomen.
Fazit
Zur Beurteilung der Morphologie von Liposomen steht eine breite Palette bildgebender Verfahren zur Verfügung, die jeweils ihre eigenen Vor- und Nachteile haben. Die Lichtmikroskopie kann relativ schnell allgemeine Angaben zur Größe und Form größerer Vesikel und zur Homogenität einer Probe liefern. Umgekehrt ist TEM die am häufigsten verwendete Technik, um die Morphologie von Liposomen viel detaillierter zu untersuchen; bei der Interpretation der Ergebnisse muss jedoch das Potenzial für strukturelle Veränderungen bei jedem TEM-Subtyp aufgrund von Färbung und / oder Exposition gegenüber Vakuumbedingungen berücksichtigt werden. ESEM ist am nützlichsten, wenn es liposomale Änderungen in Erwiderung auf die Umwelt bestimmt, während Flughandbuch als nützliche Methode in der morphologischen Analyse von nanoparticles auftaucht und maximale Entschließung der liposomalen Oberfläche zur Verfügung stellt. Sowohl AFM als auch TEM sind in der Lage, Liganden, die an die Oberfläche von Liposomen konjugiert sind, abzubilden und komplementäre Informationen über Oberflächenmodifikationen bereitzustellen. Insgesamt hängt die Wahl der Technik davon ab, welche morphologischen Merkmale und welcher Detaillierungsgrad erforderlich sind. Darüber hinaus ist das Verständnis der möglichen Auswirkungen der Probenvorbereitungsmethode jeder bildgebenden Technik für den Auswahlprozess wichtig.
Autorenbeiträge
Ausarbeitung des Manuskripts: A-LR und SH. Überarbeitung des Artikels kritisch für wichtige intellektuelle Inhalte: SH, PD, JF, WP, AM, DS und AW.
Erklärung zum Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Die Autoren danken dem Pharmacy Research Trust of New South Wales, der Rebecca L. Cooper Medical Research Foundation, dem Gladys M. Brawn Fellowship, der ausEE Research Foundation und der University of Newcastle für die finanzielle Unterstützung unserer Forschung.
Adler, K. und Schiemann, J. (1985). Charakterisierung von Liposomen mittels Rasterelektronenmikroskopie und Gefrierbruchverfahren. In: Micron Microsc. Acta 16, 109-113. doi: 10.1016/0739-6260(85)90039-5
CrossRef Volltext / Google Scholar
Almgren, M., Edwards, K. und Karlsson, G. (2000). Kryotransmissionselektronenmikroskopie von Liposomen und verwandten Strukturen. Kolloide surfen. Ein Physikochem. Eng. ASP. 174, 3–21. doi: 10.1016/S0927-7757(00)00516-1
Querverweis Volltext | Google Scholar
Anabousi, S., Laue, M., Lehr, C. M., Bakowsky, U., und Ehrhardt, C. (2005). Bewertung der Transferrinmodifikation von Liposomen durch Rasterkraftmikroskopie und Transmissionselektronenmikroskopie. EUR. In: J. Pharm. In: Biopharm. 60, 295–303. doi: 10.1016.2004.12.009
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Bagatolli, L. A. (2009). Membranen und Fluoreszenzmikroskopie. Rezensionen im August 2007. New York, NY: Springer, 33-51. doi: 10.1007/978-0-387-88722-7_2
CrossRef Volltext / Google Scholar
Bakker-Woudenberg, I. A., Sturm, G., und Woodle, M. C. (1994). Liposomen bei der Behandlung von Infektionen. J. Drogen-Ziel. 2, 363–371. doi: 10.3109/10611869408996811
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Bendas, G. (2001). Immunoliposomen: ein vielversprechender Ansatz zur gezielten Krebstherapie. BioDrugs 15, 215-224. doi: 10.2165/00063030-200115040-00002
CrossRef Volltext / Google Scholar
Bendas, G., Krause, A., Bakowsky, U., Vogel, J. und Rothe, U. (1999). Zielgenauigkeit neuartiger Immunoliposomen, die durch eine neue Antikörperkonjugationstechnik hergestellt werden. Int. In: J. Pharm. 181, 79–93. doi: 10.1016/S0378-5173(99)00002-2
PubMed Zusammenfassung | CrossRef Volltext | Google Scholar
Bibi, S., Kaur, R., Henriksen-Lacey, M., McNeil, S. E., Wilkhu, J., Lattmann, E., et al. (2011). Mikroskopische Bildgebung von Liposomen: von Deckgläsern bis zu Umwelt-SEM. Int. In: J. Pharm. 417, 138–150. doi: 10.1016/j.ijpharm.2010.12.021
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Bouvrais, H., Pott, T., Bagatolli, LA, Ipsen, JH und Meleard, P. (2010). Einfluss membranverankerter Fluoreszenzsonden auf die mechanischen Eigenschaften von Lipiddoppelschichten. Biochim. In: Biophys. Acta 1798, 1333-1337. doi: 10.1016/j.bbamem.2010.03.026
PubMed Abstract | CrossRef Full Text / Google Scholar
Cullis, P. R., Chonn, A. und Semple, S. C. (1998). Wechselwirkungen von Liposomen und lipidbasierten Trägersystemen mit Blutproteinen: relation zum Clearance-Verhalten in vivo. Adv. Drug Deliv. Offenbarung 32, 3-17. doi: 10.1016/S0169-409X(97)00128-2
PubMed Zusammenfassung | CrossRef Volltext | Google Scholar
Ding, B. S., Dziubla, T., Shuvaev, V. V., Muro, S. und Muzykantov, V. R. ( 2006). Fortschrittliche Arzneimittelabgabesysteme, die auf das vaskuläre Endothel abzielen. Mol. Interv. 6, 98–112. doi: 10.1124/Meilen.6.2.7
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Henry, CR (2005). Morphologie der unterstützten Nanopartikel. Progrock. Surfen. Sci. 80, 92–116. doi: 10.1016/j.progsurf.2005.09.004
CrossRef Volltext / Google Scholar
Hua, S. (2013). Targeting von Entzündungsstellen: Interzelluläres Adhäsionsmolekül-1 als Ziel für neuartige Entzündungstherapien. Front. Pharmacol. 4:127. Ursprungsbezeichnung: 10.3389/fphar.2013.00127
PubMed Abstract / CrossRef Full Text / Google Scholar
Hua, S., Marks, E., Schneider, J. J. und Keely, S. (2015). Fortschritte in der oralen nano-delivery-Systeme für Darm gezielte drug delivery bei entzündlichen Darmerkrankungen: selektives Targeting auf krankes versus gesundes Gewebe. Nanomedizin 11, 1117-1132. doi: 10.1016/j.nano.2015.02.018
PubMed Abstract / CrossRef Full Text / Google Scholar
Hua, S. und Wu, S. Y. (2013). Die Verwendung von lipidbasierten Nanoträgern für gezielte Schmerztherapien. Front. Pharmacol. 4:143. Ursprungsbezeichnung: 10.3389/fphar.2013.00143
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Ishida, T., Harashima, H. und Kiwada, H. (2001). Wechselwirkungen von Liposomen mit Zellen in vitro und in vivo: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L., Duportail, G., et al. (2009). Visualisierung von Lipiddomänen in riesigen unilamellaren Vesikeln unter Verwendung einer umgebungsempfindlichen Membransonde auf Basis von 3-Hydroxyflavon. Biochim. In: Biophys. Acta 1788, 495-499. doi: 10.1016/j.bbamem.2008.10.019
PubMed Abstract / CrossRef Full Text / Google Scholar
Kuntsche, J., Horst, J. C. und Bunjes, H. (2011). Kryogene Transmissionselektronenmikroskopie (Cryo-TEM) zur Untersuchung der Morphologie kolloidaler Arzneimittelabgabesysteme. Int. In: J. Pharm. 417, 120–137. doi: 10.1016/j.ijpharm.2011.02.001
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Le Bihan, O., Bonnafous, P., Marak, L., Bickel, T., Trepout, S., Mornet, S., et al. (2009). Kryo-Elektronentomographie der Nanopartikel-Transmigration in das Liposom. J. Struct. Biol. 168, 419–425. Ursprungsbezeichnung: 10.1016/j.jsb.2009.07.006
PubMed Abstract / CrossRef Full Text / Google Scholar
Liang, X., Mao, G. und Ng, K. Y. (2004a). Mechanische Eigenschaften und Stabilitätsmessung von cholesterinhaltigen Liposomen auf Glimmer mittels Rasterkraftmikroskopie. J. Kolloid-Schnittstelle Sci. 278, 53–62.
PubMed Abstract / Google Scholar
Liang, X., Mao, G. und Ng, K. Y. (2005). Auswirkung von Kettenlängen von PEO-PPO-PEO auf die Morphologie und Stabilität kleiner unilamellarer Liposomen: eine AFM-Untersuchung. J. Kolloid-Schnittstelle Sci. 285, 360–372. doi: 10.1016/j.jcis.2004.11.042
PubMed Abstract / CrossRef Full Text / Google Scholar
Liang, X., Mao, G. und Simon Ng, K. Y. (2004b). Sondierung kleiner unilamellarer Eizellbläschen auf Glimmeroberfläche durch Rasterkraftmikroskopie. Kolloide surfen. B Bioschnittstellen 34, 41-51.
PubMed Abstract / Google Scholar
Mao, G., Liang, X. und Ng, K. Y. S. (2004). Enzyklopädie der Nanowissenschaften und Nanotechnologie. In: Marcel Dekker.
Google Scholar
Mastrobattista, E., Koning, G. A. und Storm, G. (1999). Immunoliposomen zur gezielten Abgabe von Antitumormitteln. Adv. Drug Deliv. Offenbarung 40, 103-127. doi: 10.1016/S0169-409X(99)00043-5
CrossRef Volltext / Google Scholar
Mertins, O., und Dimova, R. (2013). Einblicke in die Wechselwirkungen von Chitosan mit Phospholipidvesikeln. Teil II: Membranversteifung und Porenbildung. Langmuir 29, 14552-14559. doi: 10.1021/la4032199
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Metselaar, JM und Storm, G. (2005). Liposomen bei der Behandlung von entzündlichen Erkrankungen. Experte Opin. Drogen Deliv. 2, 465–476. doi: 10.1517/17425247.2.3.465
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Mohammed, A. R., Weston, N., Coombes, A. G., Fitzgerald, M. und Perrie, Y. (2004). Liposomenformulierung von schwer wasserlöslichen Arzneimitteln: Optimierung der Wirkstoffbeladung und ESEM-Stabilitätsanalyse. Int. In: J. Pharm. 285, 23–34. doi: 10.1016/j.ijpharm.2004.07.010
PubMed Abstract / CrossRef Full Text / Google Scholar
Moutardier, V., Tosini, F., Vlieghe, P., Cara, L., Delpero, J. R. und Clerc, T. (2003). Kolloidale Krebsmedikamente Bioverfügbarkeit in oralen Verabreichungsmodellen. Int. In: J. Pharm. 260, 23–38. doi: 10.1016/S0378-5173(03)00231-X
PubMed Zusammenfassung | CrossRef Volltext | Google Scholar
Murphy, D. B. und Davidson, M. W. (2012a). Konfokale Laser-Scanning-Mikroskopie. Grundlagen der Lichtmikroskopie und elektronischen Bildgebung, 2nd Edn. Hoboken, NJ: John Wiley & Söhne, 265-305. doi: 10.1002/9781118382905.ch13
CrossRef Volltext / Google Scholar
Murphy, D. B. und Davidson, M. W. (2012b). Fluoreszenzmikroskopie. Grundlagen der Lichtmikroskopie und elektronischen Bildgebung. Weinheim: John Wiley & Söhne, 199-231. doi: 10.1002/9781118382905.ch11
CrossRef Volltext / Google Scholar
Murphy, D. B. und Davidson, M. W. (2012c). Grundlagen der Lichtmikroskopie und elektronischen Bildgebung. Hoboken, NJ: John Wiley & Söhne, 1-19. doi: 10.1002/9781118382905
CrossRef Volltext / Google Scholar
Murphy, D. B. und Davidson, M. W. (2012d). Polarisationsmikroskopie. Grundlagen der Lichtmikroskopie und elektronischen Bildgebung. Hoboken, Vereinigte Staaten: John Wiley & Söhne, 153-171. doi: 10.1002/9781118382905.ch9
CrossRef Volltext / Google Scholar
Muscariello, L., Rosso, F., Marino, G., Giordano, A., Barbarisi, M., Cafiero, G., et al. (2005). Ein kritischer Überblick über ESEM-Anwendungen im biologischen Bereich. J. Cell. In: Physiol. 205, 328–334. zertifikat: 10.1002/jcp.20444
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Nallamothu, R., Holz, G. C., Pattillo, C. B., Scott, R. C., Kiani, M. F., Moore, B. M., et al. (2006). Ein auf das Tumorgefäßsystem ausgerichtetes Liposomenabgabesystem für Combretastatin A4: Design, Charakterisierung und In-vitro-Bewertung. AAPS PharmSciTech 7:E32. doi: 10.1208/pt070232
PubMed Abstract / CrossRef Volltext / Google Scholar
Nirale, NM, Vidhate, RD und Nagarsenker, MS (2009). Fluticasonpropionat-Liposomen zur pulmonalen Verabreichung. In: Indian J. Pharm. Sci. 71, 709–711.
Google Scholar
Orlova, E. V., Sherman, M. B., Chiu, W., Mowri, H., Smith, L. C. und Gotto, A. M. Jr. (1999). Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Forni, F., Fresta, M. und Vandelli, MA (2005). Rasterkraftmikroskopie und Photonenkorrelationsspektroskopie: zwei Techniken zur schnellen Charakterisierung von Liposomen. EUR. In: J. Pharm. Sci. 25, 81–89. doi: 10.1016.2005.01.020
PubMed Abstract / CrossRef Full Text / Google Scholar
Ruozi, B., Tosi, G., Leo, E. und Vandelli, M. A. (2007). Anwendung der Rasterkraftmikroskopie zur Charakterisierung von Liposomen als Arzneimittel- und Genträger. Talanta 73, 12-22. Ursprungsbezeichnung: 10.1016/j.talanta.2007.03.031
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Ruozi, B., Tosi, G., Tonelli, M., Bondioli, L., Mucci, A., Forni, F., et al. (2009). Flughandbuch-Phasen-Darstellung von weich-hydratisierten Proben: ein vielseitiges Werkzeug, zum der chemisch-physikalischen Studie von Liposomen abzuschließen. J. Liposome Res. 19, 59-67. doi: 10.1080/08982100802584071
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
Sawant, R. R. und Torchilin, V. P. (2012). Herausforderungen bei der Entwicklung zielgerichteter liposomaler Therapeutika. 14, 303-315. artikelnummer: 10.1208/s12248-012-9330-0
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Senior, J. H. (1987). Schicksal und Verhalten von Liposomen in vivo: eine Überprüfung der Kontrollfaktoren. Krit. In: Rev. Ther. Drug Carrier Syst. 3, 123–193.
PubMed Abstract / Google Scholar
Sercombe, L., Veerati, T., Moheimani, F., Wu, S. Y., Sood, A. K. und Hua, S. (2015). Fortschritte und Herausforderungen der liposomenunterstützten Arzneimittelabgabe. Front. Pharmacol. 6:286. Ursprungsbezeichnung: 10.3389/fphar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Torchilin, VP (1994). Immunoliposomen und pegylierte Immunoliposomen: Mögliche Verwendung zur gezielten Abgabe von Bildgebungsmitteln. Immunmethods 4, 244-258. doi: 10.1006/immu.1994.1027
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Van Antwerpen, R. und Gilkey, JC (1994). Kryo-Elektronenmikroskopie zeigt menschliche Low-Density-Lipoprotein-Substruktur. J. Lipid Res. 35, 2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
Willis, M. und Forssen, E. (1998). Ligand-gezielte Liposomen. Adv. Drug Deliv. Offenbarung 29, 249-271. doi: 10.1016/S0169-409X(97)00083-5
CrossRef Volltext | Google Scholar
Zununi Vahed, S., Salehi, R., Davaran, S. und Sharifi, S. (2017). Liposomen-basierte Drug Co-Delivery-Systeme in Krebszellen. Mater. Sci. Eng. In: C Mater. Biol. Appl. 71, 1327–1341. doi: 10.1016/j.msec.2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply