Halobetasolpropionat Salbe
Dosierungsform: Salbe
Medizinisch überprüft von Drugs.com . Zuletzt aktualisiert am 1. März 2020.
- Übersicht
- Nebenwirkungen
- Dosierung
- Professionell
- Wechselwirkungen
- Mehr
Halobetasolpropionat Salbe Beschreibung
Halobetasolpropionat Salbe, 0,05% enthält Halobetasolpropionat, ein synthetisches Kortikosteroid zur topischen dermatologischen Anwendung. Die Kortikosteroide stellen eine Klasse von primär synthetischen Steroiden dar, die topisch als entzündungshemmendes und juckreizstillendes Mittel verwendet werden.
Chemisch halobetasolpropionat ist 21-Chlor-6α, 9-difluor-11β, 17-dihydroxy-16β-methylpregna-1, 4-dien-3-20- dion, 17-propionat, C25H31ClF2O5. Es hat die folgende Strukturformel:
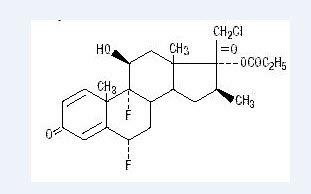
Halobetasolpropionat hat das Molekulargewicht von 485. Es ist ein weißes kristallines Pulver, das in Wasser unlöslich ist.
Jedes Gramm Halobetasolpropionatsalbe enthält 0.5 mg/g Halobetasolpropionat in einer Base aus Aluminiumstearat, Bienenwachs, Pentaerythritcocoat, Petrolatum, Propylenglykol, Sorbitanesquioleat und Stearylcitrat.
Halobetasolpropionatsalbe – Klinische Pharmakologie
Wie andere topische Kortikosteroide wirkt Halobetasolpropionat entzündungshemmend, juckreizstillend und vasokonstriktiv. Der Mechanismus der entzündungshemmenden Wirkung der topischen Kortikosteroide ist im Allgemeinen unklar. Es wird jedoch angenommen, dass Kortikosteroide durch die Induktion von Phospholipase-A2-Hemmproteinen wirken, die zusammen als Lipocortine bezeichnet werden. Es wird postuliert, dass diese Proteine die Biosynthese potenter Entzündungsmediatoren wie Prostaglandine und Leukotriene steuern, indem sie die Freisetzung ihres gemeinsamen Vorläufers Arachidonsäure hemmen. Arachidonsäure wird durch Phospholipase A2 aus Membranphospholipiden freigesetzt.
Pharmakokinetik
Das Ausmaß der perkutanen Resorption topischer Kortikosteroide wird durch viele Faktoren bestimmt, einschließlich des Vehikels und der Integrität der epidermalen Barriere. Es wurde nicht gezeigt, dass Okklusivverbände mit Hydrocortison für bis zu 24 Stunden die Penetration erhöhen; Der Verschluss von Hydrocortison für 96 Stunden verbessert jedoch die Penetration deutlich. Topische Kortikosteroide können von normaler intakter Haut absorbiert werden. Entzündungen und/oder andere Krankheitsprozesse in der Haut können die perkutane Resorption erhöhen.
Human- und Tierstudien zeigen, dass weniger als 6% der applizierten Dosis von Halobetasolpropionat innerhalb von 96 Stunden nach topischer Verabreichung der Halobetasolpropionatsalbe in den Kreislauf gelangen.
Studien, die mit Halobetasolpropionatsalbe durchgeführt wurden, zeigen, dass es im Vergleich zu anderen topischen Kortikosteroiden im superhohen Potenzbereich liegt.
Indikationen und Verwendung für Halobetasolpropionatsalbe
Halobetasolpropionatsalbe ist ein hochwirksames Kortikosteroid zur Linderung der entzündlichen und juckenden Manifestationen von auf Kortikosteroide reagierenden Dermatosen. Eine Behandlung über zwei aufeinanderfolgende Wochen hinaus wird nicht empfohlen, und die Gesamtdosis sollte 50 g / Woche nicht überschreiten, da das Arzneimittel die Hypothalamus-Hypophysen-Nebennieren-Achse (HPA) unterdrücken kann. Die Anwendung bei Kindern unter 12 Jahren wird nicht empfohlen.
Wie bei anderen hochaktiven Kortikosteroiden sollte die Therapie abgebrochen werden, wenn die Kontrolle erreicht ist. Wenn innerhalb von 2 Wochen keine Besserung festgestellt wird, kann eine Neubewertung der Diagnose erforderlich sein.
Kontraindikationen
Halobetasolpropionatsalbe ist bei Patienten mit Überempfindlichkeit gegen einen der Bestandteile der Zubereitung in der Vorgeschichte kontraindiziert.
Vorsichtsmaßnahmen
Allgemein
Die systemische Resorption topischer Kortikosteroide kann zu einer reversiblen Unterdrückung der Hypothalamus-Hypophysen-Nebennieren-Achse (HPA) führen, die nach Absetzen der Behandlung zu einer Glukokortikosteroidinsuffizienz führen kann. Manifestationen des Cushing-Syndroms, der Hyperglykämie und der Glukosurie können bei einigen Patienten auch durch systemische Resorption topischer Kortikosteroide während der Behandlung hervorgerufen werden.
Patienten, die ein topisches Steroid auf eine große Oberfläche oder auf Bereiche unter Okklusion anwenden, sollten regelmäßig auf Anzeichen einer Unterdrückung der HPA-Achse untersucht werden. Dies kann durch Verwendung der ACTH-Stimulation, A.M. Plasma-Cortisol und Urin-Frei-Cortisol-Tests erfolgen. Patienten, die hochwirksame Kortikosteroide erhalten, sollten nicht länger als 2 Wochen gleichzeitig behandelt werden, und aufgrund des erhöhten Risikos einer HPA-Suppression sollten nur kleine Bereiche gleichzeitig behandelt werden.
Halobetasolpropionat Salbe produziert HPA-Achse Unterdrückung, wenn in geteilten Dosen bei 7 Gramm pro Tag für eine Woche bei Patienten mit Psoriasis verwendet. Diese Effekte waren nach Absetzen der Behandlung reversibel.
Wenn eine Unterdrückung der HPA-Achse festgestellt wird, sollte versucht werden, das Arzneimittel abzusetzen, die Häufigkeit der Anwendung zu verringern oder ein weniger wirksames Kortikosteroid zu ersetzen. Die Wiederherstellung der HPA-Achsenfunktion erfolgt im Allgemeinen sofort nach Absetzen der topischen Kortikosteroide. In seltenen Fällen können Anzeichen und Symptome einer Glukokortikosteroidinsuffizienz auftreten, die zusätzliche systemische Kortikosteroide erfordern. Informationen zur systemischen Supplementierung finden Sie unter Verschreibungsinformationen für diese Produkte.Pädiatrische Patienten können aufgrund ihres größeren Verhältnisses von Hautoberfläche zu Körpermasse anfälliger für systemische Toxizität aus äquivalenten Dosen sein (siehe VORSICHTSMAßNAHMEN: Pädiatrische Anwendung).
Wenn sich eine Reizung entwickelt, sollte die Halobetasolpropionatsalbe abgesetzt und eine geeignete Therapie eingeleitet werden. Allergische Kontaktdermatitis mit Kortikosteroiden wird normalerweise diagnostiziert, indem ein Heilungsversagen beobachtet wird, anstatt eine klinische Exazerbation zu bemerken, wie bei den meisten topischen Produkten, die keine Kortikosteroide enthalten. Eine solche Beobachtung sollte durch geeignete diagnostische Pflastertests bestätigt werden.
Wenn begleitende Hautinfektionen vorliegen oder sich entwickeln, sollte ein geeignetes antimykotisches oder antibakterielles Mittel verwendet werden. Wenn eine günstige Reaktion nicht sofort auftritt, sollte die Anwendung von Halobetasolpropionatsalbe abgebrochen werden, bis die Infektion ausreichend kontrolliert wurde.
Halobetasolpropionatsalbe sollte nicht zur Behandlung von Rosazea oder perioraler Dermatitis und nicht im Gesicht, in der Leistengegend oder in den Achselhöhlen angewendet werden.
Informationen für Patienten
Patienten, die topische Kortikosteroide einnehmen, sollten die folgenden Informationen und Anweisungen erhalten:
- Das Medikament ist wie vom Arzt verordnet anzuwenden. Es ist nur zur äußerlichen Anwendung bestimmt. Kontakt mit den Augen vermeiden.
- Das Medikament sollte nicht für andere Erkrankungen als die, für die es verschrieben wurde, verwendet werden.
- Der behandelte Hautbereich sollte nicht verbunden, anderweitig bedeckt oder umwickelt werden, um okklusiv zu sein, es sei denn, dies wird vom Arzt verordnet.
- Patienten sollten ihrem Arzt alle Anzeichen lokaler Nebenwirkungen melden.\
Labortests
Die folgenden Tests können bei der Beurteilung von Patienten auf HPA-Achsensuppression hilfreich sein: ACTH-Stimulationstest; A.M. Plasma-Cortisol-Test; Urin-Frei-Cortisol-Test.
Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
Es wurden keine Langzeitstudien an Tieren durchgeführt, um das karzinogene Potenzial von Halobetasolpropionat zu bewerten. Positive Mutagenitätseffekte wurden in zwei Genotoxizitätstests beobachtet. Halobetasolpropionat war in einem Mikronukleustest des chinesischen Hamsters und in einem Mauslymphom-Genmutationstest in vitro positiv.
Studien an Ratten nach oraler Verabreichung in Dosierungen bis zu 50 mcg/kg/Tag zeigten keine Beeinträchtigung der Fertilität oder der allgemeinen Reproduktionsleistung.
In anderen Genotoxizitätstests wurde Halobetasolpropionat im Ames / Salmonella-Assay, im Schwesterchromatidenaustauschtest in somatischen Zellen des chinesischen Hamsters, in Chromosomenaberrationsstudien an Keim- und somatischen Zellen von Nagetieren und in einem Säugetier-Spot-Test zur Bestimmung von Punktmutationen nicht als genotoxisch befunden.
Schwangerschaft
Teratogene Wirkungen: Schwangerschaftskategorie C
Es wurde gezeigt, dass Kortikosteroide bei Labortieren teratogen sind, wenn sie systemisch in relativ niedrigen Dosierungen verabreicht werden. Einige Kortikosteroide haben sich nach dermaler Anwendung bei Labortieren als teratogen erwiesen.
Es wurde gezeigt, dass Halobetasolpropionat bei SPF-Ratten und Chinchilla-Kaninchen teratogen ist, wenn es während der Trächtigkeit in Dosen von 0,04 bis 0,1 mg / kg bei Ratten und 0,01 mg / kg bei Kaninchen systemisch verabreicht wird. Diese Dosen sind ungefähr 13, 33 und 3mal beziehungsweise die menschliche aktuelle Dosis von Halobetasol Propionate Salbe. Halobetasolpropionat war bei Kaninchen embryotoxisch, bei Ratten jedoch nicht.
Gaumenspalte wurde sowohl bei Ratten als auch bei Kaninchen beobachtet. Omphalozele wurde bei Ratten beobachtet, aber nicht bei Kaninchen.
Es gibt keine ausreichenden und gut kontrollierten Studien zum teratogenen Potenzial von Halobetasolpropionat bei Schwangeren. Halobetasolpropionatsalbe sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Stillende Mütter
Systemisch verabreichte Kortikosteroide treten in der Muttermilch auf und können das Wachstum unterdrücken, die endogene Kortikosteroidproduktion beeinträchtigen oder andere unerwünschte Wirkungen verursachen. Es ist nicht bekannt, ob die topische Verabreichung von Kortikosteroiden zu einer ausreichenden systemischen Resorption führen kann, um nachweisbare Mengen in der Muttermilch zu produzieren. Da viele Arzneimittel in die Muttermilch übergehen, ist Vorsicht geboten, wenn Halobetasolpropionatsalbe einer stillenden Frau verabreicht wird.
Pädiatrische Anwendung
Die Sicherheit und Wirksamkeit von Halobetasolpropionatsalbe bei pädiatrischen Patienten wurde nicht nachgewiesen, und die Anwendung bei pädiatrischen Patienten unter 12 Jahren wird nicht empfohlen. Aufgrund eines höheren Verhältnisses von Hautoberfläche zu Körpermasse haben pädiatrische Patienten ein höheres Risiko als Erwachsene für die Unterdrückung der HPA-Achse und das Cushing-Syndrom, wenn sie mit topischen Kortikosteroiden behandelt werden. Sie haben daher auch ein höheres Risiko für eine Nebenniereninsuffizienz während oder nach Absetzen der Behandlung. Nebenwirkungen, einschließlich Striae, wurden bei unangemessener Anwendung von topischen Kortikosteroiden bei Säuglingen und Kindern berichtet.
HPA-Achsensuppression, Cushing-Syndrom, lineare Wachstumsverzögerung, verzögerte Gewichtszunahme und intrakranielle Hypertonie wurden bei Kindern berichtet, die topische Kortikosteroide erhielten. Manifestationen der Nebennierensuppression bei Kindern umfassen niedrige Plasma-Cortisolspiegel und eine fehlende Reaktion auf ACTH-Stimulation. Manifestationen der intrakraniellen Hypertonie sind prall gefüllte Fontanellen, Kopfschmerzen und bilaterale Papillenödeme.
Geriatrische Anwendung
Von 850 Patienten, die in klinischen Studien mit Halobetasolpropionatsalbe behandelt wurden, waren 21% 61 Jahre und älter und 6% 71 Jahre und älter. Es wurden keine allgemeinen Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Patienten und jüngeren Patienten beobachtet; und andere berichtete klinische Erfahrungen haben keine Unterschiede in den Reaktionen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
Nebenwirkungen
In kontrollierten klinischen Studien schlossen die häufigsten unerwünschten Ereignisse, die für Halobetasolpropionatsalbe berichtet wurden, Stechen oder Brennen bei 1,6% der Patienten ein. Weniger häufig berichtete Nebenwirkungen waren Pustulation, Erythem, Hautatrophie, Leukodermie, Akne, Juckreiz, Sekundärinfektion, Teleangiektasien, Urtikaria, trockene Haut, Miliaria, Parästhesien und Hautausschlag.
Die folgenden zusätzlichen lokalen Nebenwirkungen werden selten bei topischen Kortikosteroiden berichtet, und sie können häufiger bei hochwirksamen Kortikosteroiden wie Halobetasolpropionatsalbe auftreten. Diese Reaktionen sind in ungefähr absteigender Reihenfolge des Auftretens aufgeführt: Follikulitis, Hypertrichose, akneiforme Eruptionen, Hypopigmentierung, periorale Dermatitis, allergische Kontaktdermatitis, Sekundärinfektion, Striae und Miliaria.
Um VERMUTETE NEBENWIRKUNGEN zu melden, wenden Sie sich an Teligent Pharma, Inc. bei 1-856-697-1441 oder FDA bei 1-800-FDA-1088 oder www.FDA.in: gov/ medwatch.
Überdosierung
Bei topischer Anwendung kann Halobetasolpropionatsalbe in ausreichenden Mengen absorbiert werden, um systemische Wirkungen zu erzielen (siehe VORSICHTSMAßNAHMEN) h
Halobetasolpropionatsalbe Dosierung und Anwendung
Tragen Sie ein- oder zweimal täglich eine dünne Schicht Halobetasolpropionatsalbe auf die betroffene Haut auf, wie von Ihrem Arzt verordnet, und reiben Sie sie sanft und vollständig ein.
Halobetasolpropionat Salbe ist ein super-hochwirksames topisches Kortikosteroid; daher sollte die Behandlung auf zwei Wochen begrenzt werden, und Mengen von mehr als 50 g / Woche sollten nicht angewendet werden. Wie bei anderen Kortikosteroiden sollte die Therapie abgebrochen werden, wenn die Kontrolle erreicht ist. Wenn innerhalb von 2 Wochen keine Besserung festgestellt wird, kann eine Neubewertung der Diagnose erforderlich sein.
Halobetasolpropionat Salbe sollte nicht mit Okklusivverbänden verwendet werden.
Wie wird Halobetasolpropionatsalbe geliefert
Halobetasolpropionatsalbe, 0,05% wird in den folgenden Röhrchengrößen geliefert:
50 g (NDC 63739-998-67)
LAGERUNG
Lagern Sie Halobetasolpropionatsalbe zwischen 15 ° C und 30 ° C (59 ° F und 86 ° F).
Hergestellt von:
Teligent Pharma, Inc.
Buena, NJ 08310
Vertrieben von:
McKesson Corporation
dba Sky Packaging
4971 Southridge Blvd., Suite 101
Memphis, TN 38141
PI-073-00
C101430 Rev 02/2020
VERPACKUNGSETIKETT.PRINCIPAL DISPLAY PANEL 50 Gramm Karton
NDC 63739-998-67
Halobetasolpropionat
Salbe, 0,05%
Nur zur topischen Anwendung.
Nicht für den einsatz in augen.
Nettogewicht. 50 grams
Rx Only

| HALOBETASOL PROPIONATE Halobetasol Propionate Ointment |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – McKesson Corporation (140529962)
Registrant – Teligent Pharma, Inc. (011036910)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Teligent Pharma, Inc. | 011036910 | manufacture(63739-998) | |
Frequently asked questions
- Halobetasol vs. clobetasol – how do they compare?
- Kann dies für Poison Ivy verwendet werden?
- Kann es auf der Kopfhaut angewendet werden?
Mehr über Halobetasol topisch
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungsinformationen
- Wechselwirkungen mit anderen Medikamenten
- Alternativen vergleichen
- Preise & Gutscheine
- 25 Bewertungen
- : topical steroids
Consumer resources
- Patient Information
- Halobetasol Topical application (Advanced Reading)
Professional resources
- Prescribing Information
- Halobetasol (FDA)
- Halobetasol Cream (FDA)
- Halobetasol Foam (FDA)
Other brands Ultravate, Lexette, Bryhali, Halonate
Related treatment guides
- Plaque Psoriasis
- Eczema
- Psoriasis
- Atopic Dermatitis
- Granuloma Annulare
- Dermatitis
Medical Disclaimer
Leave a Reply