Licht auf einen blassen Sehnerv werfen
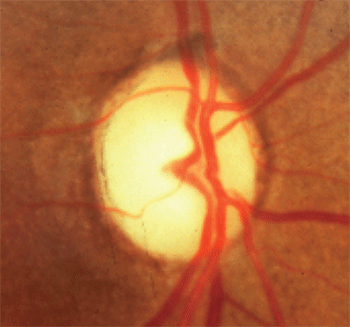
1. Papille Blässe über Schröpfen.
Verschiedene Beleidigungen des Sehnervs können auftreten und sich ophthalmoskopisch als Blässe, Atrophie, Schröpfen und Einkerben manifestieren. Bei weitem ist das häufigste Sehnervenleiden das Glaukom.
Das Glaukom weist eine sehr charakteristische kavernöse Atrophie auf, die allgemein als „Schröpfen“ oder „Einkerben“ bezeichnet wird.“ Diese ausgeprägte Neuropathie zeigt eine Vergrößerung des Papillenbechers — vorzugsweise in den unteren und oberen Regionen — mit einem vergrößerten vertikalen Schröpfmuster und einer Beeinträchtigung oder Auslöschung des neuroretinalen Randes.
Bei dieser chronischen Erkrankung fehlt typischerweise Blässe. Das Randgewebe bleibt gut durchblutet, obwohl fokale Schäden am oberen und unteren neuroretinalen Rand auftreten.Gelegentlich weisen Patienten glaukomatöse Sehnerven auf und weisen zusätzliche Merkmale wie Blässe auf, die auf das Vorhandensein eines anderen Zustands oder einer Entität zusätzlich zum Glaukom hinweisen. Es gibt auch mehrere klinische Einheiten und Situationen, in denen der Sehnerv beeinträchtigt werden kann und oberflächlich einem Glaukom ähnelt. Es ist unbedingt erforderlich, diese nicht-glaukomatösen Neuropathien korrekt vom Glaukom zu unterscheiden.
Gibt es Papillenblässe?
Identifizierung von Papille Blässe ist manchmal schwierig, wenn der Zustand subtil ist, oder es gibt Medien und Katarakt Probleme beeinträchtigen Urteil. Es kann auch schwierig sein, echte Bandscheibenblässe von Nachahmungen zu unterscheiden. Beispielsweise gehen nach der Kataraktextraktion die lichtabschwächenden Eigenschaften der natürlichen Linse verloren. Die Scheibe kann blass erscheinen, aber es gibt keine Nervenfunktionsstörung — dies wird als „pseudophakischer Pseudopallor“ bezeichnet und kann ziemlich beunruhigend und irreführend sein.1
In einseitigen Fällen hilft es, jede Disc zu fotografieren und nebeneinander zu vergleichen. Auf diese Weise kann die Blässe der Papille auf einem Auge leichter identifiziert werden, selbst wenn sie subtil ist.
 |
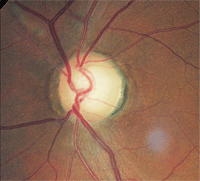 |
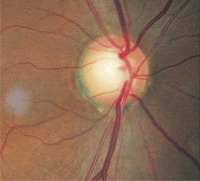
| 2. Relative Blässe der Bandscheibe, O.D. (links) im Vergleich zu O.S. (rechts). Die größere Blässe im linken Auge weist auf eine Optikusatrophie hin. | |
Optikusatrophie, die sich als Blässe der Papille manifestiert, existiert selten isoliert. Daher ist es unerlässlich, nach einer damit verbundenen Funktionsstörung des Sehnervs zu suchen, um die Nachahmungszustände von einer echten Optikusatrophie zu trennen.
Assoziationen, die auf eine echte Optikusatrophie hindeuten, umfassen Gesichtsfeldverlust, Verringerung der Sehschärfe, Dyschromatopsie, relativ afferenter Pupillendefekt (wenn einseitig oder asymmetrisch) und Schädigung der Nervenfaserschicht der Netzhaut. In Ermangelung einer solchen Anomalie müssen Sie sich fragen, ob der Patient eine echte Optikusatrophie hat.
Die Blässe der Papille, die auf eine Optikusatrophie hinweist, ist eher ein Befund als eine Diagnose. Wenn identifiziert, muss eine Erklärung oder zugrunde liegende Ursache gesucht werden. Der Begriff Blässe sollte niemals kavalier verwendet werden. Das heißt, schreiben Sie niemals, dass Sie eine Blässe auf der Karte eines Patienten sehen oder vermuten, es sei denn, es wird eine Untersuchung der Ursache durchgeführt. Wenn Sie keine Erklärung für die Blässe der Bandscheibe haben, müssen Sie ein geeignetes Neuroimaging erhalten. Das Versäumnis, einen aufgezeichneten Befund von Bandscheibenblässe zu untersuchen, ist vergleichbar mit dem Schreiben auf ein Patientendiagramm: „Ich denke, dass der Patient einen Gehirntumor haben könnte … aber ich entscheide mich, nichts dagegen zu tun.“
Es gibt zahlreiche Ursachen für Optikusatrophie, darunter direkte Kompression des Nervs oder Chiasma durch eine Massenläsion, Infarkt, Trauma, chronische Entzündung, Infiltration und Stoffwechselstörung, um nur einige zu nennen.
Kompressive Läsionen, die Bandscheibenblässe verursachen
Eine kompressive Neuropathie durch eine Massenläsion kann häufig zu Bandscheibenblässe und Optikusatrophie führen. Eine längere Kompression führt zu einer Optikusatrophie, die mit Blässe und / oder Schröpfen des Nervenkopfes einhergehen kann. Am Scheibenrand können optoziliäre Kollateralgefäße festgestellt werden.2,3 Häufig kommt es zu einem verstärkten progressiven Schröpfen des Sehnervenkopfes, ähnlich wie beim Glaukom.4-6 Der Hauptunterscheidungsfaktor zur glaukomatösen Optikusatrophie ist die Blässe des verbleibenden neuroretinalen Randes bei kompressiver Neuropathie.

3. Der gleiche Patient wie oben hatte einen bitemporalen Gesichtsfelddefekt sekundär zum Chiasmaltumor.
Es gibt auch einen signifikanteren neuroretinalen Randkompromiss in Form von Einkerbungen, der beim Glaukom auftritt, jedoch nicht bei kompressiven Läsionen, bei denen der Anstieg symmetrischer mit Blässe ist. Assoziierte Felddefekte mit kompressiven Läsionen umfassen zentrale Skotome, bogenförmige oder altitudinale Defekte, parazentrale Skotome, Feldverengung und Defekte, die die vertikale hemianopische Linie respektieren.
Das direkte Auftreffen des Sehnervs ist der Kompromissmechanismus bei der kompressiven Optikusneuropathie. Meistens, Dies ergibt sich aus einer raumgreifenden Masse innerhalb der Umlaufbahn; obwohl es am optischen Chiasma oder suprasellaren Zisterne auftreten kann. In diesen Fällen hat der Patient wahrscheinlich einen vertikal ausgerichteten Gesichtsfeldverlust.
Zu den mit einer kompressiven Optikusneuropathie verbundenen Zuständen gehören: eine dolichoektatische Halsschlagader; Mukozele; Schilddrüsen-Ophthalmopathie; Neoplasmen, einschließlich Sehnervengliome, Nervenscheidenmeningeome, Dermoidzysten, Neurilemmome (Schwannome) und orbitale Metastasen; Gefäßanomalien wie kavernöses Hämangiom, Lymphangiom, einfache venöse Varix, arteriovenöse Malformation, Karotisaneurysma und karotiskavernöse Fistel; entzündungen, einschließlich orbitaler Cellulitis und orbitalem Pseudotumor; Wegener-Granulomatose; und subperiostale oder intraorbitale Blutung.7-16
Die Pathogenese dieses Zustands ist eine mechanische Kompression des Nervs, die eine Stagnation des axoplasmatischen Flusses innerhalb der einzelnen Neuronen induziert — sowohl in der langsamen als auch in der schnellen Phase des axoplasmatischen Transports. Diese axoplasmatische Stase verursacht eine nachfolgende Schwellung der Axone sowie ein Austreten von intrazellulären Flüssigkeiten, Lipiden und Proteinen in den extrazellulären Raum der prälaminären Papille.
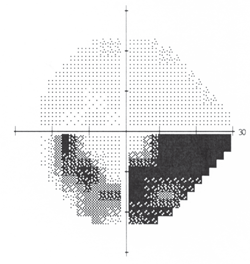
4. Inferior arcuate Defekt, der mit Glaukom konsistent war.
Gefäßveränderungen treten sekundär auf, da die venöse Drainage über die zentrale Netzhautvene durch anhaltende mechanische Beanspruchung behindert wird. Wenn dieser Prozess anhält, folgt eine Hypoxie und Desorganisation der normalen neuralen Matrix. Unbehandelt kommt es letztendlich zu einer Optikusatrophie. Die Atrophie kann vollständig oder sektoral sein. Im Jahr 1998 veröffentlichten David Greenfield, M.D., und Kollegen ein wegweisendes Papier, in dem diskutiert wurde, welche Patienten mit Glaukom Neuroimaging benötigen.17 In ihrer retrospektiven Analyse verglichen sie Glaukom-Patienten mit normalem Augeninnendruck (IOD) und Neuroimaging als Teil ihrer Bewertung (aufgrund des normalen IOD) mit Patienten, bei denen kompressive Läsionen diagnostiziert wurden.
Sie stellten fest, dass keiner der Patienten, bei denen ein Glaukom mit normaler Spannung diagnostiziert wurde, neuroradiologische Hinweise auf eine Massenläsion im vorderen Sehweg hatte. Sie fanden auch heraus, dass im Vergleich zur Kontrollgruppe mit Massenläsionen diese Patienten mit Glaukom älter waren und eine bessere Sehschärfe, einen größeren vertikalen Verlust des neuroretinalen Randes, häufigere Bandscheibenblutungen, weniger Blässe des neuroretinalen Randes und mehr Nervenfaserbündel hatten Defekte entlang der horizontalen Mittellinie ausgerichtet.
Im Gegensatz dazu waren diese Patienten mit Massenläsionen des vorderen Sehwegs typischerweise unter 50 Jahre alt und zeigten eine Sehschärfe von weniger als 20/40, vertikal ausgerichtete Gesichtsfelddefekte und Papillenblässe über dem Schröpfen (Abbildung 1). Sie kamen zu dem Schluss, dass jüngeres Alter, geringere Sehschärfe, vertikal ausgerichtete Gesichtsfelddefekte und neuroretinale Randblässe eher auf eine kompressive Massenläsion hindeuten als auf ein Glaukom.
Fallbeispiele
Fall 1. Ein 56-jähriger schwarzer Mann präsentierte sich zu einer Glaukomberatung. Er hatte mit Glaukom sechs Jahre zuvor in Nigeria diagnostiziert worden, aber nie eine Behandlung erhalten.
Seine am besten korrigierte Sehschärfe betrug 20/30 O.D. und die Lichtwahrnehmung O.S. Seine Pupillen waren gleich und reaktiv mit einem linken relativ afferenten Defekt. Der Augeninnendruck betrug 30 mm Hg O.D. und 23 mm Hg O.S. Die Biomikroskopie ergab keine Anomalien, und die Gonioskopie zeigte normale, offene Vorderkammerwinkel.
Die Untersuchung des erweiterten Fundus ergab ein Schröpfen der Papille von 0,75 / 0,75 O.D. und 0,80 / 0,80 O.S. Der linke neuroretinale Rand war deutlich geschädigt. Die Analyse der Nervenfaserschicht mittels Scanning-Laser-Polarimetrie war im linken Auge abnormal. Am bemerkenswertesten war jedoch, dass der verbleibende linke neuroretinale Rand im Vergleich zum anderen Auge blass war (Abbildung 2).
Der Patient hatte eindeutig eine Optikusatrophie im linken Auge. Darüber hinaus stimmte seine Schärfe der Lichtwahrnehmung nicht mit dem Schröpfen der Papille von 0,80 / 0,80 überein, wenn das Glaukom die alleinige Ursache war. Zu diesem Zeitpunkt wurde bei ihm ein Glaukom als eine mögliche Erkrankung diagnostiziert und der Verdacht auf eine zusätzliche Neuropathie.
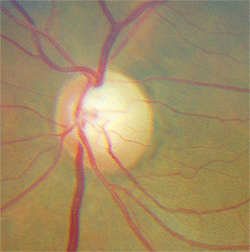
5. Derselbe Patient wie oben zeigte eine überlegene Randkerbung und Blässe.
Die Schwellenperimetrie ergab einen bitemporalen Gesichtsfelddefekt, der die vertikale hemianopische Linie des rechten Auges respektierte und zur Fixierung im linken Auge überging (Abbildung 3). Dies war konsistent mit einem Chiasma-Tumor. Magnetresonanztomographie (MRT) bestätigte die Diagnose.
Dieser Patient hatte sowohl einen Tumor als auch ein Glaukom. Der wichtigste diagnostische Befund war die Blässe der Bandscheibe und der Verlust der Sehschärfe, der viel schlimmer war als beim Glaukom zu erwarten, sowie der vertikal ausgerichtete Gesichtsfeldverlust.
Fall 2. Eine 53-jährige schwarze Frau wurde wegen Verdachts auf Glaukom überwiesen. Sie hatte keine Seh- oder Augenbeschwerden. Ihre am besten korrigierte Sehschärfe betrug 20/20 in jedem Auge.
Die Pupillen waren reaktiv, mit einem relativ afferenten Defekt im linken Auge. Der Farbtest war normal. Es gab keine biomikroskopischen Anomalien und ihre Vorderkammerwinkel waren gonioskopisch offen. Der gemessene Augeninnendruck betrug 30 mm Hg O.D. und 32 mm Hg O.S.
Die Schwellenperimetrie ergab einen vollen und normalen Feld-O.D. und einen dichten inferioren bogenförmigen Defekt O.S., der mit einem Glaukom übereinstimmte (Abbildung 4). Die erweiterte Untersuchung gab Anlass zur Sorge. Ihre rechte Papille war rosa, deutlich und normal. Allerdings war der linke Nerv des Patienten, während er eine Einkerbung des oberen temporalen neuroretinalen Randes zeigte, auch in dieser Region blass (Abbildung 5).
Obwohl ihre Sehschärfe und ihr Farbsehen normal waren und ihr Augeninnendruck eindeutig in einem glaukomatösen Bereich lag, ließen die Einseitigkeit und das Vorhandensein von Blässe in ihrem linken Auge den Verdacht auf einen Sehnervenkompressionstumor aufkommen. Der Patient wurde einer MRT der Orbits und des Chiasmas unterzogen — sowohl mit als auch ohne Kontrast —, was sich als normal herausstellte.
Trotz des verdächtigen Aussehens der Bandscheibe hat der Patient nichts weiter als ein Glaukom und ist weiterhin gut mit einer topischen Glaukomtherapie.
Betrachten Sie Retinale Ursachen
Fall 3. Ein 72-jähriger indischer Mann wurde zu einer Glaukomberatung überwiesen. Er war lange Zeit ein Verdächtiger für ein Glaukom mit normaler Spannung gewesen, das auf einem leicht asymmetrischen Bandscheibenhöpfen und einem Gesichtsfeldverlust beruhte, der einige Jahre zuvor beobachtet worden war.
Er war von einer Reihe von Ärzten in einem universitären Umfeld gesehen worden. Er hatte intermittierend eine Glaukombehandlung erhalten, und seine Akte ergab, dass keine Medikamentenstudie jemals seinen Augeninnendruck unter den unbehandelten Bereich von 12 mm Hg bis 14 mm Hg zu senken schien.
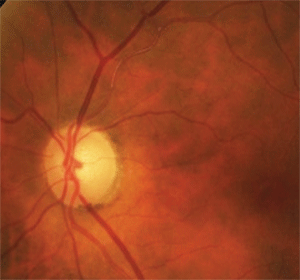
6. Die Blässe der oberen Temporalscheibe und die sklerotische, verschlossene Arteriole waren auf einen alten
asymptomatischen Verschluss der Netzhautarterie zurückzuführen.
Seine Krankengeschichte war signifikant für kontrollierte Hypertonie und Hypercholesterinämie. Nach Überprüfung der Vorgeschichte des Patienten und scheinbar unwirksamer medizinischer Therapie schlug ein früherer Arzt vor, den Patienten ohne Behandlung zu überwachen. Zuletzt hatte ein anderer Arzt in der Einrichtung eine überlegene Blässe der Bandscheibe im linken Auge festgestellt und eine andere Meinung eingeholt. Die am besten korrigierte Sehschärfe des Patienten betrug 20/20 O.D. und O.S. Es gab keinen relativen afferenten Pupillendefekt in beiden Augen. Der Patient hatte keine visuellen oder Augenbeschwerden, verstand aber, dass er aufgrund dessen, was ihm in den letzten Jahren erklärt worden war, ein Glaukomverdächtiger war. Die Analyse der vergangenen Schwellenperimetrie ergab ein unveränderliches inferiores bogenförmiges Skotom im linken Auge und ein normales Gesichtsfeld im rechten Auge. Erweiterte Fundusinspektion der Sehnerven ergab ein Cup-to-Disc-Verhältnis von 0,6 x 0,5 O.U. Die rechte Papille war normal ohne Blässe oder glaukomatöse Veränderungen. Es gab keinen fokalen Kompromiss des neuroretinalen Randes des linken Auges, der den Gesichtsfeldverlust erklären würde, wenn Glaukom die Ursache wäre. Es gab jedoch Blässe der oberen Scheibe des linken Auges, die dem Feldverlust entsprach. Somit hatte der Patient eine Blässe der Bandscheibe, die über das Schröpfen hinausging, was auf eine andere Ursache als das Glaukom hinwies.
Zu diesem Zweck ergab eine sorgfältige Untersuchung des angrenzenden Netzhautgefäßsystems eine Sklerose der Arteriole temporalis superior vor und über die erste Bifurkation hinaus (Abbildung 6). Zusätzlich gab es schwache Netzhautkollateralgefäße im oberen Temporalbereich, die auf einen früheren Netzhautgefäßverschluss hinwiesen. In diesem Fall waren der Feldverlust und die Blässe der Bandscheibe des Patienten auf einen alten asymptomatischen Verschluss der Netzhautarterie zurückzuführen.
Blässe der Papille
Wenn eine Blässe der Papille zu sehen ist, versuchen Sie, den Befund mit einer Funktionsstörung des Sehnervs zu bestätigen. Stellen Sie sicher, dass Sie Farbsichttests, Pupilleninspektion, Schwellenperimetrie, am besten korrigierte Sehschärfemessung und Bewertung der Netzhautnervenfaserschicht durchführen. Diese Tests können Sie zum Ort und zur Art des Problems führen.
Die Patientengeschichte ist entscheidend. Überprüfen Sie, ob dem Patienten Änderungen bekannt sind. Wenn ein Sehverlust vorliegt, versuchen Sie festzustellen, ob die Reduktion schrittweise (Hinweis auf Kompressionsläsionen) oder abrupt (Hinweis auf einen Sehnerv- oder Netzhautinfarkt) erfolgte. Identifizieren Sie, ob Schmerzen mit Sehverlust verbunden waren (wie bei Optikusneuritis) oder ob der Zustand schmerzlos war (im Einklang mit einer nicht arteriitischen anterioren ischämischen Optikusneuropathie). Schließlich überprüfen Sie sorgfältig die Vergangenheit und Gegenwart der Krankengeschichte des Patienten für alle möglichen beitragenden Bedingungen, wie Multiple Sklerose, Schilddrüsenfunktionsstörungen oder Krebs.
Bei Verdacht auf Sehnervenkompression sollte eine MRT der Orbits und des Chiasmas mit und ohne Kontrast angeordnet werden. Vorzugsweise sollte diese Abbildung in einer geschlossenen Einheit durchgeführt werden, da das Detail besser ist. Wenn der Verdacht auf eine Kompression des Chiasma oder des vorderen Sehwegs besteht, ist die Bildgebung der Bahnen und des Chiasmas aufschlussreicher als die des Gehirns.
Bedenken Sie, dass die Blässe der Papille eher ein Befund als eine Diagnose ist und dass eine Ursache gesucht werden muss. Notieren Sie niemals Blässe in der Akte eines Patienten, ohne diesen Befund vorher zu erklären oder darauf zu reagieren. Unterscheiden Sie sorgfältig die Blässe der Bandscheibe von der glaukomatösen Atrophie. Denken Sie immer daran, dass Blässe, die über das Schröpfen hinausgeht, auf etwas anderes als — oder zusätzlich zu — Glaukom hinweist, aber dass nichts einen Nerv wie Glaukom einkerbt.
Dr. Sowka ist Professor am Nova Southeastern University College für Optometrie in Fort Lauderdale, Florida. Er ist auch Leiter der fortgeschrittenen Pflege und Direktor der Glaukomdienste am Eye Care Institute der Nova Southeastern University.
1. Snydacker D: Die normale Papille. Ophthalmoskopische und fotografische Studien. Am J Ophthalmol 1964; 58:958-964. Wilhelm H, Dörr S, Paulsen F, et al. Frühe Symptome und Befunde bei Sehnerven-Meningeomen. In: Clin Monbl Augenheilkd. 2009 November;226(11): 869-74.
3. Rebolleda G, Corcóstegui J, Arruabarrena C, et al. Optoziliäre Shuntgefäße bei kompressiver Optikusneuropathie durch die intrakranielle A. carotis interna. In: Eur J Ophthalmol. 2008 März-April;18(2):316-9.
4. Roodhooft JM. Nonglaucomatous optic disk atrophy and excavation in the elderly. Bull Soc Belge Ophtalmol. 2003;(287):45-9.5. Hokazono K, Moura FC, Monteiro ML. 5. Optic nerve meningioma mimicking progression of glaucomatous axonal damage: a case report. Arq Bras Oftalmol. 2008 Sep-Oct;71(5):725-8.
6. Greenfield DS. Glaucomatous versus nonglaucomatous optic disc cupping: clinical differentiation. Semin Ophthalmol. 1999 Jun;14(2):95-108.
7. Rosen N, Ben Simon GJ. Orbital decompression in thyroid related orbitopathy. Pediatr Endocrinol Rev. 2010 Mar;7(Suppl 2):217-21.
8. Goh MS, McNab AA. Orbitale Dekompression bei Graves ‚Orbitopathie: Wirksamkeit und Sicherheit. Intern Med J. 2005 Oktober;35(10):586-91.
9. Robert PY, Camezind P, Adenis JP. Komplikationen der dysthyroiden Ophthalmopathie. J Fr Ophtalmol. 2004 September;27(7): 819-21.
10. Oono S, Kurimoto T, Fukazawa K, Mimura O. Kompressive Optikusneuropathie durch eine Nasennebenhöhlenzyste der Wegener-Granulomatose. In: Jpn J Ophthalmol. 2007 November-Dezember;51(6):480-1.
11. Chua CN, Alhady M, Ngo CT, et al. Solitäres nasales Neurofibrom, das sich als kompressive Optikusneuropathie darstellt. Auge (Lond). 2006 Dezember;20(12): 1406-8.
12. Mansour BIN, Salti HALLO. Multiples Myelom mit Sehnervenkompression. Auge (Lond). 2001 Dezember;15(Pt 6): 802-4.
13. Wu W, Sun MT, Kanone PS, et al. Wiederherstellung der Sehfunktion bei einem Patienten mit einer Onodi-Zell-Mukozele kompressive Optikusneuropathie, die ein 5-wöchiges Intervall zwischen Beginn und chirurgischem Eingriff hatte: ein Fallbericht. J Ophthalmol. 2010;2010:483056. Epub 2010 Oktober 12.
14. George JL, Marchal JC. Orbitaltumoren bei Kindern: klinische Untersuchung, Bildgebung, spezifisches Fortschreiten. Neurochirurgie. 2010 April-Juni;56(2-3):244-8.
15. Aakalu VK, Ahmad AZ. Wegener Granulomatose verursacht kompressive Optikusneuropathie bei einem Kind. Ophthal Plast Reconstr Surg. 2009 Juli-August;25(4):327-8.
16. Jacobson DM. Symptomatische Kompression des Sehnervs durch die Halsschlagader: Klinisches Profil von 18 Patienten mit 24 betroffenen Augen, identifiziert durch Magnetresonanztomographie. Augenheilkunde. 1999 Oktober;106(10):1994-2004.
17. Greenfield DS, Siatkowski RM, Glaser JS, et al. Die hohle Scheibe: Wer braucht Neuroimaging? Augenheilkunde. 1998 Oktober;105:1866-74.
Leave a Reply