Organische Chemie II

Experimentell wird jedoch beobachtet, dass es eine signifikante Barriere für die Rotation um die C2-C3-Bindung gibt und dass das gesamte Molekül planar ist. Darüber hinaus ist die C2-C3-Bindung 148 pm lang, kürzer als eine typische Kohlenstoff-Kohlenstoff-Einfachbindung (etwa 154 pm), obwohl länger als eine typische Doppelbindung (etwa 134 pm).
Die Molekülorbitaltheorie berücksichtigt diese Beobachtungen mit dem Konzept der delokalisierten Pi-Bindungen. In diesem Bild kombinieren sich die vier 2p-Atomorbitale mathematisch zu vier pi-Molekülorbitalen mit zunehmender Energie. Zwei davon – die bindenden Pi-Orbitale – haben eine niedrigere Energie als die p–Atomorbitale, aus denen sie gebildet werden, während zwei – die antibindenden pi * -Orbitale – eine höhere Energie haben.

Das Molekülorbital mit der niedrigsten Energie, pi1, hat nur konstruktive Wechselwirkung und Nullknoten. Höher in der Energie, aber immer noch niedriger als die isolierten p–Orbitale, hat das pi2-Orbital einen Knoten, aber zwei konstruktive Wechselwirkungen – somit ist es insgesamt immer noch ein Bindungsorbital. Betrachtet man die beiden antibindenden Orbitale, hat pi3 * zwei Knoten und eine konstruktive Wechselwirkung, während pi4 * drei Knoten und null konstruktive Wechselwirkungen hat.
Nach dem Aufbauprinzip werden die vier Elektronen aus den isolierten 2pz-Atomorbitalen in die bindenden pi1- und pi2-MO’s gelegt. Da pi1 eine konstruktive Wechselwirkung zwischen C2 und C3 beinhaltet, gibt es im 1,3-Butadienmolekül einen Grad der Pi-Bindungswechselwirkung zwischen diesen beiden Kohlenstoffen, der für seine kürzere Länge und die Rotationsbarriere verantwortlich ist. Das Valenzbindungsbild von 1,3-Butadien zeigt, dass die beiden Pi-Bindungen voneinander isoliert sind, wobei jedes Paar von Pi-Elektronen in seiner eigenen Pi-Bindung ’steckt‘. Die Molekülorbitaltheorie sagt jedoch (genau) voraus, dass die vier Pi-Elektronen zu einem gewissen Grad delokalisiert oder über das gesamte Pi-System verteilt sind.

1,3-Butadien ist das einfachste Beispiel für ein System konjugierter Pi-Bindungen. Um als konjugiert zu gelten, müssen zwei oder mehr pi–Bindungen nur durch eine Einzelbindung getrennt sein – mit anderen Worten, es kann keinen dazwischenliegenden sp3-hybridisierten Kohlenstoff geben, da dies das überlappende System paralleler p-Orbitale aufbrechen würde. In der folgenden Verbindung sind beispielsweise die C1-C2- und C3-C4-Doppelbindungen konjugiert, während die C6-C7-Doppelbindung von den beiden anderen Pi-Bindungen durch sp3-hybridisiertes C5 isoliert wird.

Ein sehr wichtiges Konzept, das es zu beachten gilt, ist, dass mit der Konjugation eine inhärente thermodynamische Stabilität verbunden ist. Diese Stabilität kann experimentell durch Vergleich der Hydrierwärme zweier verschiedener Diene gemessen werden. (Hydrierung ist ein Reaktionstyp, über den wir in Kapitel 15 viel mehr erfahren werden: Im Wesentlichen ist es der Prozess der Zugabe eines Wasserstoffmoleküls – zwei Protonen und zwei Elektronen – zu einer p-Bindung). Wenn die beiden konjugierten Doppelbindungen von 1,3-Pentadien zu Pentan ‚hydriert‘ werden, werden pro Mol gebildetem Pentan etwa 225 kJ freigesetzt. Vergleichen Sie das mit den etwa 250 kJ/mol, die freigesetzt werden, wenn die beiden isolierten Doppelbindungen in 1,4-Pentadien hydriert werden, wobei auch Pentan entsteht.
Die Bildung synthetischer Polymere aus Dienen wie 1,3-Butadien und Isopren wird in Abschnitt 18.5 diskutiert. Synthetische Polymere sind große Moleküle, die aus kleineren Wiederholungseinheiten bestehen. Sie sind wahrscheinlich mit einer Reihe dieser Polymere vertraut; zum Beispiel Polyethylen, Polypropylen, Polystyrol und Poly (Vinylchlorid).

Abbildung 13.6: Energiediagramm für die Hydrierung von 1,3-Butadien (nicht maßstabsgetreu).
Da die Hydrierung von 1,3-Butadien weniger als die vorhergesagte Energiemenge freisetzt, muss der Energiegehalt von 1,3-Butadien niedriger sein, als wir vielleicht erwartet hätten. Mit anderen Worten, 1,3-Butadien ist stabiler als seine Formel vermuten lässt.
Das konjugierte Dien hat eine geringere Energie: mit anderen Worten, es ist stabiler. Im Allgemeinen sind konjugierte Pi-Bindungen stabiler als isolierte Pi-Bindungen.
Hier ist ein Energiediagramm, das verschiedene Arten von Bindungen mit ihren Hydrierungswärmen (pro Mol) vergleicht, um die relative Stabilität jedes Moleküls zu zeigen (1 kcal = 4,18 kJ). (Je niedriger die Hydrierungswärme (pro Pi-Bindung) ist, desto stabiler ist die Struktur.)
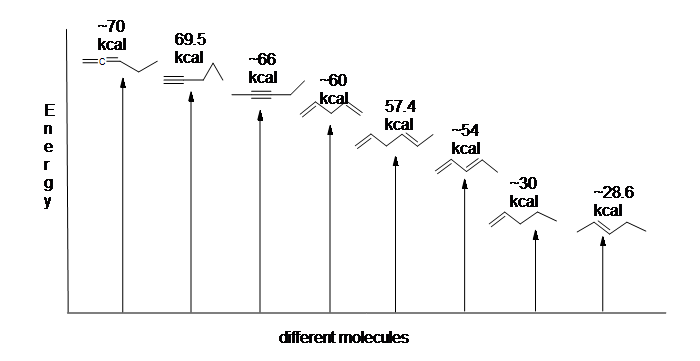
Die Stabilisierung von Dienen durch Konjugation ist weniger dramatisch als die aromatische Stabilisierung von Benzol. Dennoch können ähnliche Resonanz- und Molekülorbitalbeschreibungen der Konjugation geschrieben werden.
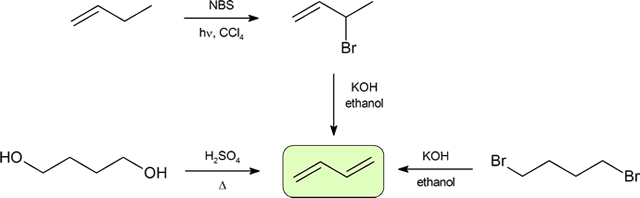
Synthese von Dienen
Die beiden häufigsten Methoden zur Synthese konjugierter Dienen sind die Dehydratisierung von Alkoholen und die Dehydrohalogenierung von Organohalogeniden, die bei der Herstellung von Alkenen eingeführt wurden (Abschnitt 9.9). Das folgende Schema veranschaulicht einige der Wege zur Herstellung eines konjugierten Diens.
Konjugierte pi-Systeme können Sauerstoff- und Stickstoffatome sowie Kohlenstoff umfassen. Im Stoffwechsel von Fettmolekülen sind einige der Schlüsselreaktionen Alkene, die an Carbonylgruppen konjugiert sind.


Übungen
Übung 2.9: Identifizieren Sie alle konjugierten und isolierten Doppelbindungen in den folgenden Strukturen. Geben Sie für jedes konjugierte pi-System die Anzahl der überlappenden p-Orbitale und die Anzahl der pi-Elektronen an.

Leave a Reply