Phosphofructokinase (PFK)
Inhalt
- 1 Einführung
- 2 Rolle bei der Glykolyse
- 3 Mechanismus und Regulation der Phosphofructokinase
- 4 Regulation
- 5 Konformationsänderungen in einer dimeren Einheit von PFK
- 6 Die wichtigsten Konformationsänderungen in einer Untereinheit von PFK.
- 7 Site-Directed Mutagenesis
- 8 Krankheit
- 9 3D-Strukturen von PFK
Einführung
Phosphofructokinase-1 (PFK-1) ist ein glykolytisches Enzym, das den Transfer einer Phosphorylgruppe von bis nach und katalysiert . Siehe Glykolyseenzyme. Mg2+ ist auch in dieser Reaktion wichtig (). Phosphofructokinase-2 (PFK-2) wirkt auf die gleichen Substrate, um ADP und zu ergeben. . Die PFK-Reaktion ist unter physiologischen Bedingungen stark exergonisch (irreversibel) und daher einer der geschwindigkeitsbestimmenden Schritte des glykolytischen Weges. In den meisten Organismen / Geweben ist PFK das wichtigste flussregulierende Enzym des glykolytischen Weges; Seine Aktivität wird durch die Konzentrationen einer ungewöhnlich großen Anzahl von Metaboliten einschließlich ATP, ADP, AMP, PEP und Fructose-2,6-Bisphosphat gesteuert.
ist ein Tetramer mit identischen 320-Rest-Untereinheiten. Es ist ein allosterisches Enzym, das unter Verwendung des Symmetriemodells des Allosterismus beschrieben wird, wobei es einen konzertierten Übergang von seinem hochaktiven R-Zustand zu seinem niedrigaktiven T-Zustand gibt. Die Röntgenstrukturen sowohl des R- als auch des T-Zustands des Enzyms wurden berichtet. Die Bindung eines Moleküls seines Substrats F6P, das mit hoher Affinität an das Enzym im R-Zustand, aber mit geringer Affinität an das Enzym im T-Zustand bindet, bewirkt, dass PFK den R-Zustand einnimmt, was wiederum die Bindungsaffinität des Enzyms für zusätzliches F6P erhöht (ein homotroper Effekt). Aktivatoren wie ADP und AMP binden an sogenannte allosterische, vom aktiven Zentrum verschiedene Bindungsstellen, wo sie ebenfalls die Bildung des R-Zustands begünstigen und damit das Enzym aktivieren (heterotroper Effekt; ADP, ein Produkt der PFK-Reaktion, bindet auch am aktiven Zentrum des Enzyms). In ähnlicher Weise binden Inhibitoren wie PEP an allosterische Stellen (die im Fall von PFK die aktivierende allosterische Stelle überlappen), wo sie die Bildung des T-Zustands fördern und dadurch das Enzym hemmen.
Zwei der aktiven Zentren des Enzyms befinden sich an der Grenzfläche von mit den Grenzflächen des aktiven Zentrums in Magenta mit den Substraten in Cyan. Zwei weitere aktive Stellen befinden sich an der Grenzfläche der Untereinheiten B (grün) und C (rosa). Eine Nahaufnahme der Untereinheit D (Gelb) zeigt, dass Aminosäuren aus beiden Untereinheiten A (hellblau) und D (Gelb) zur Bindung von F6P beitragen. Zwei der allosterischen Stellen befinden sich an der Grenzfläche von und zwei an der Grenzfläche der Untereinheiten C und D. Auch hier sind die Grenzflächen magenta mit dem allosterischen Liganden in Cyan. Eine Nahaufnahme der Untereinheit A zeigt Beiträge beider Untereinheiten zur Bindung von ADP. Die Konformationsänderungen im Gehen zwischen den R- und T-Zuständen von PFK sind unten dargestellt.
Die Atomkoordinaten für den R-Zustand PFK wurden von 4pfk erhalten; Die für den T-Zustand PFK wurden von Philip Evans, MRC Laboratory of Molecular Biology, Cambridge, UK, erhalten, sind aber jetzt als 6pfk verfügbar.
Rolle bei der Glykolyse
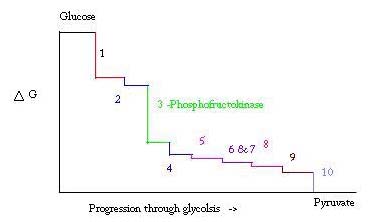
Die Glykolyse ist das Verfahren zur Herstellung und zum Abbau von Glucose zu Brenztraubensäure, die bei der anaeroben Atmung oder als einer der Ausgangsreaktanten im Zitronensäurezyklus verwendet wird. Drei Punkte im Prozess der Glykolyse treten mit einer großen negativen freien Energie auf und sind daher irreversibel. Diese drei Punkte sind Hexokinase, Phosphofructokinase und Pyruvatkinase; Von diesen drei PFK gilt als der wichtigste regulatorische Punkt für die Glykolyse im Muskel mit einem ΔG = -25,9 kJ / mol.
Mechanismus und Regulation der Phosphofructokinase
Phosphofructokinase bindet sowohl Mg2+ -ATP als auch Fructose-6-phosphat (F6P), um Fructose-1,6-Bisphosphat und Mg2+ -ADP herzustellen. Obwohl das Bild mit diesen beiden Produkten nicht bestimmt wurde, ist es an das Enzym gebunden worden. Es gibt drei Ligandenbindungsstellen pro Untereinheit. Zwei bilden die aktive Stelle, die F6P und ATP bindet, während die dritte eine allosterische Bindungsstelle ist. Einige vorgeschlagene Rückstände an der aktiven Stelle beteiligt sind . PFK existieren in zwei Konformationszuständen, die beide im Gleichgewicht sind. ATP bindet sowohl aktive als auch allosterische Stellen in beiden Konformationen. Während ATP das aktive Zentrum gleich gut bindet, bindet es bevorzugt die allosterische Stelle des T-Zustands Diese bevorzugte Bindung bewirkt eine Verschiebung vom Gleichgewicht der beiden Zustände zu einer größeren Menge des T-Zustands , wodurch die Affinität zu F6P verringert wird. bindet auch an die allosterische Stelle, um das Verhältnis der Phosphofructokinase des R-Zustands zu erhöhen. Zusammen mit ADP, AMP und F2 hemmt 6P die regulatorische Rolle von ATP. Die PFK Km für ATP ist .020mM und .032mM.
Regulation
Glykolyse ist ein essentieller Stoffwechselprozess für das Überleben. Daher muss es in seiner Aktivierung und Unterdrückung stark reguliert werden. Drei Punkte im Prozess der Glykolyse treten mit einer großen negativen freien Energie auf und sind daher irreversibel. Diese drei Punkte sind Hexokinase, Phosphofructokinase und Pyruvatkinase. Diese drei Reaktionen sind aufgrund ihrer hohen negativen freien Energien Kandidaten für die Hauptregulationspunkte. Von den Dreien wird PFK als Hauptregulationspunkt für die Glykolyse (# 3 im Bild unten) im Muskel mit einem ΔG = -25,9 kJ / mol angesehen, da es sich um einen sekundären Schritt handelt. Sobald PFK F6P in F1,6P umwandelt, wird die Reaktion aufgrund der hohen Energiemenge, die überwunden werden muss, um rückwärts zu gehen, nicht leicht rückgängig gemacht. . Diese Energiebarriere ist sinnvoll, da Pyruvatkinase die Endreaktion katalysiert (# 10) und Hexokinase (# 1) überhaupt nicht an der Glykolyse beteiligt ist, wenn der Prozess aus Glykogen begonnen wird.
PFK wird durch ATP, AMP und ADP reguliert. Während ATP am aktiven Standort in R- und T-Zuständen gleichmäßig gut bindet, bindet es bevorzugt die allosterische Stelle des T-Zustandes Diese bevorzugte Schwergängigkeit verursacht eine Verschiebung vom Gleichgewicht der zwei Zustände, zu einer größeren Menge T-Zustand, der die Affinität für F6P verringert. Allosterischer Aktivator ADP bindet auch an den allosterischen Standort, um das Verhältnis von R-Zustandphosphofructokinase zu erhöhen. Wie aus der folgenden Grafik hervorgeht, sind die Diagramme für die Aktivität von PFK sigmoid. Dies zeigt weiter die kooperative Natur des Enzyms. Die anfängliche Bindung des Substrats an das Enzym ist schwierig, aber sobald es gebunden ist und die Zustandsänderung von T -> R erzwingt, binden die anderen Substrate viel leichter. Die Grafik zeigt auch, dass das Hinzufügen von ATP das Diagramm nach rechts verschiebt (dh die Affinität zu F6P verringert), während das Hinzufügen von AMP es nach links verschiebt.
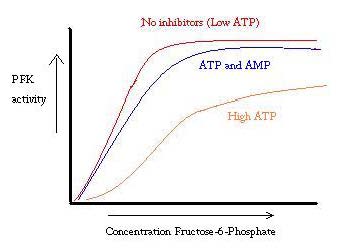
Das Regulierungssystem passt gut zur Funktion von PFK. Wenn PFK aktiv ist, wird ATP stromabwärts daraus produziert, da weitere Produkte vollständiger abgebaut werden. Wenn also die ATP-Spiegel niedrig sind und mehr hergestellt werden muss, wird die Aktivität von PFK erhöht, da ADP in hoher Konzentration vorliegt. Das Gegenteil gilt auch, weil eine hohe ATP-Konzentration die Proteinaktivität hemmt. Und doch kann diese Erklärung die Regulation von PFK nicht vollständig erklären, da die ATP-Spiegel zwischen aktiven und ruhenden Muskeln nicht stark genug variieren. Ein anderes Mittel der allosterischen Regulation muss gefunden werden.
PFKS Km für ATP ist .020mM und .032mM.
Diese Kinemage-Übung besteht aus zwei Kinemage-Szenen, die einige der allosterisch induzierten Konformationsänderungen veranschaulichen, die bei PFK von Bacillus stearothermophilus auftreten.
Konformationsänderungen in einer dimeren Einheit von PFK
Dieses Kinemagramm zeigt die beiden Untereinheiten des Tetramers, dessen Grenzfläche zwei aktive Stellen enthält. (KineMage wird derzeit nicht unterstützt) Die erste Ansicht, 1: PFK-Dimer, zeigt die beiden Untereinheiten in ihrer R-Zustandskonformation, dargestellt durch ihre Ca-Backbones mit Untereinheit 1 in rosa Tönung und Untereinheit 2 in Rosa. In jeder Untereinheit sind zwei Seitenketten gezeigt, die von Glu 161 (rot) und Arg 162 (Cyan), die Teil der F6P-Bindungsstelle in den Zuständen T und R sind (siehe unten). In der aktiven Stelle jeder Untereinheit sind ein F6P (hotpink) und ein ADP (grün; „ADP-aktiv“) gebunden. Ein zusätzliches ADP (gelb; „ADP-allo“) ist in einer separaten sogenannten allosterischen Stelle jeder Untereinheit gebunden. Den ADPs ist jeweils ein Mg2+ zugeordnet, das hier durch eine Kugel dargestellt wird, die dieselbe Farbe hat wie das ADP, an das sie bindet.
Klicken Sie auf die Schaltfläche „ANIMIEREN“, um das Dimer zwischen den Zuständen R und T umzuschalten. In seinem T-Zustand ist Untereinheit 1 bluetint und Untereinheit 2 skyblue. Die Seitenketten von Glu 161 und Arg 162 in beiden Untereinheiten sind nach wie vor rot und cyan (nur die Ca- und Cb-Atome der Arg 162-Seitenkette in der Untereinheit 1 werden in der Röntgenstruktur des T-Zustands beobachtet; diejenigen der Untereinheit 2 werden alle beobachtet). Das T-Enzym bindet den Inhibitor 2-Phosphoglycolat (Gold; „PGC“), ein nichtphysiologisches Analogon des glykolytischen Intermediats Phosphoenolpyruvat (PEP). Beachten Sie, dass die Bindungsstelle von PGC im T-Zustand die allosterische Bindungsstelle von ADP im R-Zustand („ADP-allo“) überlappt und sich daher ihre Bindung gegenseitig ausschließt. Die aktiven Stellen im T-Zustand, die kein F6P enthalten, sind durch „Geister“ -F6Ps (grau; „F6P-Stelle“) gekennzeichnet, die die gleichen Positionen haben wie die F6Ps im Enzym im R-Zustand.
Die zweite Ansicht, 2: Allo/Act Sites, ist eine Nahaufnahme des oberen Teils der ersten Ansicht, die sowohl die aktive Stelle als auch die allosterische Stelle in dieser Region zeigt. Beachten Sie, dass sich die aktive Stelle an der Grenzfläche zwischen zwei Untereinheiten befindet und dass die allosterische Stelle direkt mit der aktiven Stelle an der benachbarten Untereinheit interagiert. Vergleichen Sie die R-Status- und T-Status-Konformationen, indem Sie beide gleichzeitig anzeigen oder auf „ANIMIEREN“ klicken. Können Sie das Mg2 + -Ion identifizieren, das mit jedem der ADPs assoziiert ist, die im R-Zustand an das Enzym gebunden sind? Welche ADP-Atome koordinieren diese Mg2+-Ionen?
Die Phosphatgruppe von PGC bindet an die allosterische Stelle im T-Zustand in fast derselben Position wie die Beta-Phosphatgruppe von „ADP-allo“ an die allosterische Stelle im R-Zustand; beide Phosphatgruppen binden an die Seitenketten der gleichen drei Reste (2 arg und 1 Lys; nicht gezeigt).
Im hochaktiven R-Zustand bildet die positiv geladene Seitenkette von Arg 162 eine wasserstoffgebundene Salzbrücke mit der negativ geladenen 6-Phosphatgruppe von F6P (weiße gestrichelte Linien), eine Wechselwirkung, die vermutlich den R-Zustand relativ zum T-Zustand stabilisiert und daher teilweise für den homotropen Effekt von F6P verantwortlich ist.
Die wichtigsten Konformationsänderungen in einer Untereinheit von PFK.
Dieses KINEMAGRAMM zeigt die Segmente in der Nähe der allosterischen Stelle (die Reste 53-60 sind hier nicht dargestellt). Wie in KINEMAGE 1 wird das Polypeptid durch seine Ca-Kette mit den R-Zustandsuntereinheiten 1 und 2 in Rot und Rosa und den T-Zustandsuntereinheiten 1 und 2 in Blau und Himmelblau dargestellt. (KineMage derzeit nicht unterstützt) KINEMAGE 2 erscheint in Ansicht 1: Die allosterische Stelle im R-Zustand, die die Phosphatgruppe von F6P (Hotpink) zeigt, die im aktiven Zentrum des Enzyms in einer wasserstoffgebundenen Salzbrücke (gestrichelte weiße Linien) mit der Seitenkette von Arg 162 (Cyan) gebunden ist. Ein ADP (gelb; „ADP-allo“) besetzt die angrenzende allosterische Stelle. Klicken Sie einmal auf „ANIMIEREN“, um in den T-Zustand zu wechseln. Dies ersetzt das ADP in der allosterischen Stelle des R-Zustands durch den Inhibitor und das PEP-Analogon PGC (Gold). F6P nimmt nicht mehr die aktive Site ein, aber seine Position im R-Zustand wird durch den „Geist“ F6P angezeigt (grau; angezeigt durch Klicken auf „F6P site“).
Was passiert mit dem zentralen Polypeptid-Helikalsegment (Reste 149-164) im R-zu-T-Übergang? Was macht dies mit den relativen Positionen des negativ geladenen Glu 161 und des positiv geladenen Arg 162? Klicken Sie auf „F6P site“. Welchen Einfluss hätte das Fehlen der positiven Ladung von Arg 162 auf die Bindung von F6P? Erklärt dies zumindest teilweise, warum T-PFK eine geringe Affinität zu F6P hat? Gehen Sie zu Ansicht 2: Nahaufnahme, für eine Nahaufnahme der F6P-Sidechain-Interaktionen. Zentrieren Sie die Moleküle, indem Sie „pickcenter“ aus dem Menü „Extras“ auswählen und auf das Atom klicken, das Sie in der Mitte haben möchten. Schieben Sie den Schieberegler „Zoom“, um die Ansicht zu vergrößern.
Ortsgerichtete Mutagenese
Zu einer Zeit wurde angenommen, dass die negative Ladung von Glu 161 einen negativen Effekt auf die F6P-Bindung im T-Zustand hat. Diese Idee wurde nicht durch ortsgerichtete Mutagenese-Experimente unterstützt. Es wurden mehrere mutierte PFKs hergestellt, darunter R162A, E161A und R162A / E161A. Die R162A-Mutation verursachte eine 30-fache Abnahme der F6P-Bindung. Die E161A-Mutation hatte jedoch wenig Einfluss auf die Fähigkeit von PEP, die F6P-Bindung zu hemmen.
Krankheit
Erblicher Erythrozyten-PFK-Mangel ist mit Myopathie und Hämolyse (Tarui-Krankheit) verbunden.
3D-Strukturen von PFK
Phosphofructokinase 3D-Strukturen
Leave a Reply