Virale Latenz: Runter, aber nicht raus
Wenn Sie sich Viren vorstellen, die sich vor Ihrem Immunsystem verstecken, denken Sie vielleicht an das Herpes-simplex-Virus, das für Fieberbläschen und Herpes genitalis verantwortlich ist, oder an das Varicella-Zoster-Virus, das Gürtelrose verursacht. Diese Viren können jahrzehntelang in einem Winterschlaf-ähnlichen Zustand, der als Latenz bekannt ist, bestehen bleiben und die Erkennung durch unser Immunsystem vermeiden (Kennedy et al., 2015). Latente Viren können manchmal aufwachen und sich erneut replizieren, Symptome verursachen und Infektionen verbreiten (Lieberman, 2016).
Das humane Immundefizienzvirus (HIV) ist ebenfalls ein meisterhafter Fluchtkünstler. Es bildet früh in der Infektion ein latentes Reservoir, das es dem Virus ermöglicht, dem Immunsystem auszuweichen und langfristig zu überleben. Menschen, die mit HIV leben, nehmen täglich Medikamente ein, die als antiretrovirale Kombinationstherapie (ART) bekannt sind, um die Replikation des Virus zu verhindern. ART ist jedoch kein Heilmittel, da es nicht auf bereits latente Viren abzielt. Diese Medikamente werden daher für das Leben eines Individuums gegeben: Wenn Sie die Behandlung auch nur für einige Wochen abbrechen, können die latenten Viren die aktive Infektion reaktivieren und neu entfachen. Menschen mit HIV können aufgrund von ART ein langes, gesundes Leben erwarten, aber latente Viren sind immer in ihrem Körper vorhanden.
Um eine Heilung für HIV zu finden, muss das latente Virusreservoir eliminiert oder kontrolliert werden können. Um dieses Ziel zu erreichen, müssen jedoch noch einige Schlüsselfragen angegangen werden. Wie, wann und wo etabliert HIV Latenz? Wie groß ist das latente Reservoir und wie kann es am besten gemessen werden? Was bewirkt, dass latente Viren reaktiviert werden? In eLife berichten Miles Davenport, Brandon Keele und Kollegen von der University of New South Wales und dem Frederick National Laboratory for Cancer Research – darunter Mykola Pinkevych als Erstautorin –, wann das latente Reservoir in einem nicht-menschlichen Primatenmodell von HIV etabliert ist und wie viel des Reservoirs reaktiviert werden kann (Pinkevych et al., 2019).In dieser Studie infizierte das Team Rhesusaffen mit dem Simian Immunodeficiency Virus (SIV), einem Vorläufervirus, das bei afrikanischen Affen endemisch ist und HIV genetisch ähnlich ist (Williams und Burdo, 2009). Irgendwann im 20.Jahrhundert sprang SIV von nichtmenschlichen Primaten auf den Menschen über; Dieses artübergreifende Übertragungsereignis, gepaart mit einer schnellen Evolution, ermöglichte es dem Virus, sich effizient bei Menschen auszubreiten und die anhaltende HIV-Pandemie auszulösen (Keele et al., 2006).
Pinkevych et al. begann mit der Infektion von Rhesusaffen mit einem gentechnisch veränderten SIV, das über 10.000 einzigartige randomisierte DNA-Sequenzen enthält; Nach der Sequenzierung ermöglichen diese ‚Barcodes‘ die Identifizierung einzelner Viren (Fennessey et al., 2017). Die Affen wurden dann 4, 10 oder 27 Tage nach der Infektion mit einer antiretroviralen Therapie behandelt. Diese Intervalle simulieren akute (4 Tage), frühe (10 Tage) oder späte Intervention (27 Tage) mit ART beim Menschen. Die Medikamente wurden ungefähr ein Jahr lang verabreicht, und das Virus wurde bei allen Tieren vollständig unterdrückt. Anschließend wurde die Behandlung abgebrochen und das latente Virus reaktiviert. Mithilfe genetischer Sequenzierung und mathematischer Modellierung bestimmte das Team die Größe des latenten Reservoirs von SIV und wie es reaktiviert würde.
Bei den Affen blockierte der Beginn der Behandlung vier Tage nach der Infektion nicht die Bildung des latenten Reservoirs, sondern reduzierte seine Größe im Vergleich zu einer späteren ART-Initiierung um etwa das 100-fache. In ähnlicher Weise haben Menschen, die ART innerhalb von Tagen nach dem Erwerb von HIV beginnen, ein extrem kleines Reservoir im Vergleich zu denen, die später mit der Behandlung beginnen (Luzuriaga et al., 2015; Henrich et al., 2017). Trotz dieser großen Unterschiede in der Gesamtreservoirgröße reaktivierten sich die latenten Viren nach Beendigung der ART bei akuten, frühen und spät behandelten Tieren mit ähnlichen Raten (Abbildung 1). Pinkevych et al. schließen Sie daher, dass die Mehrheit der Viren, die das Potenzial zur Reaktivierung haben, früh nach der Infektion eine Latenzzeit aufbauen.
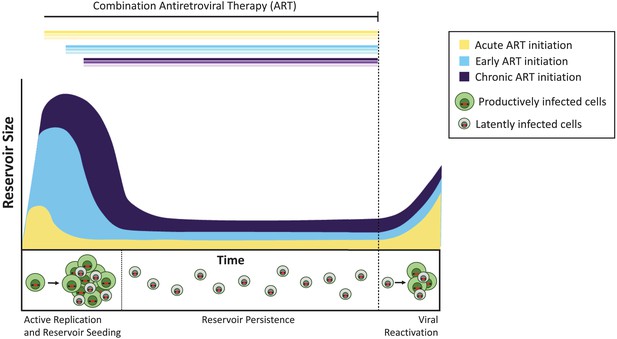
Der Zeitpunkt der antiretroviralen Therapie beeinflusst die Größe des latenten Reservoirs.
Ohne Behandlung erzeugen Zellen, die mit aktiv replizierendem Virus infiziert sind (produktiv infizierte Zellen; grün dargestellt), infektiöse Viren. Eine Minderheit infizierter Zellen enthält Viren, die auf unbestimmte Zeit als latentes Reservoir persistieren können (latent infizierte Zellen; grau dargestellt), und diese Viren können möglicherweise zu einem späteren Zeitpunkt reaktiviert werden. Die Behandlung während der akuten Infektionsphase (d. H. Innerhalb von Tagen oder Wochen nach der Primärinfektion; gelbe Kurve) führt zu einem kleineren latenten Reservoir als bei frühzeitigem Behandlungsbeginn (innerhalb von sechs Monaten nach der Infektion, hellblau) oder bei chronischer Infektion (mehr als 6 Monate seit der Infektion, violett). Wenn die Behandlung abgebrochen wird (gestrichelte Linie), reaktiviert sich das Virus aus diesen Reservoirs in ähnlichen Konzentrationen, um die aktive Infektion wieder zu entfachen und das latente Reservoir neu zu säen.
Um herauszufinden, warum der Zeitpunkt der Behandlung die Reaktivierungsrate nicht zu beeinflussen schien, maß das Team den Grad der genetischen Mutationen in den latenten Viren. Wenn Viren mehr schädliche Mutationen akkumulieren, je länger sie sich aktiv im Körper replizieren, würde dies darauf hindeuten, dass Tiere, die verzögerte ART erhalten, einen größeren Anteil latenter Viren tragen könnten, die defekt sind und nicht wiedererwachen können. Das Team stellte jedoch fest, dass die Mehrheit der Viren (mehr als 80%) bei allen Tieren genetisch intakt war, unabhängig davon, wann die Behandlung begann. Dies ist ganz anders als bei der HIV-Infektion beim Menschen, wo die meisten latenten Viren große genetische Mutationen und Deletionen enthalten, so dass nur ein kleiner Bruchteil (zwischen 2% und 11%) reaktiviert werden kann (Ho et al., 2013; Bruner et al., 2019).Eine kürzlich durchgeführte Studie, die die Dynamik des HIV-Reservoirs bei Menschen mit stabiler ART untersuchte, identifizierte eine weitere Diskrepanz zwischen diesem SIV-Modell und der HIV-Latenz beim Menschen. Trotz laufender ART kann sich latentes HIV manchmal spontan reaktivieren und die Viren werden für kurze Zeit im Blut nachweisbar. Beim Menschen sind diese viralen ‚Blips‘ phylogenetisch mit einem viralen Reservoir verbunden, das nicht nur bei der Erstinfektion, sondern über Jahre unbehandelter Infektion aufgebaut wurde (Jones et al., 2018). Die Gründe für diese Unterschiede sind nicht gut verstanden und stellen wichtige Bereiche für die laufende Forschung dar.
Trotz der Unterschiede zwischen nicht-menschlichen Primatenmodellen und menschlichen HIV-Infektionen ist die Arbeit von Pinkevych et al. bestätigt, dass die virale Latenz extrem früh nach der Infektion festgestellt wird. Diese Ergebnisse deuten darauf hin, dass die antiretrovirale Therapie so bald wie möglich begonnen werden sollte, um die HIV-Infektion zu kontrollieren und die Größe des latenten Reservoirs zu verringern. Es ist noch viel darüber unbekannt, wie die HIV-Latenz hergestellt und aufrechterhalten wird, insbesondere unter Behandlung; SIV-Modelle werden jedoch ein wichtiges Instrument bleiben, um zu verstehen, wie das latente Reservoir ausgerottet werden kann.
Leave a Reply