Was beeinflusst die Größe der Gruppen, in denen Primaten leben?

Einer der wichtigsten theoretischen Beiträge zur Untersuchung von Primaten ist das Verständnis dessen, was die Natur komplexer Variationen in sozialen Strukturen und Organisationen beeinflusst. Dem liegt eine Reihe theoretischer Entwicklungen zugrunde, die untersuchen, warum Tiere überhaupt in Gruppen leben und warum Gruppen eine bestimmte Größe haben. Hier konzentrieren wir uns auf die Frage „Was beeinflusst die Größe der Gruppen, in denen Primaten leben?“Primaten sind besonders nützliche Taxa, um diese Frage zu beantworten, da ihre Gruppengrößen nicht nur innerhalb, sondern auch zwischen Arten sehr unterschiedlich sind. Die intraspezifische Gruppengröße für roten Colobus (Procolobus rufomitratus) variiert beispielsweise zwischen 12 und 150 Mitgliedern (Chapman & Chapman 2000a). Die interspezifische Variation reicht von einem einzelnen Individuum aus, wie bei Orang-Utans (Pongo sp.) (van Schaik 1999), an über 800 Mitglieder in Mandrills (Mandrillus sphinx) (Abernethy et al. 2002). Darüber hinaus teilen sich soziale Gruppen innerhalb einiger Arten im Laufe der Zeit wiederholt auf und vereinigen sich wieder zu Untergruppen unterschiedlicher Größe und Kombination (z. B. soziale Organisation der Spaltfusion von Klammeraffen (Ateles sp.) und Schimpansen (Pan troglodytes) oder die mehrstufige Organisation von Gelada (Theropithecus gelada) und Hamadryas-Pavianen (Papio hamadryas, Aureli et al. 2008). Diese Variation bildet die Grundlage für die Entwicklung von Modellen, um sowohl die ökologischen als auch die sozialen Treiber der Gruppengröße zu untersuchen.
Gruppierung ist in mehrfacher Hinsicht vorteilhaft. Es wird angenommen, dass Individuen in größeren Gruppen ein geringeres Risiko für Raubtiere haben (Hamilton 1971), möglicherweise besser in der Lage sind, Nahrungsressourcen zu finden und zu verteidigen (Cody 1971, Wrangham 1980) und möglicherweise vor Artgenossen geschützt sind Bedrohung, wie Kindestötung durch Männer außerhalb der Gruppe (Wrangham 1979). Verschiedene Forscher haben vorgeschlagen, dass die Gruppierung so vorhersehbare Vorteile bringt (Alexander 1974, van Schaik 1983), dass Unterschiede in der Gruppengröße durch die Nachteile erklärt werden können (Wrangham et al. 1993). Es wird angenommen, dass die am weitesten akzeptierten potenziellen Kosten der Gruppierung eine Verringerung der Futtereffizienz sind. Mit anderen Individuen mit den gleichen Ernährungsbedürfnissen zusammen zu sein bedeutet, dass Tiere entweder um Nahrung kämpfen (Wettbewerbswettbewerb), oder ein Tier in einer Gruppe schlägt ein anderes zum Essen, so dass, wenn das zweite Tier in ein Gebiet kommt, einfach kein Essen mehr übrig ist (Scramble competition, Janson & van Schaik 1988). In beiden Situationen wird angenommen, dass der Wettbewerb um Nahrung dazu führt, dass Tiere weiter reisen müssen. Die Logik hinter diesem Argument ist relativ einfach. Die Tiere müssen auf einer Fläche nach Futter suchen, die ihren energetischen und ernährungsphysiologischen Anforderungen entspricht. Daraus folgt, dass eine Zunahme der Gruppengröße die Fläche vergrößern wird, die abgedeckt werden muss, um ausreichende Lebensmittelvorräte zu finden. Daher müssen Individuen weiter reisen und mehr Energie aufwenden, wenn sie in einer großen Gruppe sind, als wenn sie in einer kleineren Gruppe Futter suchen. Mit zunehmender Reisezeit wird ein Punkt erreicht, an dem die für das Reisen aufgewendete Energie zu kostspielig ist und kleinere Gruppen vorteilhaft werden. Auf diese Weise können ökologische Faktoren die Bewegungsmuster und die Effizienz der Nahrungssuche beeinflussen, wodurch die Größe der Gruppen eingeschränkt wird, die die verfügbaren Nahrungsressourcen effizient nutzen können. Diese Ideen wurden in dem sogenannten Ecological Constraints Model formalisiert (Chapman & Chapman 2000b, Ganas & Robbins 2005, Snaith & Chapman 2007, Teichroeb & Sicotte 2009).
Die wesentliche Komponente des Modells der ökologischen Einschränkungen ist, dass eine Zunahme der Gruppengröße zu einer Zunahme des Fütterungswettbewerbs innerhalb der Gruppe führen muss. Es ist denkbar, dass dies je nach Art der von bestimmten Arten genutzten Ressourcen etwas anders funktioniert. Bei frugivoren und möglicherweise vielen folivoren Primaten, die sich in diskreten Bereichen ernähren – typischerweise Bäume mit Nahrungsmitteln oder Baumklumpen – können zusätzliche Gruppenmitglieder die Bereiche schneller erschöpfen und zu erhöhten Tagesbereichen führen (Chapman 1988, Snaith & Chapman 2005). Für mehr insektenfressende Arten, deren Ressourcen möglicherweise nicht in so diskreten Gebieten vorkommen, kann eine kontinuierliche Reise durch das Blätterdach auf der Suche nach Insekten mit zusätzlichen Gruppenmitgliedern zu einer Zunahme der Überlappung einzelner Suchfelder führen, was die Pro-Kopf-Begegnungsrate mit Nahrung verringert und somit die Fläche vergrößert, die durchsucht werden muss (van Schaik et al. 1983).
Das ecological constraints Model legt also nahe, dass die Faktoren, die die Entfernung beeinflussen, die Tiere zurücklegen, auch die Gruppengröße beeinflussen sollten. Bei Tieren, die sich typischerweise von Früchten oder Blättern ernähren, die erschöpft sein können, würde die Größe des Flecks bestimmen, wie lange eine Gruppe einer bestimmten Größe bleiben und sich ernähren könnte. Eine große Gruppe würde weniger Zeit in einem Patch einer bestimmten Größe verbringen als eine kleinere Gruppe, weil es den Patch schneller erschöpft — eine große Gruppe hat einfach mehr Münder zu füttern. Wenn Tiere zwischen Patches reisen, sobald sie sie erschöpft haben, bestimmen die Dichte und Verteilung der Patches die anfallenden Reisekosten. Wenn Ressourcenflecken eine hohe Dichte aufweisen oder sich in einer verklumpten Verteilung befinden, ist die Entfernung zum nächsten Patch gering, die Reisekosten sind gering und Tiere können daher große Gruppen bilden. Zu solchen Zeiten können alle zusätzlichen Kosten, die mit der Mitgliedschaft in einer großen Gruppe verbunden sind, wie z. B. die Notwendigkeit, viele Orte zu besuchen, leicht wiederhergestellt werden. Im Gegensatz dazu, wenn Ressourcen-Patches bei niedrigen Dichten auftreten, ist die Entfernung zum nächsten Patch typischerweise groß, die Reisekosten sind hoch und Tiere können es sich nicht leisten, Patches schnell zu erschöpfen, und daher bilden Tiere kleine Gruppen.
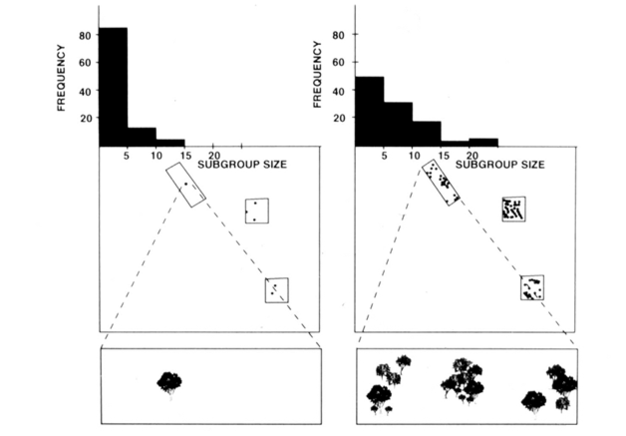
Die soziale Spaltungs-Fusions-Organisation von Klammeraffen, Schimpansen und einigen anderen Primaten (Abbildung 1) bietet nützliche Tests des Modells der ökologischen Einschränkungen, da versucht werden kann, zeitliche Änderungen der Untergruppengröße anhand direkter Messungen der Größe, Dichte und Verteilung der Nahrungsressourcen vorherzusagen (Chapman 1990, Chapman et al. 1995). Für Klammeraffen und Schimpansen wurde ein multiples Regressionsmodell entwickelt, um zu zeigen, dass die Größe, Dichte und Verteilung der jeden Monat gemessenen Nahrungsflächen ein guter Prädiktor für die Untergruppengröße waren. Es ist schwierig, eine multiple Regression visuell darzustellen, aber die Methoden, die für Klammeraffen verwendet wurden, sind in Abbildung 2 dargestellt. Klammeraffen haben eine sehr flexible Spaltung-Fusion-Art der sozialen Organisation, und im Santa Rosa Nationalpark, Costa Rica, kann die Untergruppengröße von 1 bis 35 Individuen reichen, aber im Durchschnitt werden etwa 5 Individuen gefunden, die zusammen reisen. Für diese Population können 50% der Varianz der mittleren monatlichen Untergruppengröße aus relativ groben Messungen der Größe, Dichte und Verteilung von Nahrungsflächen vorhergesagt werden (Chapman 1990).

Zusätzlich zu den oben genannten Arten wurde die Anwendbarkeit des ecological Constraints-Modells im Allgemeinen durch Forschung aus einer Vielzahl von Arten (Snaith & Chapman 2005) und Situationen (z. B. allgemeine Modelle, Wrangham et al. 1993 und gemischte Artenverbände, Chapman & Chapman 2000c). Wir sind der Ansicht, dass es angesichts der breiten Unterstützung, die dieses Modell erhalten hat, an der Zeit ist, vorzuschlagen, dass Arten typischerweise den Erwartungen des Modells für ökologische Einschränkungen entsprechen sollten. Dies bedeutet nicht, dass sich alle Arten anpassen werden, und daher wird es eine aufregende Zeit für die Forschung auf diesem Gebiet, da die Forscher nach Ausnahmen vom Modell suchen können. Wir vermuten, dass Arten, die sich nicht anpassen, dies tun werden, weil sie soziale Strategien angenommen haben, die den ökologischen Erwartungen zuwiderlaufen. Dies liefert einen „Maßstab“, um die potenzielle Bedeutung verschiedener sozialer Strategien zu bewerten (d. H. Je weiter man von den Erwartungen des ökologischen Modells abweicht, desto wichtiger ist der soziale Selektivdruck).
Lassen Sie uns kurz zwei Beispiele aus unserer bisherigen Forschung nennen. Weibliche Schimpansen waren einsamer als weibliche Klammeraffen, dennoch haben beide ähnliche soziale Organisationen mit Spaltfusion. Während wir die Anzahl der männlichen und subadulten Schimpansen in einer Untergruppe basierend auf den ökologischen Bedingungen genau vorhersagen konnten, konnten wir die Anzahl der weiblichen Schimpansen in diesen Untergruppen nicht vorhersagen (Chapman et al. 1995). Selbst wenn die Ressourcen extrem reichlich vorhanden waren und sich fast alle Männer in einer großen Untergruppe befanden, traten Frauen selten in Gruppen ein, was darauf hindeutet, dass die Kosten für eine größere Untergruppe alle Vorteile wie die Vermeidung von Raubtieren überwogen. Dies ist unerwartet aus der Perspektive, dass die Säuglinge dieser Frauen die Alters- / Geschlechtsklasse wären, die am stärksten von Raubtieren bedroht ist. Eine überprüfbare Hypothese, um diese Beobachtungen zu erklären, ist, dass die Art der Koalitionen in diesen beiden Arten die Vorteile der Gruppenmitgliedschaft beeinflussen kann. Es gibt Hinweise darauf, dass im Gegensatz zu Schimpansen, Klammeraffen Weibchen Koalitionen bilden, die oft arbeiten, um den Mitgliedern der Koalition exklusiven Zugang zu Nahrung zu ermöglichen. So können Klammeraffen, wenn sie sich bestimmten Individuen anschließen, ihren Zugang zu Nahrung erhöhen, indem sie andere ausschließen, aber für Schimpansenweibchen ist dies nicht der Fall (Chapman et al. 1995).
Wir haben eine weitere interessante Abweichung identifiziert, die möglicherweise durch soziale Faktoren verursacht wird, die die Kosten und den Nutzen einer Gruppe beeinflussen, und dies betrifft rote Colobus- und schwarz-weiße Colobus-Affen (aka. guerezas, Colobus guereza) im Kibale-Nationalpark, Uganda. Rote Colobus bilden große Gruppen mit durchschnittlich 65 Individuen (25-127 Individuen, Snaith et al. 2008), während Guerezas in kleinen Gruppen mit durchschnittlich 6,5 Individuen leben (4-11 Individuen, Harris & Chapman 2007). Trotz dieses Unterschieds gibt es eine große Ähnlichkeit in den Pflanzen, die von den beiden Arten gegessen werden. Wenn ökologische Bedingungen für den Unterschied in der Gruppengröße zwischen den beiden Colobin-Arten verantwortlich wären, würde man erwarten, dass sich ihre Ernährung unterscheiden würde und die Dichte der Nahrungsbäume in den Heimatgebieten der Guerezas niedriger wäre, da sie die kleinere Gruppengröße haben. Allerdings sind ihre Diäten sehr ähnlich; Die diätetische Überschneidung zwischen einem roten Colobus und einer Guereza-Gruppe, die ihre Heimat vollständig innerhalb der Heimat der roten Colobus-Gruppe hatte, betrug 43.2%, während sich die Ernährung für die beiden benachbarten Gruppen des roten Colobus nur um 37, 3% überlappte (Chapman et al. 2002). Es scheint, dass der reproduktive Erfolg der weiblichen Guereza in kleinen und mittelgroßen Gruppen maximiert wird, entweder weil größere Gruppen höhere Raten von Übernahmen und Kindestötung oder mehr Fütterungskonkurrenz erfahren (siehe Beweise für Scramble-Konkurrenz in der folivorous Trachypithecus phayrei und Semnopithecus sp. , aber ein Mangel an Beweisen für Guerezas, die Nahrungsmittelflecken abbauen ). Wir haben eine Reihe von männlichen Übernahmen und Tötungen von Säuglingen in den Guerezas erlebt (Onderdonk 2000) — siehe Teichroeb & Sicotte (2008) für eine Bewertung der Theorie bezüglich Kindestötung bei Kolobinen. Was nicht klar ist, ist, wie das Risiko eines Kindsmords die Größe der Guereza-Gruppen begrenzen würde, wenn sie offensichtlich Zugang zu einer hohen Nahrungsdichte haben, die die Bildung von multi-männlichen Gruppen ermöglichen sollte. Bei mehreren Arten sind größere weibliche Gruppen eher ein Ziel für eingewanderte Männer, und diese Situation kann die Kindermordrate erhöhen – zum Beispiel Semnopithecus sp. (Borries 1997), Theropithecus gelada (Dunbar 1984), Alouatta seniculus (Crockett & Janson 2000), Presbytis thomasi (Steenbeek & van Schaik 2001). Es wird jedoch erwartet, dass Kindestöte seltener auftreten, wenn eine Gruppe mehrere reproduktiv aktive Männchen enthält, da männliche Einwanderung und anschließende gewaltsame Übernahme und Kindestöte weniger wahrscheinlich sind, wenn der Neuankömmling mit mehreren möglichen Vererbern zukünftiger Säuglinge konfrontiert ist (Janson & van Schaik 2000). Guerezas scheinen über ausreichende Nahrungsressourcen zu verfügen, um größere Gruppen zu bilden (Tombak et al. 2012), die das Risiko von Kindstötung verringern würde, aber sie bilden keine großen Gruppen. Es ist möglich, dass die Art der männlich-männlichen Interaktionen in Guerezas große Gruppen instabil macht. Dies scheint bei Ursine colobus (Colobus vellerosus) der Fall zu sein, wo multi-männliche Gruppen männliche Einwanderer anziehen und höhere Kindestötungsraten aufweisen als Gruppen mit einem starken erwachsenen Mann in seinen besten Jahren (Teichroeb, Wikberg, Badescu, & Sicotte, unveröffentlichte Daten; Abbildung 3). Thus, even when ecological conditions would permit large groups to form, social conditions preclude their formation (Chapman & Pavelka 2005).

Wenn das ecological constraints Model Belastungen beschreibt, die die Gruppengröße von Primaten im Allgemeinen beeinflussen, und wenn Abweichungen von dieser erwarteten Gruppengröße auf sozialen Druck zurückzuführen sind, wird es eine aufregende Zeit in diesem Forschungsbereich sein, da es eine Reihe interessanter Fragen aufwirft. Beispielsweise: Was ist der soziale Druck auf die Gruppengröße? Warum sind diese sozialen Zwänge bei diesen Arten vorhanden und nicht bei eng verwandten? Und was sind die evolutionären Kräfte, die für diesen sozialen Druck verantwortlich sind? Die Gruppengröße ist ein kritisches Element, das die Art der sozialen Organisation beeinflusst, die Arten annehmen, Daher wird die Untersuchung dieser Fragen zu aufregenden Verfeinerungen sozioökologischer Modelle führen.
Leave a Reply