7.2: Quimotripsina
Introducción
La quimotripsina es una de las enzimas más estudiadas debido a su cinética de dos fases: pre-estado estacionario y estado estacionario. El estudio de estos dos estados cinéticos da evidencia del mecanismo de «Ping-Pong», la formación de complejos covalentes que conducen a reacciones de hidrólisis covalente, y la velocidad de las reacciones catalizadas. La síntesis de quimotripsina ocurre principalmente en el páncreas. Sin embargo, en lugar de la forma activa, se produce como un zimógeno inactivo llamado quimotripsinógeno para evitar que su actividad proteasa digiera el páncreas. Tras la secreción en el lumen del intestino delgado, se convierte en su forma activa por otra enzima llamada tripsina. Esta dependencia de una enzima diferente para la activación de una proteasa es una forma común para que el cuerpo prevenga la digestión de órganos y otros efectos secundarios enzimáticos dañinos.
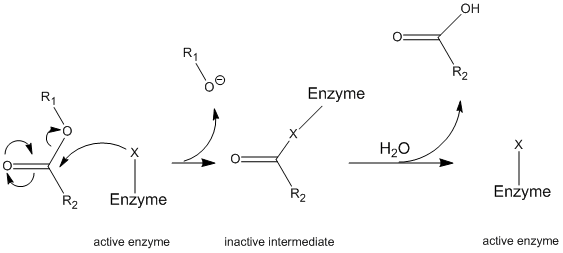
La quimotripsina opera a través de un mecanismo general conocido como mecanismo de ping-pong (Figura \(\pageIndex{1}\)) en el que la enzima reacciona con un sustrato para formar un intermediario enzimático. Este intermedio tiene propiedades diferentes a la enzima inicial, por lo que para regenerar la actividad enzimática inicial, debe reaccionar con un sustrato secundario. Este proceso se ilustra a continuación:

Más específicamente, la quimotripsina opera a través de un tipo particular de mecanismo de ping-pong llamado hidrólisis covalente. Esto significa que la enzima primero forma un enlace covalente con el sustrato objetivo, desplazando la fracción más estable en solución. Este complejo de sustrato enzimático se denomina intermedio enzimático. El intermedio reacciona con el agua, lo que desplaza la parte restante del sustrato inicial y reforma la enzima inicial.
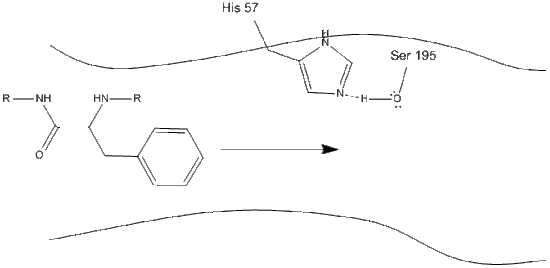
La quimotripsina, como la mayoría de las enzimas, es específica en los tipos de sustratos con los que reacciona. Como proteasa, escinde polipéptidos, y su especificidad inherente le permite actuar solo en el carboxi-terminal de los residuos aromáticos. Es un mecanismo algo complicado, y se explica mejor en una serie de pasos.
1. El objetivo entra en el sitio activo de quimotripsina, y se mantiene allí por interacciones hidrofóbicas entre grupos no polares expuestos de residuos enzimáticos y la cadena lateral aromática no polar del sustrato. Es importante tener en cuenta el enlace de hidrógeno entre el nitrógeno Schiff de la histidina-57 y la cadena lateral de oxígeno de la serina-195.
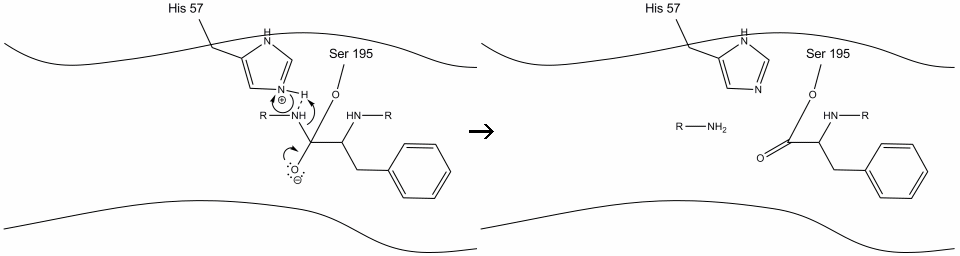
2. Ayudado por el enlace de hidrógeno histidina-serina, el grupo hidroxilo de la serina-195 realiza un ataque nucleofílico sobre el carbono carbonilo de un aminoácido aromático mientras transfiere simultáneamente el hidrógeno hidroxilo al nitrógeno histidina Schiff. Este ataque empuja los electrones del carbonilo pi al oxígeno del carbonilo, formando un intermediario de corta duración que consiste en un carbono c-terminal con cuatro enlaces simples: un anión de oxígeno, el beta-carbono del aminoácido aromático, el n-terminal del aminoácido subsiguiente de la proteína del sustrato y el oxígeno de la cadena lateral serina-195.
.gif?revision=1&size=bestfit&width=720&height=192)
3. Este intermedio es de corta duración, ya que los electrones oxianion reforman el enlace pi con el c-terminal del aminoácido aromático. El enlace entre el carboxi-terminal del aminoácido aromático y el n-terminal del residuo posterior se rompe, y sus electrones se utilizan para extraer el hidrógeno del nitrógeno Schiff protonado en la histidina-57. Los enlaces entre el carbono carbonilo y el oxígeno serina-195 permanecen en una configuración de éster. Esto se denomina intermedio de acil-enzima. El lado c-terminal del polipéptido ahora es libre de disociarse del sitio activo de la enzima.
4. Las moléculas de agua ahora pueden entrar y unirse al sitio activo a través de enlaces de hidrógeno entre los átomos de hidrógeno del agua y el nitrógeno histidina-57 Schiff.
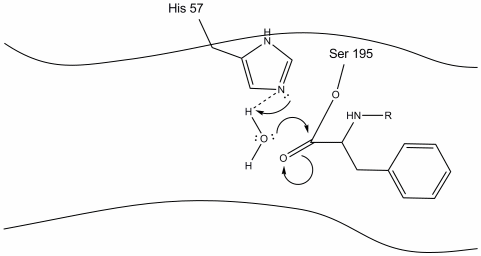
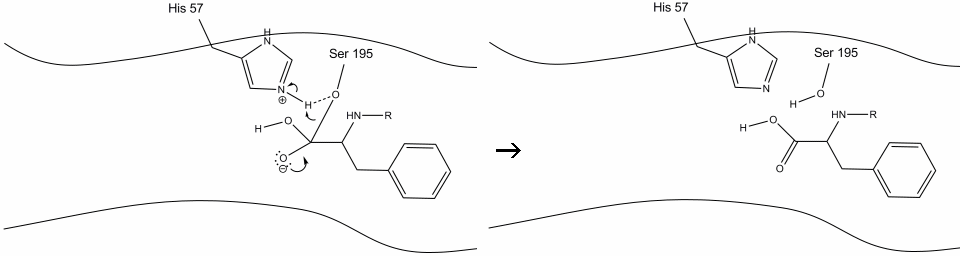
5. El oxígeno del agua ahora hace un ataque nucleofílico sobre el carbono carbonilo del intermedio de la enzima acilo, empujando los electrones pi del carbonilo sobre el carbono carbonilo a medida que la histidina-57 extrae un protón del agua. Esto forma otro carbono cuaternario unido covalentemente con serina, un hidroxilo, un oxianión y el aminoácido aromático. El protón de la histidina-57 recientemente protonada ahora es capaz de hacer un enlace de hidrógeno con el oxígeno de la serina.
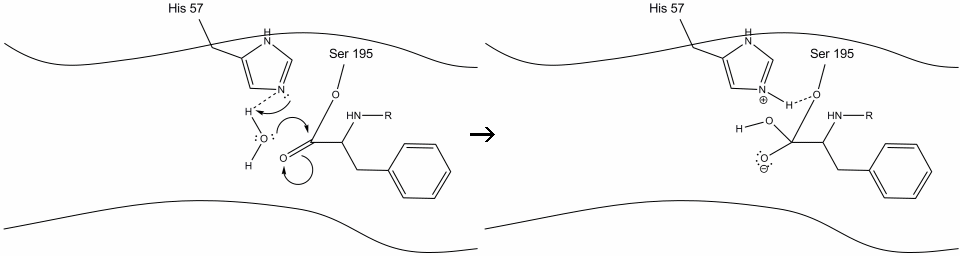
6. Los electrones oxianion reforman el enlace carbonilo pi, rompiendo el enlace entre el carbono carbonilo y el hidroxilo de serina. Los electrones en este enlace son utilizados por el oxígeno de la serina para desprotonar el nitrógeno de histidina Schiff y reformar la enzima original. El sustrato ya no tiene afinidad por el sitio activo, y pronto se disocia del complejo.
Leave a Reply