Fosfofructocinasa (PFK)
Contenido
- 1 Introducción
- 2 Papel en la Glucólisis
- 3 Mecanismo y Regulación de la Fosfofructocinasa
- 4 Regulación
- 5 Cambios Conformacionales en una Unidad Dimérica de PFK
- 6 Los Cambios Conformacionales Principales en una Subunidad de PFK.
- 7 Mutagénesis dirigida al sitio
- 8 Enfermedad
- 9 Estructuras 3D de PFK
Introducción
La fosfofructocinasa-1 (PFK-1) es una enzima glicolítica que cataliza la transferencia de un grupo fosforilo de a a rendimiento y . Ver Enzimas de Glucólisis. Mg2+ también es importante en esta reacción (). La fosfofructocinasa – 2 (PFK-2) actúa sobre los mismos sustratos para producir ADP y . . La reacción PFK es fuertemente exergónica (irreversible) en condiciones fisiológicas y, por lo tanto, es uno de los pasos determinantes de la velocidad de la vía glucolítica. En la mayoría de los organismos/tejidos, la PFK es la principal enzima reguladora de flujo de la vía glicolítica; su actividad está controlada por las concentraciones de un número inusualmente grande de metabolitos, incluidos ATP, ADP, AMP, PEP y fructosa-2,6-bisfosfato.
es un tetrámero de subunidades idénticas de 320 residuos. Es una enzima alostérica que se describe utilizando el modelo de simetría del alosterismo en el que hay una transición concertada de su estado R de alta actividad a su estado T de baja actividad. Se han notificado las estructuras de rayos X de los estados R y T de la enzima. La unión de una molécula de su sustrato F6P, que se une a la enzima de estado R con alta afinidad pero a la enzima de estado T con baja afinidad, hace que la PFK tome el estado R, lo que a su vez aumenta la afinidad de unión de la enzima para obtener F6P adicional (un efecto homotrópico). Los activadores, como ADP y AMP se unen a los llamados sitios alostéricos, sitios de unión distintos del sitio activo, donde también facilitan la formación del estado R y, por lo tanto, activan la enzima (un efecto heterotrópico; el ADP, al ser un producto de la reacción PFK, también se une al sitio activo de la enzima). De manera similar, inhibidores como el PEP se unen a sitios alostéricos (que en el caso de PFK se superpone al sitio alostérico activador) donde promueven la formación del estado T, inhibiendo así la enzima.
Dos de los sitios activos de la enzima se encuentran en la interfaz de con el sitio activo interfaces en magenta con los sustratos en cian. Dos sitios activos más se encuentran en la interfaz de las subunidades B (verde) y C (rosa). Un primer plano de la subunidad D de (Amarillo) muestra que los aminoácidos de ambas subunidades A (azul claro) y D (Amarillo) contribuyen a la unión de F6P. Dos de los sitios alostéricos se encuentran en la interfaz de y dos en la interfaz de las subunidades C y D. De nuevo, las interfaces son magenta con el ligando alostérico en cian. Un primer plano de la subunidad A de muestra las contribuciones de ambas subunidades al enlace de ADP. Los cambios conformacionales al pasar entre los estados R y T de PFK se ilustran a continuación.
Las coordenadas atómicas para el PFK del estado R se obtuvieron de 4pfk; las del PFK del estado T se obtuvieron de Philip Evans, MRC Laboratory of Molecular Biology, Cambridge, Reino Unido, pero ahora están disponibles como 6pfk.
Papel en la glucólisis
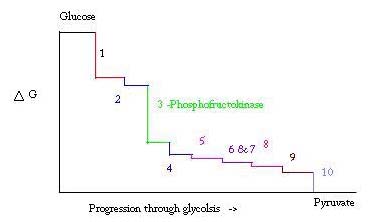
La glucólisis es el proceso de preparación y descomposición de la glucosa para producir ácido pirúvico, que se utiliza en la respiración anaeróbica o como uno de los reactivos iniciales en el ciclo del ácido cítrico. Tres puntos en el proceso de glucólisis ocurren con una gran energía libre negativa y, por lo tanto, son irreversibles. Estos tres puntos son hexocinasa, fosfofructocinasa y piruvato quinasa; de estos tres PFK se considera el principal punto regulador de la glucólisis en el músculo con un ΔG= -25,9 kJ/mol.
Mecanismo y Regulación de la fosfofructocinasa
La fosfofructocinasa se une a Mg2+-ATP y fructosa-6-fosfato (F6P) para producir fructosa-1,6-bisfosfato y Mg2+-ADP. Aunque la imagen con ambos productos no se ha determinado, se ha unido a la enzima. Hay tres sitios de unión de ligandos por subunidad. Dos conforman el sitio activo, que se une a F6P y ATP, mientras que el tercero es un sitio de unión alostérico. Algunos de los residuos que se proponen en el sitio activo son : Los PFK existen en dos estados conformacionales, ambos en equilibrio. El ATP se une a los sitios activos y alostéricos en ambas conformaciones. Mientras que el ATP se une al sitio activo igualmente bien, se une preferentemente al sitio alostérico del estado T Esta unión preferencial causa un cambio desde el equilibrio de los dos estados, a una mayor cantidad de estado T , lo que disminuye la afinidad por F6P. también se une al sitio alostérico para aumentar la proporción de fosfofructocinasa del estado R. Junto con ADP, AMP y F2, 6P inhiben el papel regulador del ATP. El Km de PFK para ATP lo es .020mM y .032 mm.
Regulación
La glucólisis es un proceso metabólico esencial para la supervivencia. Por lo tanto, en su activación y supresión debe estar altamente regulada. Tres puntos en el proceso de glucólisis ocurren con una gran energía libre negativa y, por lo tanto, son irreversibles. Estos tres puntos son hexoquinasa, fosfofructocinasa y piruvato quinasa. Estas tres reacciones son candidatas a ser los principales puntos de regulación debido a sus altas energías libres negativas. De los tres, la PFK se considera el principal punto regulador de la glucólisis (#3 en la imagen de abajo) en el músculo, con un ΔG= -25,9 kJ/mol, porque es un paso comprometido. Una vez que PFK convierte F6P a F1,6P, la reacción no se revertirá fácilmente debido a la gran cantidad de energía que se debe superar para retroceder. . Esta barrera de energía tiene sentido ya que la piruvato quinasa cataliza la reacción final (#10) y la hexoquinasa (#1) no participa en la glucólisis cuando el proceso se inicia a partir del glucógeno.
PFK está regulado por ATP, AMP y ADP. Mientras que el ATP se une en el sitio activo igualmente bien en los estados R y T, se une preferentemente al sitio alostérico del estado T Esta unión preferencial causa un cambio desde el equilibrio de los dos estados, a una mayor cantidad de estado T , lo que disminuye la afinidad por F6P. El activador alostérico ADP también se une al sitio alostérico para aumentar la proporción de fosfofructocinasa en el estado R. Como se puede ver en el gráfico de abajo, las gráficas para la actividad de PFK son sigmoidales. Esto demuestra aún más la naturaleza cooperativa de la enzima. La unión inicial del sustrato a la enzima es difícil, pero una vez que se une y fuerza el cambio de estado de T -> R, los otros sustratos se unen mucho más fácilmente. El gráfico también muestra que la adición de ATP mueve la gráfica a la derecha (es decir, disminuye la afinidad por F6P), mientras que la adición de AMP la mueve a la izquierda.
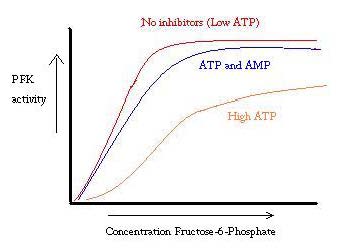
El sistema de regulación coincide bien con la función de PFK. Cuando el PFK está activo, el ATP se produce a partir de él a medida que otros productos se descomponen más completamente. Por lo tanto, cuando los niveles de ATP son bajos y se necesita hacer más, la actividad de PFK aumentará, porque el ADP estará en alta concentración. Lo contrario también es cierto, porque la alta concentración de ATP inhibe la actividad de las proteínas. Y sin embargo, esta explicación no puede explicar completamente la regulación de PFK, porque los niveles de ATP no varían lo suficiente entre los músculos activos y en reposo. Se debe encontrar otro medio de regulación alostérica.
Km de PFK para ATP es .020mM y .032 mm.
Este ejercicio de Kinemage consiste en dos escenas de kinemage que ilustran algunos de los cambios conformacionales inducidos alostéricamente que ocurren en PFK de Bacillus stearothermophilus.
Cambios conformacionales en una Unidad dimérica de PFK
Este kinemage muestra las dos subunidades del tetrámero cuya interfaz contiene dos sitios activos. (KineMage actualmente no es compatible) La primera vista, dímero 1: PFK, muestra las dos subunidades en su conformación de estado R representada por sus espinas dorsales Ca con la Subunidad 1 en tinte rosa y la Subunidad 2 en rosa. Se muestran dos cadenas laterales en cada subunidad, las de Glu 161 (rojo) y Arg 162 (cian), que son parte del sitio de unión de F6P en los estados T y R, respectivamente(ver más abajo). Un F6P (hotpink) y un ADP (verde; «ADP-activo») están enlazados en el sitio activo de cada subunidad. Un ADP adicional (amarillo; «ADP-allo») está unido en un sitio alostérico separado de cada subunidad. Cada ADP tiene un Mg2 + asociado, que está representado aquí por una bola del mismo color que el ADP al que se une.
Haga clic en el botón «ANIMAR»para cambiar el dímero entre sus estados R y T. En su estado T, la Subunidad 1 es bluetint y la Subunidad 2 es skyblue. Las cadenas laterales de Glu 161 y Arg 162 en ambas subunidades son rojas y cianas como antes (solo los átomos Ca y Cb de la cadena lateral Arg 162 en la Subunidad 1 se observan en la estructura de rayos X del estado T; los de la Subunidad 2 se observan todos). La enzima de estado T se une al inhibidor 2-fosfoglicolato (gold; «PGC»), un análogo no fisiológico del fosfoenolpiruvato intermedio glicolítico (PEP). Tenga en cuenta que el sitio de unión de PGC en el estado T se solapa con el sitio de unión alostérico de ADP en el estado R («ADP-allo») y, por lo tanto, su unión es mutuamente excluyente. Los sitios activos de estado T, que no contienen F6P, están marcados con F6Ps» fantasma»(gris;» sitio F6P»), que tienen las mismas posiciones que los F6Ps en la enzima de estado R.
La segunda vista, 2: Sitios Allo / Act, es un primer plano de la parte superior de la primera vista que muestra tanto el sitio activo como el sitio alostérico en esta región. Tenga en cuenta que el sitio activo se encuentra en la interfaz entre dos subunidades y que el sitio alostérico interactúa directamente con el sitio activo en la subunidad adyacente. Compare las conformaciones de estado R y estado T mostrándolas a la vez o haciendo clic en «ANIMAR». ¿Puede identificar el ion Mg2 + asociado a cada uno de los ADP unidos a la enzima en el estado R? ¿Qué átomos de ADP coordinan estos iones Mg2+?
El grupo fosfato de PGC se une al sitio alostérico en el estado T en casi la misma posición que el grupo fosfato beta de «ADP-allo» se une al sitio alostérico en el estado R; ambos grupos fosfato se unen a las cadenas laterales de los mismos tres residuos (2 arg y 1 Lys; no se muestra).
En el estado R de alta actividad, la cadena lateral cargada positivamente de Arg 162 forma un puente salino enlazado con hidrógeno con el grupo de fosfato 6 cargado negativamente de F6P (líneas discontinuas blancas), una interacción que presumiblemente estabiliza el estado R en relación con el estado T y, por lo tanto, es en parte responsable del efecto homotrópico de F6P.
Los Principales Cambios Conformacionales en una Subunidad de PFK.
Este KINEMAGE muestra los segmentos cercanos al sitio alostérico (los residuos 53-60 no se muestran aquí). Al igual que en KINEMAGE 1, el polipéptido está representado por su cadena Ca con Subunidades de estado R 1 y 2 en tinta roja y rosa, y Subunidades de estado T 1 y 2 en tinta azul y azul cielo. (KineMage actualmente no es compatible)KINEMAGE 2 aparece en la vista 1: El Sitio Alostérico, en el estado R que muestra el grupo fosfato de F6P (hotpink) unido al sitio activo de la enzima en un puente salino unido al hidrógeno (líneas blancas discontinuas) con la cadena lateral de Arg 162 (cian). Un ADP (amarillo; «ADP-allo») ocupa el sitio alostérico adyacente. Haga clic una vez en «ANIMAR» para cambiar al estado T. Esto reemplaza el ADP en el sitio alostérico de estado R con el inhibidor y el análogo de PEP PGC (gold). F6P ya no ocupa el sitio activo, pero su posición en el estado R se indica con el F6P «fantasma» (gris; se ve haciendo clic en «sitio F6P»).
¿Qué sucede con el segmento helicoidal central del polipéptido (residuos 149-164) en la transición de R a T? ¿Qué hace esto con las posiciones relativas del Glu 161 con carga negativa y del Arg 162 con carga positiva? Haga clic en «Sitio F6P». ¿Qué influencia tendría la ausencia de la carga positiva de Arg 162 en la unión de F6P? ¿Explica esto, al menos en parte, por qué el PFK del estado T tiene baja afinidad por el F6P? Ve a Vista 2: Primer plano, para ver un primer plano de las interacciones F6P-cadena lateral. Centre las moléculas eligiendo » pickcenter «en el menú» herramientas » y haciendo clic en el átomo que le gustaría estar en el centro. Deslice el deslizador «zoom» para ampliar la vista.
Mutagénesis dirigida al sitio
En un momento dado, se pensó que la carga negativa de Glu 161 tenía un efecto negativo en la unión de F6P en el estado T. Esta idea no ha sido apoyada por experimentos de mutagénesis dirigidos al sitio. Se han producido varios PFK mutantes, incluidos R162A, E161A y R162A/E161A. La mutación R162A causó una disminución de 30 veces en la unión a F6P. La mutación E161A, sin embargo, tuvo poco efecto en la capacidad de la PEP para inhibir la unión a la F6P.
Enfermedad
Eritrocitos hereditarios La deficiencia de PFK se asocia con miopatía y hemólisis (enfermedad de Tarui).
estructuras 3D de la PFK
la Fosfofructoquinasa estructuras 3D
Leave a Reply