Frontiers en Farmacología
Introducción
Los liposomas son un tipo de nanocarrier que ha sido ampliamente investigado con fines de administración de fármacos. Están compuestos de bicapas fosfolípidas que encierran un espacio acuoso distinto, lo que permite la encapsulación de compuestos hidrofílicos e hidrofóbicos (Metselaar y Storm, 2005). Los liposomas son capaces de estabilizar los compuestos terapéuticos y superar las barreras a la captación celular y tisular(Ding et al., 2006; Hua y Wu, 2013). Esto les permite mejorar la orientación de los compuestos a los sitios de enfermedad y, en consecuencia, reducir la acumulación en órganos no diana (Bakker-Woudenberg et al., 1994; Mastrobattista et al., 1999; Hua, 2013; Hua et al., 2015; Sercombe et al., 2015; Zununi Vahed et al., 2017). Hay cuatro tipos principales de liposomas basados en sus características superficiales: liposomas convencionales, liposomas pegilados, liposomas dirigidos a ligandos y liposomas teranósticos (Figura 1; Sercombe et al., 2015). Los liposomas dirigidos a ligandos proporcionan el potencial de administración de fármacos en sitios específicos a ciertos tejidos u órganos que expresan selectivamente el ligando dirigido (Willis y Forssen, 1998; Bendas, 2001; Sawant y Torchilin, 2012), mientras que los liposomas pegilados confieren un obstáculo estérico para mejorar la vida media de circulación del sistema de administración después de la administración sistémica (Torchilin, 1994; Wang et al., 2015). Los liposomas que incorporan una combinación de las diversas plataformas de administración pueden mejorar aún más la administración de compuestos encapsulados, dependiendo de la vía de administración y el sitio de la enfermedad.
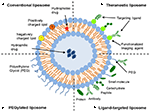
la FIGURA 1. Representación esquemática de los diferentes tipos de sistemas de administración de fármacos liposomales: (A) liposomas convencionales, (B) liposomas pegilados, (C) liposomas dirigidos a ligandos y (D) liposomas teranósticos (Sercombe et al., 2015).
Después del proceso de fabricación, los liposomas se caracterizan para garantizar la homogeneidad en una serie de parámetros, incluida la encapsulación de fármacos, la conjugación de ligandos, la composición lipídica, la carga superficial y las propiedades morfológicas (por ejemplo, tamaño, forma y número de láminas) (Kuntsche et al., 2011). Estas características son importantes ya que pueden tener un gran impacto en el comportamiento de los liposomas tanto in vitro como in vivo (Sawant y Torchilin, 2012; Sercombe et al., 2015). El reconocimiento y la eliminación de liposomas por las defensas del cuerpo, incluido el sistema reticuloendotelial (RES) y la adsorción de opsoninas con la posterior absorción por el sistema fagocítico mononuclear, son los principales contribuyentes a la eliminación y degradación de los liposomas (Senior, 1987; Cullis et al., 1998; Ishida et al., 2001). Por lo tanto, ser capaz de determinar las propiedades fisicoquímicas de los liposomas fabricados es importante para optimizar una formulación para una evaluación traslacional posterior.
Un aspecto importante en la evaluación fisicoquímica de los liposomas es la visualización de la morfología de las nanopartículas mediante microscopía. Hay una serie de técnicas disponibles para obtener imágenes de liposomas y otras nanopartículas que se pueden clasificar ampliamente en microscopía de luz, electrones o fuerza atómica (Bibi et al., 2011). Cada técnica tiene sus propias ventajas y limitaciones, que deben tenerse en cuenta al evaluar estudios sobre sistemas de administración de fármacos basados en nanopartículas (Tabla 1). Esta revisión evaluará cada técnica de imagen utilizada para evaluar las características morfológicas de los liposomas.

CUADRO 1. Resumen de las técnicas de imagen actuales para caracterizar la morfología de los liposomas.
Microscopía de luz
La microscopía óptica o de luz se refiere a los microscopios que utilizan luz visible y una disposición de lentes para ampliar un campo de visión (Murphy y Davidson, 2012c). La microscopía óptica básica en sí no puede proporcionar información completa sobre la bicapa lipídica en comparación con los detalles ofrecidos por otras técnicas de microscopía. Sin embargo, se puede utilizar para obtener rápidamente una imagen de vesículas utilizando equipos básicos de laboratorio (Bibi et al., 2011). Esta técnica puede ser particularmente útil para recopilar información general sobre el tamaño, la forma, la homogeneidad y el grado de agregación de una muestra de liposomas (Nallamothu et al., 2006). Los microscopios ópticos tienen una resolución final de 2 250 nm (gobernados por el tamaño de punto limitado por difracción más pequeño que puede alcanzar el instrumento) y, como tal, son típicamente incapaces de proporcionar información detallada sobre las estructuras de pequeñas vesículas unilamelares (SUV) y la laminaridad de las vesículas (Bibi et al., 2011). En general, la microscopía de luz solo puede proporcionar información significativa sobre vesículas unilamelares gigantes (GUV), que pueden variar de un solo a cientos de micrómetros de diámetro (Bagatolli, 2009). La incorporación de sondas fluorescentes, las técnicas de polarización y la aplicación de microscopía confocal de alta resolución pueden proporcionar más información sobre la estructura 3D y la lamelaridad de las vesículas (Bagatolli, 2009).
Microscopía de polarización
Este tipo de microscopía de luz utiliza la capacidad única de la luz polarizada para interactuar con enlaces polarizables de moléculas ordenadas (Murphy y Davidson, 2012d). La absorción de luz mejorada se produce cuando los dipolos moleculares de la muestra están alineados con el vector de polarización de la onda de luz incidente; el resultado son diferencias de fase entre los rayos de luz de muestreo, que a su vez producen cambios de amplitud dependientes de la interferencia en el plano de la imagen (Murphy y Davidson, 2012d). El contraste de la imagen surge no solo de los efectos de la interferencia y la difracción, sino también debido a la presencia de arreglos moleculares ordenados (Murphy y Davidson, 2012d). Se puede usar para estudiar la forma y la dinámica de muchas estructuras celulares ordenadas, incluidas las bicapas lipídicas de las membranas plasmáticas (Bibi et al., 2011; Murphy y Davidson, 2012d). Las imágenes se pueden obtener en monocromo o en color. Esta técnica proporciona un método alternativo para visualizar liposomas, particularmente para confirmar la formación de vesículas. No proporciona observaciones concluyentes sobre las características de las dos capas o la lamelaridad de las vesículas(Bibi et al., 2011). Además, la microscopía de polarización también está limitada por el tamaño de las vesículas que se pueden visualizar, con vesículas grandes en el rango micrométrico que tienen la claridad óptima. Esta técnica no proporciona imágenes claras de partículas en el rango nanométrico.
Microscopía de fluorescencia
La microscopía de fluorescencia o «epifluorescencia» es una forma especial de microscopía de luz que explota la capacidad de los fluorocromos de emitir luz después de ser excitados con luz de cierta longitud de onda (Murphy y Davidson, 2012b). Esta técnica es ampliamente utilizada en biofísica para proporcionar información esencial sobre la estructura y la dinámica de los componentes de la membrana (Bouvrais et al., 2010). En estos estudios, las sondas fluorescentes se incorporan específicamente a la membrana bajo investigación, lo que permite la visualización de la estructura. Una amplia gama de tintes fluorescentes con diversas propiedades químicas y fotónicas están disponibles comercialmente, atendiendo a una variedad de preguntas de investigación. Por ejemplo, ciertos tintes fluorescentes pueden preferir ambientes de membrana específicos que exhiben diferentes arreglos y empaque lateral(Bouvrais et al., 2010). Como tal, la microscopía de fluorescencia permite la posibilidad de aplicar simultáneamente múltiples sondas dentro de una muestra para proporcionar información sobre la estructura de la membrana en sí. Las sondas fluorescentes se pueden colocar dentro del compartimento acuoso, así como en la bicapa lipídica de los liposomas (Bibi et al., 2011). Esta disposición puede ser especialmente útil cuando se visualizan GUV, donde se puede obtener información sobre la forma, el tamaño y la fluidez de las vesículas lipídicas (Klymchenko et al., 2009; Bouvrais et al., 2010). La incorporación de sondas, como los lípidos marcados con rodamina, directamente en la bicapa lipídica también puede permitir la visualización de la lamelaridad de los liposomas (Bibi et al., 2011).
La desventaja de la microscopía fluorescente es que la adición de sondas y colorantes a un sistema de membrana puede interferir potencialmente con las propiedades del sistema de administración liposomal (Bouvrais et al., 2010; Bibi et al., 2011; Murphy y Davidson, 2012b). Sin embargo, se ha demostrado que el uso de concentraciones bajas de tinte (≤1 mol%) tiene un impacto mínimo en las propiedades físicas de la membrana (Bouvrais et al., 2010). También es importante tener en cuenta que la elección del tinte fluorescente es un paso crítico, ya que algunos tintes pueden inducir grandes cambios en la membrana del huésped y/o causar artefactos experimentales, lo que resulta en una interpretación inexacta de los datos (Bouvrais et al., 2010). Además, la peroxidación lipídica fotoinducida también puede conducir a la formación de dominios incluso en sistemas de tintes simples. Este proceso puede resultar en la formación de grandes balsas y la formación espontánea de facetas (Bouvrais et al., 2010). La exposición prolongada a la luz fluorescente también puede resultar en decoloración y pérdida de intensidad de fluorescencia. Por lo tanto, la elección del tinte fluorescente y el desarrollo de nuevas sondas de membrana son consideraciones importantes cuando se usa microscopía de fluorescencia (Klymchenko et al., 2009).
Microscopía confocal
La microscopía confocal de barrido ha sido un avance en el área de la microscopía de fluorescencia. En lugar de iluminar toda la muestra, una imagen se construye escaneando uno (o más) haces de luz enfocados a través de la muestra. La luz que regresa de la muestra iluminada pasa a través de una abertura que rechaza la luz desenfocada desde arriba y por debajo del plano de interés; asegurar que solo se obtengan imágenes de una pequeña profundidad de campo, mejorando en gran medida la resolución fuera del plano (Bibi et al., 2011; Murphy y Davidson, 2012a). Utilizando esta técnica, se recopila una «pila z» de imágenes, comenzando desde la parte superior de la vesícula, seguida de imágenes tomadas en incrementos z definidos hasta la parte inferior de la muestra, lo que resulta en una imagen 3D compuesta de la muestra (Bibi et al., 2011; Murphy y Davidson, 2012a). La microscopía de barrido confocal se ha convertido en una técnica más atractiva que los microscopios de luz epifluorescentes debido a su claridad de imagen superior. En el caso de las GUV, esta técnica es capaz de visualizar la estructura interna de los sistemas lipídicos, lo que a menudo no es posible con otros métodos de microscopía (Ruozi et al., 2011; Mertins y Dimova, 2013). Por ejemplo, la separación de la fase bicapa acuosa y lipídica se puede visualizar claramente en vesículas más grandes (Mertins y Dimova, 2013). Sin embargo, la microscopía confocal todavía está limitada a la difracción y, por lo tanto, es incapaz de producir imágenes de alta definición de SUV o liposomas oligolamelares (Ruozi et al., 2011).
Técnicas de microscopía Electrónica
La microscopía electrónica es un método para la visualización de vesículas bajo un aumento muy alto (Henry, 2005). Es ampliamente utilizado en la caracterización de vesículas lipídicas, ya que la longitud de onda de electrones (y, por lo tanto, la resolución limitada por difracción), es muchos órdenes de magnitud menor que la de la microscopía óptica, y por lo tanto proporciona una superresolución para una visualización clara de liposomas pequeños (Bibi et al., 2011; Ruozi et al., 2011). Esta técnica utiliza un haz de electrones enfocado en la superficie de la muestra por varias lentes electromagnéticas. Los electrones son luego dispersados por la muestra, y luego son reorientados y amplificados por una serie adicional de lentes electromagnéticas en la columna de imágenes para producir una imagen proyectada (Henry, 2005). Hay varios tipos diferentes de microscopios electrónicos, cada uno de los cuales requiere un método de preparación de muestras diferente.
Microscopía electrónica de barrido (SEM)
Los microscopios electrónicos de barrido (SEM) utilizan un haz de electrones que se escanea a través o sobre una muestra (en lugar de a través de una muestra) para producir una imagen ampliada de un objeto (Adler y Schiemann, 1985). Alder et al. el primer intento de usar SEM para caracterizar liposomas fue en 1984 (Adler y Schiemann, 1985). Mostraron que el uso del método de liofilización para preparar las muestras de liposomas para el SEM resultó en una gran proporción de bultos visibles y material con costras (Adler y Schiemann, 1985). Estudios más recientes han demostrado que la estructura del liposoma en sí puede sufrir perturbaciones debido a las condiciones de alto vacío y los procesos de tinción requeridos para esta técnica de preparación (Ruozi et al., 2011). El SEM ahora no se usa comúnmente para analizar liposomas porque requiere que la muestra se seque o se fije antes de la toma de imágenes (Ruozi et al., 2011). Sin embargo, el SEM puede proporcionar información general sobre la estructura concéntrica de las diferentes capas lipídicas, así como dar detalles sobre el tamaño y la morfología esférica de un preparado (Nirale et al., 2009).
Microscopía Electrónica de transmisión (TEM)
La microscopía electrónica de transmisión (TEM) es el método de imagen más utilizado para la evaluación de la estructura de nanopartículas (Henry, 2005; Kuntsche et al., 2011). Consiste en la preparación de una muestra delgada (<de 100 nm de espesor) que se coloca en una cámara de vacío. El haz de electrones atraviesa la muestra, donde luego es enfocado por la lente del objetivo para formar una imagen. La TEM puede obtener fácilmente imágenes de muestras de materia blanda con una resolución espacial de hasta muy por debajo de 1 nm de tamaño (Henry, 2005; Kuntsche et al., 2011; Ruozi et al., 2011). Esta técnica se puede categorizar en función del método de preparación de muestras utilizado, en particular, tinción negativa, fractura por congelación y TEM criogénico. Puede proporcionar información sobre modificaciones superficiales de nanopartículas, ya que proporciona un mejor contraste y contorno de imágenes que otras técnicas de microscopía. Por ejemplo, la conjugación de transferrina a la superficie de liposomas de DSPC/colesterol mostró un revestimiento de superficie de partículas con TEM de tinción negativa, que estaba ausente en las preparaciones de liposomas no conjugados (Anabousi et al., 2005). En un experimento separado, se agregaron anticuerpos específicos contra transferrina humana antes del procedimiento de tinción negativa para confirmar la identidad del revestimiento de la superficie de partículas (Anabousi et al., 2005). Por lo tanto, TEM proporciona la posibilidad de lograr una resolución mucho mejor al evaluar la conjugación de ligandos a la superficie de los liposomas.
Técnica de tinción negativa
En el TEM de tinción negativa, la preparación de la muestra implica colocar una pequeña cantidad de muestra hidratada en una rejilla. Como las vesículas están en contacto directo con la rejilla, su orientación y morfología pueden verse afectadas, por lo que esto debe tenerse en cuenta (Bibi et al., 2011). También es necesario incrustar los liposomas en un material adecuado con densidad electrónica (p. ej., sales de metales pesados como acetato de uranilo o ácido fosfotungstico) que proporcionan un alto contraste, por lo que las vesículas se pueden ver contra un fondo teñido de oscuro (Ruozi et al., 2011). La técnica de tinción negativa es relativamente rápida y simple; sin embargo, se ha demostrado que causa cambios en la estructura liposómica original y puede conducir a la creación de flecos claros y oscuros que pueden confundirse con estructuras lamelares (Bibi et al., 2011; Ruozi et al., 2011). Además, colocar la muestra al vacío puede causar una mayor deshidratación de la muestra, lo que de nuevo puede causar cambios en la estructura de las vesículas (Bibi et al., 2011). Si bien la técnica TEM de tinción negativa puede proporcionar un aumento mucho mayor para obtener imágenes de nanopartículas, el daño a la estructura del liposoma dificulta la evaluación precisa de las características morfológicas de la muestra. Por lo tanto, generalmente se requieren otras técnicas de diagnóstico por imágenes para confirmar los resultados.
Técnica de fractura por congelación
La técnica de fractura por congelación no requiere ningún proceso de secado y puede proporcionar información adicional sobre la estructura interna de las nanopartículas (Kuntsche et al., 2011). Este método consiste en colocar una muestra en una rejilla TEM que está intercalada entre dos soportes de cobre u oro (Severs, 2007). La muestra se vitrifica mediante congelación rápida, típicamente con propano líquido o nitrógeno líquido, antes de fracturarse a lo largo de áreas de la muestra con interacciones moleculares débiles. Esta superficie de fractura se puede grabar y sombrear con una fina capa de platino o carbono para proporcionar una réplica «negativa» del plano de muestra de fractura (Severs, 2007; Kuntsche et al., 2011). A continuación, la réplica se limpia con un disolvente orgánico para eliminar todos los residuos antes de visualizarla bajo un microscopio TEM. Como estas réplicas son tan estables, se pueden almacenar y ver más tarde(Kuntsche et al., 2011). La principal ventaja de esta técnica es que las réplicas reflejan de cerca el estado nativo de la muestra, y pueden proporcionar información detallada sobre la estructura 3D de las vesículas y la organización de las bicapas (Bibi et al., 2011; Kuntsche et al., 2011). Esta información incluye la construcción multilamelar y el embalaje bicapa de vesículas multilamelares. Esta técnica también puede evaluar el tamaño del agregado y puede ser particularmente útil para examinar la interacción de los liposomas catiónicos con el ADN (Bibi et al., 2011). Sin embargo, todavía pueden aparecer artefactos en la muestra durante la preparación debido a la tasa de congelación insuficiente, la deposición de moléculas de disolvente y/o el estrés mecánico (Severs, 2007; Kuntsche et al., 2011). Por ejemplo, un «efecto ondulante» puede ocurrir en los SUV de la muestra (Bibi et al., 2011). Esta es una deformación bicapa común que se debe a un trastorno en las transiciones de las cadenas aciles antes de la congelación. La incubación de vesículas entre la temperatura de transición previa y la temperatura de transición real también puede causar ondulaciones(Bibi et al., 2011). Curiosamente, esto se puede usar para proporcionar información sobre las transiciones de fase lipídica que ocurren con la naturaleza variable de los lípidos utilizados para preparaciones liposomales (Bibi et al., 2011).
TEM criogénico
TEM criogénico (crio-TEM) es una variación de TEM en la que se utilizan películas hidratadas acuosas finas vitrificadas en etano líquido antes de la obtención de imágenes. Esta técnica permite el análisis de liposomas en su estado más nativo, y es una herramienta valiosa para determinar el tamaño, la forma, la estructura interna y la lamelaridad de los liposomas (Weisman et al., 2004; Bibi et al., 2011; Kuntsche et al., 2011). La principal ventaja de congelar rápidamente las muestras de liposomas es minimizar la formación de cristales de hielo y preservar proteínas u otros materiales (Bibi et al., 2011; Kuntsche et al., 2011). Esto es beneficioso cuando las proteínas o el ADN se han encapsulado dentro de las nanopartículas (Weisman et al., 2004; Kuntsche et al., 2011). La criotem es la forma de microscopía más útil disponible actualmente para estudiar liposomas, ya que evita problemas de fijación química, deshidratación, corte y tinción, todo lo cual puede afectar la morfología de las vesículas (Bibi et al., 2011). El rango de resolución es de 5 5 a 500 nm, definido por el grosor de la película (Almgren et al., 2000). Sin embargo, se deben tener en cuenta varias limitaciones con esta técnica, incluido el hecho de que solo se obtiene una imagen 2D de objetos 3D (lo que generalmente también se aplica a la mayoría de las otras técnicas de microscopía). Para superar esta limitación, es posible la reconstrucción de formas 3D a partir de un número suficientemente grande de imágenes 2D de partículas no esféricas orientadas aleatoriamente (Orlova et al., 1999), así como ver la muestra en diferentes ángulos de inclinación para obtener información sobre la forma 3D (Van Antwerpen y Gilkey, 1994). La tomografía criogénica de electrones (cryo-ET) también se puede utilizar para obtener imágenes en 3D (Le Bihan et al., 2009). El crio-TEM también utiliza dosis más bajas de electrones, lo que significa que a menudo tiene una resolución más baja en comparación con otros métodos (Bibi et al., 2011; Kuntsche et al., 2011). Los artefactos todavía son posibles debido a la formación de una película delgada de hielo amorfo y el uso de secantes en la muestra aplicando fuerzas cortantes durante la formación de la película (Almgren et al., 2000; Bibi et al., 2011).
Microscopía Electrónica de Barrido Ambiental (ESEM)
La microscopía electrónica de barrido ambiental (ESEM) es un sistema de imágenes que no requiere el uso de fijación, tinción o congelación de vesículas, y puede permitir la obtención de imágenes de cambios dinámicos de sistemas húmedos sin preparación previa de muestras (Muscariello et al., 2005; Ruozi et al., 2011). La característica principal de ESEM es la presencia de vapor de agua en la cámara del microscopio. La capacidad de mantener una atmósfera que contiene agua alrededor de la muestra que puede estar parcialmente o incluso totalmente hidratada es posible gracias al uso de un sistema de vacío graduado de apertura múltiple que permite que la cámara de imágenes se mantenga a presiones de hasta 55 hPa (Bibi et al., 2011; Ruozi et al., 2011). El haz de electrones primario puede generar electrones secundarios que luego se encuentran con moléculas de vapor, lo que lleva a una amplificación en cascada de la señal antes de llegar al detector. Debido a esto, ESEM no requiere preparación de muestras (Muscariello et al., 2005). Esta técnica permite la variación en el entorno de la muestra a través de una serie de composiciones de presión, temperatura y gas (Mohammed et al., 2004), que es útil para determinar cómo los cambios ambientales afectan a las vesículas. Esto es aplicable a estudios de formulación y estabilidad nanofarmacéutica(Bibi et al., 2011). El ESEM también se ha utilizado para analizar la carga de fármacos en la bicapa de los liposomas (Mohammed et al., 2004), así como determinar el tamaño y la forma de las vesículas. Una limitación de ESEM es que no puede proporcionar información detallada sobre la lamelaridad y la arquitectura interna de las estructuras a nanoescala (Ruozi et al., 2011).
Microscopía de fuerza atómica (AFM)
La microscopía de fuerza atómica (AFM), también conocida como microscopía de fuerza de barrido (SFM), es un tipo de técnica de microscopio de sonda de barrido. Funciona ejecutando una punta afilada unida a un voladizo y un sensor sobre la superficie de una muestra y midiendo las fuerzas de superficie entre la sonda y la muestra (Sitterberg et al., 2010). A medida que el voladizo recorre la superficie de la muestra, se mueve hacia arriba y hacia abajo debido a las características de la superficie y el voladizo se desvía en consecuencia. Esta desviación generalmente se cuantifica utilizando un sensor óptico, con el rayo láser reflejado en la parte posterior del voladizo en el detector de luz (Sitterberg et al., 2010). El AFM no necesita funcionar en vacío y puede funcionar en aire ambiente o bajo líquido; por lo tanto, se utiliza cada vez más para obtener imágenes de muestras biológicas y nanopartículas (Liang et al., 2004a, b; Ruozi et al., 2005, 2009). AFM tiene una resolución excepcional en el orden de fracciones de un nanómetro y puede proporcionar una imagen 3D de liposomas junto con detalles sobre morfología, distribución de tamaños, homogeneidad y estabilidad (Liang et al., 2004a, b; Ruozi et al., 2005, 2007, 2009). Es importante destacar que la AFM se puede utilizar para caracterizar las modificaciones superficiales de los liposomas y detectar ligandos (por ejemplo, anticuerpos y polímeros) conjugados en la superficie de la membrana liposomal (Bendas et al., 1999; Moutardier et al., 2003; Anabousi et al., 2005; Liang et al., 2005). Por ejemplo, Bendas et al. utilizó AFM para ampliar el borde de la membrana liposomal y pudo obtener imágenes de estructuras triméricas, de aproximadamente 8-10 nm de diámetro, que representaban el acoplamiento de anticuerpos IgG a la superficie del liposoma (Bendas et al., 1999). Los hallazgos mostraron que la eficacia de la técnica dependía en gran medida del método de conjugación utilizado, ya que los anticuerpos conjugados directamente a la superficie liposomal eran visibles con AFM (movilidad proteica restringida), en comparación con los anticuerpos unidos a las cadenas PEG. Era sugestivo que las cadenas PEG causaban una alta movilidad proteica y, por lo tanto, no podían ser escaneadas (Bendas et al., 1999). Por el contrario, Anabousi et al mostraron que la incorporación de lípidos pegilados en los liposomas indujo una estabilización estérica con liposomas manteniendo una forma esférica (Anabousi et al., 2005). Las imágenes de AFM de la superficie de los liposomas no conjugados fueron lisas y no se observaron estructuras, mientras que la conjugación de transferrina a la superficie de los liposomas pegilados se visualizaron como pequeñas estructuras globulares (Anabousi et al., 2005). De manera similar, Moutardier et al fabricaron liposomas con núcleos poliméricos (LSP) que consistían en fármacos cargados en partículas poliméricas que formaban el núcleo de vesículas lipídicas (Moutardier et al., 2003). Las imágenes tomadas con AFM mostraron la presencia de una red de polímeros en la superficie exterior, lo que sugiere que el núcleo polimérico de colágeno se irradió hacia afuera y formó una capa superficial en el LSP (Moutardier et al., 2003). Además de los detalles estructurales de la superficie, el AFM puede proporcionar información sobre las propiedades mecánicas y químicas de una superficie de muestra a través de mediciones de fuerza(Ruozi et al., 2007). Por ejemplo, Mao et al. se utilizó esta técnica para evaluar la elasticidad y las propiedades adhesivas de los liposomas(Mao et al., 2004). Una limitación de AFM es la necesidad de que las nanopartículas se adsorban en superficies de soporte, como mica o obleas de silicio. La adsorción de liposomas en un sustrato sólido tiene el potencial de modificar el tamaño y la forma de las vesículas y causar su aplanamiento. (Ruozi et al., 2007). Además, el contacto periódico de la punta de sondeo puede arrastrar los liposomas a medida que se mueven a través de las vesículas de una muestra (Jass et al., 2000). A pesar de esto, la AFM sigue siendo una herramienta útil en la evaluación de liposomas.
Conclusión
Existe una amplia gama de técnicas de imagen disponibles para evaluar la morfología de los liposomas, cada una con sus propias ventajas y desventajas. La microscopía de luz puede proporcionar detalles generales sobre el tamaño y la forma de vesículas más grandes y la homogeneidad de una muestra de una manera relativamente rápida. Por el contrario, la TEM es la técnica más utilizada para examinar la morfología de los liposomas con mucho más detalle; sin embargo, el potencial de cambios estructurales con cada subtipo TEM debido a la tinción y/o exposición a condiciones de vacío debe tenerse en cuenta al interpretar los resultados. ESEM es más útil para determinar cambios liposomales en respuesta al medio ambiente, mientras que AFM está emergiendo como un método útil en el análisis morfológico de nanopartículas y proporciona la máxima resolución de la superficie liposomal. Tanto la AFM como la TEM son capaces de obtener imágenes de ligandos conjugados con la superficie de los liposomas y proporcionan información complementaria sobre las modificaciones de la superficie. En general, la elección de la técnica depende de las características morfológicas y el grado de detalle que se requieren. Además, la comprensión de los efectos potenciales del método de preparación de muestras de cada técnica de imágenes es importante en el proceso de selección.
Contribuciones de los autores
Redacción del manuscrito: A-LR y SH. Revisión crítica del artículo para el contenido intelectual importante: SH, PD, JF, WP, AM, DS y AW.
Declaración de Conflicto de Intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Agradecimientos
Los autores desean agradecer al Fondo de Investigación Farmacéutica de Nueva Gales del Sur, la Fundación de Investigación Médica Rebecca L. Cooper, la Beca Gladys M. Brawn, la Fundación de Investigación ausEE y la Universidad de Newcastle por proporcionar apoyo financiero para nuestra investigación.
Adler, K., and Schiemann, J. (1985). Caracterización de liposomas mediante microscopía electrónica de barrido y la técnica de fractura por congelación. Micron Microsc. Acta 16, 109-113. doi: 10.1016/0739-6260(85)90039-5
CrossRef Full Text/Google Scholar
Almgren, M., Edwards, K., and Karlsson, G. (2000). Crio-microscopía electrónica de transmisión de los liposomas y las estructuras relacionadas. Los Coloides Surfean. Un Fisicoquímico. Ing. Áspid. 174, 3–21. doi: 10.1016/S0927-7757(00)00516-1
CrossRef Texto Completo | Google Scholar
Anabousi, S., Laue, M., Lehr, C. M., Bakowsky, U., and Ehrhardt, C. (2005). Evaluación de la modificación de transferrinas de liposomas mediante microscopía de fuerza atómica y microscopía electrónica de transmisión. EUR. J. Pharm. Biofármaco. 60, 295–303. doi: 10.1016 / j. ejpb.2004.12.009
PubMed Abstract | CrossRef Texto Completo | Google Scholar
Bagatolli, L. A. (2009). Membranas y Microscopía de Fluorescencia. Comentarios en Fluorescencia 2007. Nueva York, NY: Springer, 33-51. doi: 10.1007 / 978-0-387-88722-7_2
Texto completo de CrossRef | Google Scholar
Bakker-Woudenberg, I. A., Storm, G., and Woodle, M. C. (1994). Liposomas en el tratamiento de infecciones. J. Objetivo de Drogas. 2, 363–371. doi: 10.3109/10611869408996811
Resumen de PubMed | Texto completo cruzado / Google Académico
Bendas, G. (2001). Inmunoliposomas: un enfoque prometedor para tratar el tratamiento del cáncer. Biofármacos 15, 215-224. doi: 10.2165 / 00063030-200115040-00002
Texto completo cruzado | Google Scholar
Bendas, G., Krause, A., Bakowsky, U., Vogel, J., and Rothe, U. (1999). Targetability of novel immunoliposomes prepared by a new antibody conjugation technique. Int. J. Pharm. 181, 79–93. doi: 10.1016/S0378-5173(99)00002-2
Resumen de PubMed | Texto completo cruzado | Google Scholar
Bibi, S., Kaur, R., Henriksen-Lacey, M., McNeil, S. E., Wilkhu, J., Lattmann, E., et al. (2011). Imágenes microscópicas de liposomas: desde cubreobjetos hasta SEM ambiental. Int. J. Pharm. 417, 138–150. doi: 10.1016 / j. ijpharm.2010.12.021
Resumen de PubMed / Texto completo cruzado / Google Scholar
Bouvrais, H., Pott, T., Bagatolli, L. A., Ipsen, J. H., and Meleard, P. (2010). Impacto de las sondas fluorescentes ancladas a membrana en las propiedades mecánicas de las bicapas lipídicas. Biochim. Biophys. Acta 1798, 1333-1337. doi: 10.1016 / j. bbamem.2010.03.026
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Cullis, P. R., Chonn, A., and Semple, S. C. (1998). Interacciones de liposomas y sistemas portadores basados en lípidos con proteínas sanguíneas: relación con el comportamiento de eliminación in vivo. Drogas Avanzadas Deliv. Apo. 32, 3-17. doi: 10.1016/S0169-409X(97)00128-2
Resumen de PubMed | Texto completo cruzado | Google Scholar
Ding, B. S., Dziubla, T., Shuvaev, V. V., Muro, S. y Muzykantov, V. R. (2006). Sistemas avanzados de administración de fármacos dirigidos al endotelio vascular. Mol. Interv. 6, 98–112. doi: 10.1124 / mi.6.2.7
PubMed Abstract | CrossRef Texto Completo | Google Scholar
Henry, C. R. (2005). Morfología de nanopartículas soportadas. Prog. Surf. Sci. 80, 92–116. doi: 10.1016 / j. progsurf.2005.09.004
CrossRef Texto Completo | Google Scholar
Hua, S. (2013). Objetivo de los sitios de inflamación: molécula de adhesión intercelular-1 como objetivo para nuevas terapias inflamatorias. Delantero. Pharmacol. 4:127. doi: 10.3389 / fphar.2013.00127
Resumen de PubMed / Texto completo cruzado / Google Scholar
Hua, S., Marks, E., Schneider, J. J., and Keely, S. (2015). Avances en los sistemas de nano administración oral para la administración de medicamentos dirigidos al colon en la enfermedad inflamatoria intestinal: focalización selectiva en tejido enfermo versus tejido sano. Nanomedicine 11, 1117-1132. doi: 10.1016 / j.nano.2015.02.018
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Hua, S., and Wu, S. Y. (2013). El uso de nanocarriers a base de lípidos para terapias dirigidas contra el dolor. Delantero. Pharmacol. 4:143. doi: 10.3389 / fphar.2013.00143
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Ishida, T., Harashima, H., and Kiwada, H. (2001). Interacciones de liposomas con células in vitro e in vivo: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L., Duportail, G., et al. (2009). Visualización de dominios lipídicos en vesículas unilamelares gigantes utilizando una sonda de membrana sensible al medio ambiente basada en 3-hidroxiflavona. Biochim. Biophys. Acta 1788, 495-499. doi: 10.1016 / j. bbamem.2008.10.019
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Kuntsche, J., Horst, J.C., and Bunjes, H. (2011). Microscopía electrónica de transmisión criogénica (crio-TEM) para estudiar la morfología de los sistemas coloidales de administración de fármacos. Int. J. Pharm. 417, 120–137. doi: 10.1016 / j. ijpharm.2011.02.001
PubMed Abstract | CrossRef Texto Completo | Google Scholar
Le Bihan, O., Bonnafous, P., Marak, L., Bickel, T., Trepout, S., Mornet, S., et al. (2009). Tomografía crioelectrónica de transmigración de nanopartículas en liposomas. J. Struct. Biol. 168, 419–425. doi: 10.1016 / j. jsb.2009.07.006
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Liang, X., Mao, G., and Ng, K. Y. (2004a). Medición de propiedades mecánicas y estabilidad de liposomas que contienen colesterol en mica mediante microscopía de fuerza atómica. J. Interfaz Coloide Sci. 278, 53–62.
Resumen de PubMed/Google Scholar
Liang, X., Mao, G., and Ng, K. Y. (2005). Efecto de las longitudes de cadena de PEO-PPO-PEO en la morfología y estabilidad de liposomas unilamelares pequeños: una investigación de AFM. J. Interfaz Coloide Sci. 285, 360–372. doi: 10.1016 / j. jcis.2004.11.042
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Liang, X., Mao, G., and Simon Ng, K. Y. (2004b). Sondeo de pequeñas vesículas unilamelares de huevos en la superficie de la mica mediante microscopía de fuerza atómica. Los Coloides Surfean. B Biointerfaces 34, 41-51.
Resumen de PubMed/Google Scholar
Mao, G., Liang, X., and Ng, K. Y. S. (2004). Encyclopedia of Nanoscience and Nanotechnology (en inglés). Nueva York, NY: Marcel Dekker.
Google Scholar
Mastrobattista, E., Koning, G. A., and Storm, G. (1999). Inmunoliposomas para la administración dirigida de fármacos antitumorales. Drogas Avanzadas Deliv. Apo. 40, 103-127. doi: 10.1016/S0169-409X(99)00043-5
CrossRef Texto Completo | Google Scholar
Mertins, O., and Dimova, R. (2013). Insights on the interactions of chitosan with phospholipid vesicles (en inglés). Parte II: rigidez de la membrana y formación de poros. Langmuir 29, 14552-14559. doi: 10.1021 / la4032199
Resumen de PubMed / Texto completo cruzado / Google Scholar
Metselaar, J. M., and Storm, G. (2005). Liposomas en el tratamiento de trastornos inflamatorios. Opinión Experta. Entrega de Drogas. 2, 465–476. doi: 10.1517/17425247.2.3.465
PubMed Abstract | CrossRef Texto Completo | Google Scholar
Mohammed, A. R., Weston, N., Coombes, A. G., Fitzgerald, M., and Perrie, Y. (2004). Formulación de liposomas de fármacos poco solubles en agua: optimización de la carga de fármacos y análisis de estabilidad de ESEM. Int. J. Pharm. 285, 23–34. doi: 10.1016 / j. ijpharm.2004.07.010
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Moutardier, V., Tosini, F., Vlieghe, P., Cara, L., Delpero, J. R., and Clerc, T. (2003). Biodisponibilidad de medicamentos anticancerosos coloidales en modelos de administración oral. Int. J. Pharm. 260, 23–38. doi: 10.1016/S0378-5173(03)00231-X
Resumen de PubMed | Texto completo cruzado/Google Académico
Murphy, D. B., and Davidson, M. W. (2012a). Microscopía de Escaneo Láser Confocal. Fundamentos de Microscopía de Luz e Imágenes Electrónicas, 2a Edn. Hoboken, NJ: John Wiley & Sons, 265-305. doi: 10.1002 / 9781118382905. ch13
Texto completo de CrossRef/Google Scholar
Murphy, D. B., and Davidson, M. W. (2012b). Microscopía de Fluorescencia. Fundamentos de Microscopía de Luz e Imágenes Electrónicas. Weinheim: John Wiley & Sons, 199-231. doi: 10.1002 / 9781118382905. ch11
Texto completo de CrossRef/Google Scholar
Murphy, D. B., and Davidson, M. W. (2012c). Fundamentos de Microscopía de Luz e Imágenes Electrónicas. Hoboken, NJ: John Wiley & Sons, 1-19. doi: 10.1002 / 9781118382905
Texto completo de CrossRef/Google Scholar
Murphy, D. B., and Davidson, M. W. (2012d). Microscopía de Polarización. Fundamentos de Microscopía de Luz e Imágenes Electrónicas. Hoboken, Nueva Jersey: John Wiley & Sons, 153-171. doi: 10.1002/9781118382905.ch9
CrossRef Texto Completo | Google Scholar
Muscariello, L., Rosso, F., Marino, G., Giordano, A., Barbarisi, M., Cafiero, G., et al. (2005). A critical overview of ESEM applications in the biological field. J. Cell. Fisiol. 205, 328–334. doi: 10.1002 / jcp.20444
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Nallamothu, R., Wood, G. C., Pattillo, C. B., Scott, R. C., Kiani, M. F., Moore, B. M., et al. (2006). Un sistema de administración de liposomas dirigidos a la vasculatura tumoral para combretastatina A4: diseño, caracterización y evaluación in vitro. AAPS PharmSciTech 7: E32. doi: 10.1208 / pt070232
Resumen de PubMed / Texto completo cruzado / Google Académico
Nirale, N. M., Vidhate, R. D., and Nagarsenker, M. S. (2009). Liposomas de propionato de fluticasona para el parto pulmonar. Indian J. Pharm. Sci. 71, 709–711.
Google Scholar
Orlova, E. V., Sherman, M. B., Chiu, W., Mowri, H., Smith, L. C., and Gotto, A. M. Jr. (1999). Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Forni, F., Fresta, M., and Vandelli, M. A. (2005). Microscopía de fuerza atómica y espectroscopia de correlación de fotones: dos técnicas para la caracterización rápida de liposomas. EUR. J. Pharm. Sci. 25, 81–89. doi: 10.1016 / j.ejps.2005.01.020
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Ruozi, B., Tosi, G., Leo, E., and Vandelli, M. A. (2007). Aplicación de microscopía de fuerza atómica para caracterizar liposomas como portadores de fármacos y genes. Talanta 73, 12-22. doi: 10.1016 / j. talanta.2007.03.031
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Ruozi, B., Tosi, G., Tonelli, M., Bondioli, L., Mucci, A., Forni, F., et al. (2009). Imágenes de fase AFM de muestras suaves hidratadas: una herramienta versátil para completar el estudio químico-físico de liposomas. J. Liposome Res. 19, 59-67. doi: 10.1080 / 08982100802584071
Resumen de PubMed / Texto completo cruzado / Google Académico
Sawant, R. R., and Torchilin, V. P. (2012). Desafíos en el desarrollo de terapias liposomales dirigidas. AAPS J. 14, 303-315. doi: 10.1208 / s12248-012-9330-0
Resumen de PubMed / Texto completo cruzado / Google Scholar
Senior, J. H. (1987). Destino y comportamiento de los liposomas in vivo: una revisión de los factores de control. Hematocrito. Reverendo Ther. Sistema Portador de Drogas. 3, 123–193.
Resumen de PubMed/Google Scholar
Sercombe, L., Veerati, T., Moheimani, F., Wu, S. Y., Sood, A. K., and Hua, S. (2015). Avances y desafíos de la administración asistida por liposomas. Delantero. Pharmacol. 6:286. doi: 10.3389 / fphar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
PubMed Abstract | CrossRef Texto Completo | Google Scholar
Torchilin, V. P. (1994). Inmunoliposomas e inmunoliposomas pegilados: posible uso para la administración dirigida de agentes de imagen. Inmunométodos 4, 244-258. doi: 10.1006 / immu.1994.1027
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Van Antwerpen, R., and Gilkey, J.C. (1994). La microscopía crioelectrónica revela una subestructura humana de lipoproteínas de baja densidad. J. Lipid Res. 35, 2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
Resumen de PubMed / Texto completo cruzado / Google Scholar
Willis, M., and Forssen, E. (1998). Liposomas dirigidos a ligandos. Drogas Avanzadas Deliv. Apo. 29, 249-271. doi: 10.1016 / S0169-409X(97)00083-5
Texto completo cruzado | Google Scholar
Zununi Vahed, S., Salehi, R., Davaran, S., and Sharifi, S. (2017). Sistemas de administración conjunta de fármacos basados en liposomas en células cancerosas. Mater. Sci. Ing. C Mater. Biol. Appl. 71, 1327–1341. doi: 10.1016 / j.mseg.2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply