Frontiers en Oncología
Introducción
Cerca de 25% de las pacientes de cáncer de mama temprano todavía experimentan recidiva local y presentan metástasis a distancia después del tratamiento activo (1), y casi 10% de las pacientes se encuentran en estadio IV en el momento del diagnóstico inicial en el mundo desarrollado, lo que se conoce como cáncer de mama metastásico de novo (CMM) (2). A pesar de los avances en el tratamiento, la CMM sigue siendo incurable y hasta el 70-80% de los pacientes con CMM mueren de cáncer en 5 años (2). Como resultado de la heterogeneidad de la CMM, se desarrollan múltiples modelos pronósticos basados en factores pronósticos o puntuaciones para predecir sus desenlaces clínicos y dirigir a los médicos a tomar decisiones terapéuticas adecuadas (3-5). Además, también hay una variedad de modelos pronósticos para el cáncer de mama con metástasis cerebral (BCBM) para que los médicos puedan predecir con precisión la supervivencia de estas pacientes (6, 7).
El cáncer de mama puede hacer metástasis en cualquier parte del cuerpo, pero principalmente en los pulmones, los huesos, el hígado, los ganglios linfáticos no axilares y el cerebro (8). En particular, la metástasis hepática (LM) no solo es un sitio metastásico común, sino que también se relaciona con un aumento significativo del riesgo de muerte similar a la metástasis cerebral, una mortalidad desproporcionadamente mayor en comparación con las metástasis pulmonares o óseas (5, 8). Dado que la evaluación pronóstica graduada (GPA) es ampliamente aceptada en pacientes con MBC, los modelos pronósticos mencionados anteriormente nos estimulan a proponer un modelo práctico para MBC (3-7). Nuestro objetivo era construir un modelo de pronóstico confiable y fácil de usar para el MCLB y evaluar su concordancia y precisión validándolo tanto interna como externamente. El modelo pronóstico podría ayudar a los médicos a estimar el riesgo de muerte de los pacientes con MBC y seleccionar el tratamiento óptimo.
Pacientes y métodos
Selección de Pacientes
El presente estudio fue aprobado por los comités de ética independientes de FUSCC. Se identificaron pacientes consecutivos de CMM diagnosticados en FUSCC desde enero de 2007 hasta diciembre de 2018 (n = 9.062). Los criterios de elegibilidad fueron los siguientes: (1) cáncer de mama confirmado histológicamente, (2) pacientes de sexo femenino, (3) el hígado como primer sitio de enfermedad metastásica en cáncer de mama de novo metastásico o recurrente, y (4) registros completos y detallados. Se excluyeron las pacientes con cáncer de mama bilateral, otras neoplasias invasivas o con seguimiento desconocido. Finalmente, se seleccionaron 1.022 pacientes elegibles para un análisis posterior. Los pasos completos de selección se muestran en la Figura S1.
Estudio de Variables y Selección de Valores de Corte
Se recogió información sobre las siguientes variables clinicopatológicas: edad, subtipos moleculares, información de tratamiento previo (cirugía y quimioterapia sistémica), IMF, sitios de metástasis extrahepáticas (cerebro, pulmón, hueso y ganglios linfáticos), características de la metástasis hepática (distribución, número, diámetro máximo), hemoglobina (HB), pruebas de función hepática y tiempo de supervivencia. Los subtipos moleculares incluyeron el estado del receptor hormonal (HR) y del receptor 2 del factor de crecimiento epidérmico humano (HER2). Se definió la IMF como el intervalo entre la fecha del diagnóstico de cáncer de mama primario y la fecha de la primera metástasis a distancia. Los puntos de corte de la IMF utilizados en este estudio fueron de 3 y 24 meses según la referencia (9). Por lo tanto, los pacientes se pueden dividir en tres grupos: pacientes con CMM de novo (IMF < 3 meses), pacientes con un IMF corto (≤ 24 meses) y pacientes con un IMF largo > 24 meses. La metástasis a ganglios linfáticos distantes se definió como metástasis de ganglios linfáticos axilares, supraclaviculares, infraclaviculares o mamarios internos ipsilaterales. El diagnóstico de ML se basó en la imagen radiográfica o evidencia patológica. Las características de la metástasis hepática se evaluaron con la ayuda de tomografía computarizada (TC) abdominal, imágenes por resonancia magnética (RM) o muestras de resección quirúrgica. En el presente estudio también se analizaron pruebas de función hepática, que incluyeron bilirrubina total, alanina aminotransferasa (ALT), aspartato aminotransferasa (AST), fosfatasa alcalina (ALP), lactato deshidrogenasa (LDH) y relación γ-glutamil transferasa a albúmina (GAR). Se tomaron muestras de sangre para análisis de laboratorio dentro de 1 semana después del diagnóstico de LM. Las clasificaciones de distribución, número o diámetro máximo de metástasis hepáticas y LDH se basaron en otros estudios (10-13). Los valores de corte para HB, bilirrubina total, ALT, AST y ALP se determinaron de acuerdo con los Criterios Terminológicos Comunes para Eventos Adversos (CTCAE) porque las anomalías moderadas o de grado II en los niveles de hemoglobina o la función hepática podrían influir en las opciones terapéuticas (14). El valor de GAR se definió como una relación simple entre el nivel de serumi-glutamil transferasa (GGT, U/L) y el nivel de albúmina sérica (ALB g/L). Se midió la SG desde el momento de la metástasis desde la fecha del diagnóstico de LM hasta la muerte por cualquier causa. El último período de seguimiento fue noviembre de 2019 con una mediana de tiempo de seguimiento de 18,63 meses. Si los pacientes se perdían en el seguimiento, se censuraba el último día de seguimiento.
Análisis estadístico
Los pacientes se dividieron en el entrenamiento (2007-2016, n = 715) y la validación (2016-2018, n = 307) en una relación de 7:3. El valor de corte óptimo para GAR se eligió mediante el cálculo del análisis del índice de Youden y de la curva característica de operación del receptor (ROC) (Figura S2). Se utilizó la prueba de chi cuadrado de Pearson o la prueba exacta de Fisher para hacer una comparación entre variables categóricas. Se utilizaron modelos de regresión de riesgos proporcionales de Cox con el método de selección hacia atrás para el análisis multivariado y para calcular los cocientes de riesgos. Los coeficientes de regresión se calcularon mediante análisis de regresión multivariante y luego se multiplicaron por 10 y se redondearon para representar los puntajes pronósticos finales. Se utilizó bootstrapping para la validación interna. A continuación, se utilizaron curvas ROC dependientes del tiempo y gráficos de calibración para evaluar la discriminación y calibración de este modelo pronóstico en el conjunto de validación. Los valores de corte de los grupos de riesgo se determinaron mediante gráficas X-tile (15). El análisis de supervivencia se realizó utilizando curvas de supervivencia de Kaplan-Meier y se utilizaron pruebas de rango logarítmico para comparar las curvas de supervivencia. Todos los valores de P fueron de dos lados, y los valores de P < 0,05 se consideraron estadísticamente significativos. El análisis estadístico se realizó con el software SPSS (SPSS 20, Chicago, IL, EE.UU.) y el software R versión 4.0.1.
Resultados
Características y Relación con la Estratificación de Riesgo
Un total de 1.022 pacientes seleccionados en este estudio se dividieron en conjuntos de entrenamiento (n = 715) y validación (n = 307). En la Tabla 1 y en la Tabla S1 se presenta una descripción de las características clinicopatológicas. En el grupo de entrenamiento, hubo 126 pacientes (17,6%) diagnosticados de CMM de novo y 589 pacientes (82,4%) con CMM recurrente, de los cuales 297 pacientes (50,4%) tenían un IMF corto y 292 pacientes (49,6%) tenían un IMF largo. La mediana de edad en el momento del diagnóstico de ML fue de 50 (rango 21-87) años con 617 pacientes (86).3%) menores de 60 años. De estos pacientes, la proporción de pacientes HR-positivos y HER2-positivos fue de 62,2 y 38,0%, respectivamente. Entre los pacientes con CMM recidivantes, casi todos los pacientes se sometieron a cirugía del tumor primario (584, 99,2%) y recibieron quimioterapia adyuvante (neo) (569, 96,6%). Los patrones de metástasis a distancia mostraron que el sitio más común de metástasis extrahepáticas fue el hueso (42,7%), seguido de los ganglios linfáticos distantes (36,1%), los pulmones (25,6%) y el cerebro (2,9%). La metástasis hepática se caracterizó por una distribución difusa y nódulos pequeños, la mayoría de los cuales eran múltiples (≥3 metástasis, 77,3%) pero nódulos pequeños (≤3 cm, 59,4%) y afectaron los lóbulos derecho e izquierdo (74,4%). En la etapa temprana de la LM, la función hepática se deterioró en diversos grados, pero generalmente fue leve. El aumento de LDH (36,1%) y GAR (35,9%) parecía ser un indicador de disfunción hepática sensible, y las anomalías moderadas o superiores en los niveles de HB (2,9%), bilirrubina total (2,7%), ALT (3,6%), AST (9,5%) y ALP (3,9%) eran poco frecuentes según el CTCAE. En comparación con el grupo de riesgo bajo, el grupo de riesgo intermedio y alto presentó una tasa más alta de negatividad de CRI y HER2, una IMF corta, metástasis extrahepáticas, carga tumoral de metástasis hepática y anomalías en las concentraciones de hemoglobina o la función hepática (todos los Ps ≤ 0,001), lo que indica que estos factores podrían afectar el pronóstico de la MCBB.
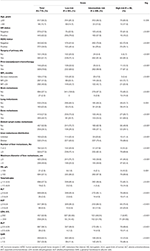
la Tabla 1. Características basales y su relación con la estratificación de riesgo del conjunto de entrenamiento.
Modelo pronóstico y validación
En el modelo multivariado de regresión de Cox, los subtipos moleculares (HR y estado HER2), la IMF, los sitios de metástasis extrahepáticas (metástasis encefálica, pulmonar y ósea) y las pruebas de función hepática (bilirrubina total, LDH y GAR) se relacionaron con la SG (Tabla 2). Específicamente, el riesgo de muerte de pacientes con FC negativo (HR 1,740, IC del 95% 1,424–2,127, P < 0,001) y HER2 negativo (HR 1,615, IC del 95% 1,316–1,983, P < 0,001) aumentó en comparación con FC o Contrapartes HER2 positivas. La duración de la MFI también tuvo un impacto significativo en la supervivencia de los pacientes con MCIB y, por lo tanto, la supervivencia de los pacientes con una MFI larga (HR 1,612, IC del 95%: 1,195–2,174, P < 0,001) se redujo en comparación con los pacientes con CMM de novo y los pacientes con una MFI corta (HR 2,563, IC del 95%: 1,904–3,449, P < 0,001) tuvieron más del doble de riesgo de muerte en relación con ellos. Además, la presencia de metástasis extrahepáticas (metástasis encefálica, pulmonar y ósea) y función hepática anormal (bilirrubina total, LDH y GAR) se correlacionaron con un impacto pronóstico desfavorable en la SG. Este modelo pronóstico tenía el área bajo la curva (AUC) de ROC dependiente del tiempo a 1 año de SG con 0,78 en el conjunto de entrenamiento y 0,80 en el conjunto de validación, lo que indica que este modelo tuvo una buena discriminación (Figura 1). Se utilizó el método de arranque para confirmar la estabilidad de nuestro modelo pronóstico en el set de entrenamiento, y los resultados finales fueron bastante sólidos (Tabla S2). Las curvas de calibración del modelo pronóstico para SG de 1 y 3 años en el conjunto de entrenamiento, así como para SG de 1 año en el conjunto de validación, mostraron una buena concordancia (Figura 2).

la Tabla 2. Modelo de regresión de Cox multivariado (Conjunto de entrenamiento).
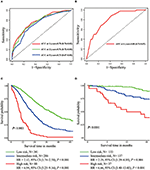
la Figura 1. Curvas ROC dependientes del tiempo del modelo pronóstico en el conjunto de entrenamiento (A) y el conjunto de validación (B). Supervivencia general a partir de metástasis de los tres grupos de pronóstico del conjunto de entrenamiento (C) y validación (D).
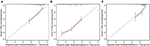
la Figura 2. Curva de calibración para predecir la supervivencia del paciente a 1 año (A) y 3 años (B) en el equipo de entrenamiento y a 1 año (C) en el equipo de validación.
la Estratificación del Riesgo y de Supervivencia

la Tabla 3. Cálculo de la puntuación y puntos de corte de los grupos pronósticos.
Discusión
En el presente análisis de 1.022 pacientes tratados en nuestra institución de 2007 a 2018, hemos demostrado que los subtipos moleculares (HR y estado HER2), IMF, sitios de metástasis extrahepáticas (metástasis cerebral, pulmonar y ósea), pruebas de función hepática (bilirrubina total, LDH y GAR) fueron factores pronósticos independientes de pacientes con MBC. Por lo tanto, se construyó un modelo pronóstico para pacientes con MCLB utilizando factores pronósticos.
Con respecto a los subtipos moleculares, la FC positiva puede indicar que el crecimiento y la proliferación del cáncer de mama todavía están regulados por hormonas, llamadas tumores dependientes de hormonas. Al mismo tiempo, la terapia endocrina tiene beneficios que incluyen pocas reacciones adversas y efectos duraderos, que a menudo pueden brindar beneficios de supervivencia a largo plazo a los pacientes con RH positivo. Por lo tanto, la FC positiva se ha considerado un factor significativo que sugiere un pronóstico favorable en el cáncer de mama temprano y metastásico(1, 3-5, 8-10, 16). Aunque se considera que la amplificación y sobreexpresión de HER2 es un factor predictivo del riesgo de metástasis a distancia y muerte relacionada con el cáncer de mama, los fármacos anti–HER2 desarrollados posteriormente han mejorado notablemente la supervivencia de las pacientes con cáncer de mama HER2 positivo (2, 9, 17). En la era de la terapia dirigida, un estudio en el sureste de los Países Bajos encontró que el riesgo de mortalidad de los pacientes con HER2 negativo aumentó en un 44% (IC 95%: 1,13-1,83, P = 0,003) en comparación con los pacientes con HER2 positivo (9). En nuestro estudio, el riesgo de muerte de los pacientes con FC negativo y HER2 negativo aumentó en comparación con las contrapartes con FC o HER2 positivo, de acuerdo con estas observaciones. Los pacientes con una IMF corta, definida generalmente como ≤24 meses, tuvieron un pronóstico más precario (3, 5, 9). Además, los pacientes con CMM de novo parecían tener un pronóstico significativamente mejor en comparación con los pacientes con CMM recidivantes, aunque esta diferencia se redujo gradualmente con la extensión del intervalo libre de enfermedad (IFD) o IFM (9, 18, 19). Lobbezoo et al. se encontró que los pacientes con IMF ≤24 meses tuvieron un tiempo de supervivencia significativamente más corto (9,1 vs.29.4 meses, P < 0,001) que aquellos con enfermedades en estadio IV de novo, pero los pacientes con una IMF más larga (>24 meses) tuvieron un pronóstico similar (27,9 vs.29,4 meses, P = 0,73) (9). La posible razón de este fenómeno es que los pacientes con CMM recidivante que se sometieron previamente a terapia sistemática pueden ser más resistentes a la quimioterapia que los pacientes sin tratamiento previo con CMM de novo, pero se justifica una investigación adicional (9, 18, 19). Este estudio confirmó que el tiempo de supervivencia de los pacientes con un IMF largo se redujo en comparación con el CMM de novo, con pacientes con un IMF corto que confirió un resultado significativamente peor.
La supervivencia de la CMM difirió significativamente según los sitios metastásicos y los pacientes con metástasis visceral se relacionaron con un mayor riesgo de mortalidad en comparación con aquellos con metástasis no visceral (3-5, 9, 18). Además, la presencia de metástasis cerebral tuvo un mayor impacto en la supervivencia que cualquier otro sitio metastásico(3, 5, 9, 18). No era de extrañar que las metástasis múltiples tuvieran una influencia más desfavorable en el pronóstico (3, 5, 9, 17, 18). En este análisis, la metástasis extrahepática, a excepción de la metástasis a ganglios linfáticos distantes, podría llevar a una supervivencia más corta, probablemente porque la metástasis hepática fue el factor crítico que puso en peligro la vida en comparación con la metástasis a ganglios linfáticos.
Cabe señalar que los pacientes con niveles más altos de bilirrubina tenían un riesgo mucho menor de padecer varias enfermedades, en parte por sus propiedades antioxidantes y antiinflamatorias (20). Un estudio reciente también informó que se mostró una reducción de casi el 40% del riesgo de muerte entre las pacientes de cáncer de mama temprano con un nivel total de bilirrubina más alto (21). Sin embargo, la hiperbilirrubinemia se asoció con mal pronóstico en los pacientes con MBC (22). Es posible que, a diferencia de la bilirrubina total relativamente más alta entre las pacientes con cáncer de mama no metastásico, una bilirrubina elevada 1,5 veces más que el límite superior normal (LSN) entre las pacientes con MCLB pueda predecir una lesión hepática grave y, por lo tanto, contribuir a la interrupción del medicamento o a la encefalopatía hepática.
El efecto Warburg hace que las células cancerosas dependan de la glucólisis aeróbica incluso cuando el suministro de oxígeno es suficiente, que es el sello distintivo del metabolismo del cáncer en contraste con los tejidos normales (23). La LDH desempeña un papel indispensable en la glucólisis debido a su capacidad de convertir piruvato en lactato durante condiciones anaeróbicas (24). Los niveles desregulados de LDH podrían reflejar una carga tumoral más alta, una respuesta al tratamiento más precaria y un pronóstico, que se habían notificado previamente en tumores múltiples (21, 24-26). En un metanálisis sobre el efecto pronóstico de la LDH en pacientes de cáncer de mama, se observó que las concentraciones más altas de LDH resultaron en una SG insatisfactoria y una supervivencia sin progresión, que incluyó 11 estudios con 6102 pacientes (27).
El GGT, el principal antioxidante endógeno, asimila aminoácidos precursores e interviene en la síntesis de glutatión (28). La GGT en tumores permite a las células reponer rápidamente el glutatión después de recibir terapia anticancerígena prooxidante y, por lo tanto, se correlaciona con la resistencia a los medicamentos y la supervivencia deficiente (29). Curiosamente, Fentiman et al. se informó de que se identificó una relación significativamente positiva entre el GGT elevado y el riesgo de cáncer de mama (30). El ALB sintetizado por el hígado funciona como antioxidante, transportador de nutrientes y participa en las vías de señal debido a sus propiedades estructurales únicas (31). La hipoalbuminemia, por lo general, se presenta en pacientes con cáncer avanzado y se atribuye a diversos mecanismos, como deterioro de la síntesis hepática, aumento del catabolismo y caquexia (21, 31). La hipoalbuminemia es un indicador independiente de mal pronóstico de varios tumores (21, 22, 32, 33). A diferencia de la disminución de los niveles séricos de albúmina, los niveles séricos de GGT tienden a elevarse cuando la función hepática está alterada. Por lo tanto, la GAR basada en los dos parámetros anteriores puede tener la ventaja de reflejar la capacidad de reserva hepática y predecir el pronóstico (32, 33). En el estudio actual, la función hepática anormal (bilirrubina total, LDH y GAR) se correlacionó con un impacto pronóstico desfavorable en la SG.
Después de analizar el pronóstico de 123 pacientes con MCLB, Duan et al. se encontró que los pacientes con tres o más metástasis hepáticas tenían 2.26 veces mayor riesgo de muerte en relación con los pacientes con < 3 metástasis hepáticas en análisis multivariado (10). Sin embargo, las características de la metástasis hepática en este estudio parecían no hacer ninguna diferencia. Hay dos posibles razones que contribuyen a esta discrepancia. En primer lugar, la distribución, el número y el diámetro máximo de las metástasis hepáticas fueron significativamente diferentes en los tres grupos de riesgo, lo que indica que el riesgo de mortalidad aumentó con la expansión de la metástasis hepática en el análisis univariado. Posteriormente, la función hepática anormal se relacionó estrechamente con la carga tumoral de metástasis hepática, ajustando la función de estos factores en el análisis multivariado.
Se han realizado muchos estudios sobre factores pronósticos en el entorno de la MCBL. Un análisis de 145 pacientes con MCLB mostró que la hipoalbuminemia, la edad avanzada y la negatividad de la sala de emergencias eran predictores independientes de mala supervivencia (22). Un análisis del registro griego obtuvo resultados similares, en los que la positividad de la FC, el bajo grado histológico, la ausencia de metástasis extrahepáticas y el buen estado funcional fueron factores pronósticos significativos para un pronóstico favorable en el análisis univariado (34). En un estudio poblacional reciente en el que participaron más de 4000 pacientes con MCLB de novo, se identificaron factores demográficos y socioeconómicos, grado patológico, número total de metástasis extrahepáticas, tratamiento y subtipo molecular como parámetros que influyen significativamente en la supervivencia general (17). Regierer et al. se elaboró un puntaje pronóstico para la CMM basado en el estado de la FC, la IMF y los sitios de metástasis para predecir su pronóstico e individualizar el tratamiento óptimo, que se validó interna y externamente (5). Desafortunadamente, el estado HER2 no se incluyó en el puntaje pronóstico y, por lo tanto, limitó su aplicabilidad. La GPA de mama modificada para pacientes con MBC que integraba cuatro parámetros clínicos simples tuvo un papel inmediato en la predicción de su supervivencia, pero no fue aplicable para pacientes con MBC (7). Hasta donde sabemos, no existe un modelo pronóstico que integre estos factores pronósticos para los pacientes con MCLB, por lo que nuestro modelo tiene sentido pragmático.
También hubo algunas limitaciones en esta investigación. En primer lugar, un estudio retrospectivo de un solo centro resultó inevitablemente en un sesgo de selección, aunque nuestro modelo pronóstico fue validado interna y externamente. En segundo lugar, se excluyó a los pacientes que desarrollaron metástasis hepática más adelante en el curso de la enfermedad, por lo que no pudimos evaluar a estos pacientes. En tercer lugar, en este estudio no se disponía de información detallada sobre el estado funcional y el tratamiento.
Conclusiones
A pesar de estas limitaciones, esta investigación puede proporcionar un modelo pronóstico simple y confiable. La principal ventaja de nuestro estudio es la incorporación de parámetros de fácil acceso en la práctica clínica a partir de la gran muestra de pacientes con MBC. Además de una clasificación exquisita de los tumores de acuerdo con los métodos de secuenciación de próxima generación, nuestro modelo puede ayudar a identificar subgrupos con diferentes pronósticos y guiar el tratamiento posterior.
Declaración de Disponibilidad de Datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material Complementario, las consultas adicionales pueden dirigirse al autor/es correspondiente.
Declaración de ética
El presente estudio fue aprobado por los comités de ética independientes de FUSCC. Los pacientes / participantes proporcionaron su consentimiento informado por escrito para participar en este estudio.
Contribuciones de los autores
LJ propuso el estudio. XZ e YG recopilaron los datos. LJ y LF analizaron los datos y escribieron el primer borrador. ZW revisó críticamente el manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Conflicto de Intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un conflicto de intereses potencial.
Agradecimientos
Agradecemos a Lei Cheng por realizar análisis de datos.
Material suplementario
Abreviaturas
BCLM, cáncer de mama con metástasis hepática; FUSCC, Centro Oncológico de Shanghái de la Universidad de Fudan; ALP: aspartato aminotransferasa; MCM: cáncer de mama metastásico con metástasis cerebral; IC: intervalo de confianza; FC: razón de riesgos; FC: evaluación pronóstica graduada; MCM: cáncer de mama metastásico; MCB: cáncer de mama con metástasis cerebral; HB: hemoglobina; FC: receptor hormonal; HER2: receptor 2 del factor de crecimiento epidérmico humano; RM: imágenes por resonancia magnética; ALP: alanina aminotransferasa; AST: aspartato aminotransferasa fosfatasa alcalina; LDH, lactato deshidrogenasa; GAR, relación γ-glutamil transferasa a albúmina; GGT: γ-glutamil transferasa; ALB: albúmina; CTCAE: Criterios Terminológicos Comunes para Eventos Adversos; LSN: límite superior de la normalidad.
4. Puente J, López-Tarruella S, Ruiz A, Lluch A, Pastor M, Alba E, et al. Índice de pronóstico práctico para pacientes con cáncer de mama recidivante metastásico: análisis retrospectivo de 2.322 pacientes del Registro GEICAM Español de El Álamo. Tratamiento para el Cáncer de Mama. (2010) 122:591–600. doi: 10.1007/s10549–009-0687–4
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Regierer AC, Wolters R, Ufen MP, Weigel A, Novopashenny I, Kohne CH, et al. An internally and externally validated prognostic score for metastatic breast cancer: analysis of 2269 patients. Ann Oncol. (2014) 25:633–8. doi: 10.1093/annonc/mdt539
PubMed Abstract | CrossRef Full Text
6. Marko NF, Xu Z, Gao T, Kattan MW, Weil RJ. Predicción de la supervivencia en mujeres con cáncer de mama y metástasis cerebral: un nomograma supera a los modelos actuales de predicción de supervivencia. Cancer. (2012) 118:3749–57. doi: 10.1002 / cncr.26716
PubMed Abstract | CrossRef Texto Completo | Google Scholar
7. Subbiah IM, Lei X, Weinberg JS, Sulman EP, Chavez-MacGregor M, Tripathy D, et al. Validación y desarrollo de una evaluación de pronóstico con graduación de mama modificada como herramienta para la supervivencia en pacientes con cáncer de mama y metástasis cerebrales. J Clin Oncol. (2015) 33:2239–45. doi: 10.1200 / JCO.2014.58.8517
PubMed Abstract | CrossRef Texto Completo | Google Scholar
9. Lobbezoo DJ, van Kampen RJ, Voogd AC, Dercksen MW, van den Berkmortel F, Smilde TJ, et al. Pronóstico del cáncer de mama metastásico: ¿hay diferencias entre las pacientes con cáncer de mama metastásico de novo y recidivante? Br J Cancer. (2015) 112:1445–51. doi: 10.1038/bjc.2015.127
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Duan XF, Dong NN, Zhang T, Li Q. The prognostic analysis of clinical breast cancer subtypes among patients with liver metastases from breast cancer. Int J Clin Oncol. (2013) 18:26–32. doi: 10.1007/s10147–011-0336-x
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dueck AC, Mendoza TR, Mitchell SA, Reeve BB, Castro KM, Rogak LJ, et al. Validez y Fiabilidad de la Versión de Resultados Notificados por pacientes del Instituto Nacional del Cáncer de los Estados Unidos de los Criterios Terminológicos Comunes para Eventos Adversos (PRO-CTCAE). JAMA Oncol. (2015) 1:1051–9. doi: 10.1001 / jamaoncol.2015.2639
PubMed Abstract | CrossRef Texto Completo | Google Scholar
17. Xie J, Xu Z. Estudio Poblacional de Metástasis Hepáticas en Mujeres con Cáncer de Mama recién Diagnosticado. Cancer Epidemiol Biomarkers Prev. (2019) 28:283–92. doi: 10.1158/1055–9965.EPI-18–0591
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dawood S, Broglio K, Ensor J, Hortobagyi GN, Giordano SH. Survival differences among women with de novo stage IV and relapsed breast cancer. Ann Oncol. (2010) 21:2169–74. doi: 10.1093/annonc/mdq220
PubMed Abstract | CrossRef Full Text
19. den Brok WD, Speers CH, Gondara L, Baxter E, Tyldesley SK, Lohrisch CA. Supervivencia con cáncer de mama metastásico según la presentación inicial, de novo versus recidivante. Tratamiento para el Cáncer de Mama. (2017) 161:549–56. doi: 10.1007/s10549–016-4080–9
PubMed Abstract | CrossRef Texto Completo | Google Scholar
20. Fujiwara R, Haag M, Schaeffeler E, Nies AT, Zanger UM, Schwab M. Regulación sistémica de la homeostasis de la bilirrubina: beneficios potenciales de la hiperbilirrubinemia. Hepatología. (2018) 67:1609–19. doi: 10.1002/hep.29599
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Liu X, Meng QH, Ye Y, Hildebrandt MAT, Gu J, Wu X. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer. Carcinogenesis. (2015) 36:243–8. doi: 10.1093/carcin/bgu247
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect: the metabolic requirements of cell proliferation (en inglés). Ciencia. (2009) 324:1029–33. doi: 10.1126 / ciencia.1160809
PubMed Abstract | CrossRef Texto Completo | Google Scholar
24. Mishra D, Banerjee D. Lactato deshidrogenasas como enlaces metabólicos entre el tumor y el estroma en el microambiente tumoral. Cancer. (2019) 11:750. doi: 10.3390/cancers11060750
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Pelizzari G, Basile D, Zago S, Lisanti C, Bartoletti M, Bortot L, et al. Lactate dehydrogenase (ldh) response to first-line treatment predicts survival in metastatic breast cancer: first clues for a cost-effective and dynamic biomarker. Cancers. (2019) 11:1243. doi: 10.3390/cancers11091243
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Hopkins AM, Rowland A, McKinnon RA, Sorich MJ. Predictors of long-term disease control and survival for HER2-positive advanced breast cancer patients treated with pertuzumab, trastuzumab, and docetaxel. Front Oncol. (2019) 9:789. doi: 10.3389/fonc.2019.00789
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Pentheroudakis G, Fountzilas G, Bafaloukos D, Koutsoukou V, Pectasides D, Skarlos D, et al. Cáncer de mama metastásico con metástasis hepáticas: un análisis de registro de las características clinicopatológicas, de manejo y de desenlace de 500 mujeres. Tratamiento para el Cáncer de Mama. (2006) 97:237–44. doi: 10.1007 / s10549–005-9117–4
Resumen de PubMed / Texto completo cruzado / Google Scholar
Leave a Reply