Latencia viral: Baja pero no baja
Cuando imaginas que los virus se esconden de tu sistema inmunitario, puedes pensar en el virus del herpes simple, responsable del herpes labial y el herpes genital, o el virus de la varicela-zóster, que causa el herpes zóster. Estos virus pueden persistir durante décadas en un estado similar a la hibernación conocido como latencia y evitar la detección por parte de nuestro sistema inmunitario (Kennedy et al., 2015). Los virus latentes a veces pueden despertar y comenzar a replicarse una vez más, causando síntomas y propagando la infección (Lieberman, 2016).
El virus de inmunodeficiencia humana (VIH) es de manera similar un artista maestro del escape. Forma un reservorio latente al principio de la infección, lo que permite que el virus evada el sistema inmunitario y sobreviva a largo plazo. Las personas que viven con el VIH toman medicamentos diarios conocidos como terapia antirretroviral combinada (o TAR) para evitar que el virus se reproduzca. Sin embargo, el tratamiento antirretroviral no es una cura, ya que no se dirige a virus que ya están latentes. Por lo tanto, estos medicamentos se administran durante toda la vida de un individuo: la interrupción del tratamiento, incluso durante unas pocas semanas, permitirá que los virus latentes se reactiven y reaviven la infección activa. Las personas con VIH pueden esperar tener una vida larga y saludable debido al tratamiento antirretroviral, pero los virus latentes siempre estarán presentes en su cuerpo.
Encontrar una cura para el VIH requiere ser capaz de eliminar o controlar el reservorio viral latente. Sin embargo, todavía es necesario abordar algunas cuestiones clave para lograr este objetivo. ¿Cómo, cuándo y dónde establece el VIH la latencia? ¿Cuál es el tamaño del reservorio latente y la mejor manera de medirlo? ¿Qué desencadena la reactivación de los virus latentes? Ahora, en eLife, Miles Davenport, Brandon Keele y colegas de la Universidad de Nueva Gales del Sur y el Laboratorio Nacional Frederick para la Investigación del Cáncer, incluido Mykola Pinkevych como primer autor, informan cuándo se establece el reservorio latente en un modelo de primates no humanos del VIH y cuánto del reservorio puede reactivarse (Pinkevych et al., 2019).
En este estudio, el equipo infectó a los macacos rhesus con el virus de inmunodeficiencia simia (VSI), un virus precursor endémico en monos africanos y genéticamente similar al VIH (Williams y Burdo, 2009). En algún momento durante el siglo XX, SIV saltó de primates no humanos a humanos; este evento de transmisión entre especies, junto con una rápida evolución, permitió que el virus se propagara de manera eficiente en las personas y creara la pandemia del VIH en curso (Keele et al., 2006).
Pinkevych et al. comenzó infectando macacos rhesus con un SIV diseñado que contiene más de 10,000 secuencias aleatorias únicas de ADN; una vez secuenciadas, estos «códigos de barras» permiten identificar virus individuales (Fennessey et al., 2017). Los monos fueron tratados con terapia antirretroviral 4, 10 ó 27 días después de la infección. Estos intervalos simulan intervenciones agudas (4 días), tempranas (10 días) o tardías (27 días) con ART en humanos. Los medicamentos se administraron durante aproximadamente un año, y el virus se suprimió por completo en todos los animales. El tratamiento se interrumpió y se permitió que el virus latente se reactivara. Mediante secuenciación genética y modelado matemático, el equipo determinó el tamaño del reservorio latente de VSI y cómo se reactivaría.
En los monos, el inicio del tratamiento cuatro días después de la infección no bloqueó la formación del reservorio latente, pero redujo su tamaño en aproximadamente 100 veces en comparación con el inicio posterior de la terapia antirretroviral. De manera similar, las personas que comienzan el tratamiento antirretroviral a los pocos días de adquirir el VIH tienen un reservorio extremadamente pequeño en comparación con las que comienzan el tratamiento más tarde (Luzuriaga et al., 2015; Henrich et al., 2017). A pesar de estas grandes diferencias en el tamaño general del reservorio, una vez que se detuvo la terapia antirretroviral, los virus latentes se reactivaron a tasas similares en animales tratados de forma aguda, temprana y tardía (Figura 1). Pinkevych et al. por lo tanto, concluye que la mayoría de los virus que tienen el potencial de reactivarse están estableciendo latencia al principio de la infección.
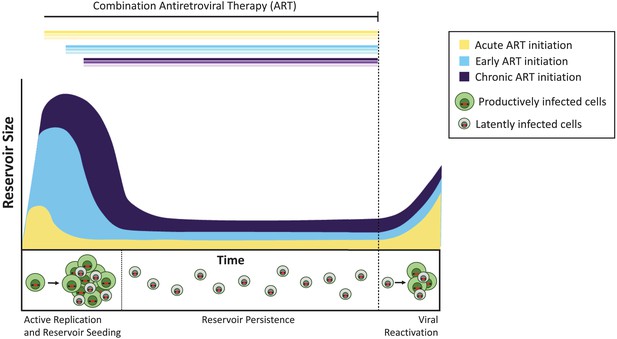
El tiempo de la terapia antirretroviral influye en el tamaño del reservorio latente.
Sin tratamiento, las células infectadas con virus que se replican activamente (células infectadas productivamente; se muestran en verde) crean virus infecciosos. Una minoría de células infectadas contienen virus que pueden persistir indefinidamente como reservorio latente (células infectadas latentemente; se muestran en gris), y estos virus pueden reactivarse potencialmente en una fecha posterior. El tratamiento administrado durante la fase aguda de la infección (es decir, a los pocos días o semanas de la infección primaria; curva amarilla) produce un reservorio latente más pequeño que cuando el tratamiento se inicia temprano (a los seis meses de la infección, azul claro) o durante la infección crónica (a más de 6 meses de la infección, violeta). Si se interrumpe el tratamiento (línea discontinua), el virus se reactiva de estos reservorios a niveles similares para reavivar la infección activa y volver a sembrar el reservorio latente.
Para explorar por qué el momento del tratamiento no parecía influir en la tasa de reactivación, el equipo midió el nivel de mutaciones genéticas en los virus latentes. Si los virus acumulan mutaciones más dañinas cuanto más tiempo se replican activamente en el cuerpo, esto sugeriría que los animales que reciben TARV retardados podrían llevar una mayor proporción de virus latentes que son defectuosos y no pueden despertarse. Sin embargo, el equipo encontró que la mayoría de los virus (más del 80%) estaban genéticamente intactos en todos los animales, independientemente de cuándo comenzó el tratamiento. Esto es muy diferente a lo que sucede con la infección por el VIH en los seres humanos, donde la mayoría de los virus latentes contienen mutaciones y eliminaciones genéticas importantes, dejando solo una pequeña fracción (entre el 2% y el 11%) que son capaces de reactivarse (Ho et al., 2013; Bruner et al., 2019).
Un estudio reciente, que evaluó la dinámica del reservorio del VIH en personas con TAR estable, identificó otra discrepancia entre este modelo de VSI y la latencia del VIH en humanos. A pesar de la terapia antirretroviral en curso, el VIH latente a veces puede reactivarse espontáneamente y los virus se detectan en la sangre durante un corto período de tiempo. En los seres humanos, estos «blips» virales están filogenéticamente vinculados a un reservorio viral establecido no solo en la infección inicial, sino a lo largo de años de infección no tratada (Jones et al., 2018). Las razones subyacentes a estas diferencias no se comprenden bien y representan áreas importantes para la investigación en curso.
A pesar de las diferencias entre los modelos de primates no humanos y la infección por VIH en humanos, el trabajo de Pinkevych et al. confirma que la latencia viral se establece muy pronto después de la infección. Estos resultados indican que el tratamiento antirretroviral debe iniciarse lo antes posible para controlar la infección por VIH y reducir el tamaño del reservorio latente. Todavía se desconoce mucho sobre cómo se establece y mantiene la latencia del VIH, especialmente bajo tratamiento; sin embargo, los modelos de VSI seguirán siendo una herramienta importante para comprender cómo erradicar el reservorio latente.
Leave a Reply