Noticias-Leucemia congénita después de un fuerte abuso de aerosol de permetrina durante el embarazo

REPORTE DE UN CASO
Leucemia congénita después de un fuerte abuso de aerosol de permetrina durante el embarazo
A Borkhardt, M Wilda, U Fuchs, L Gortner y yo Reiss
Hospital Universitario Infantil Giessen, Feulgenstr 12, 35392 Giessen, Alemania
Correspondencia a:
Dr. Borkhardt, Hematología y Oncología Pediátrica, Feulgenstr 12, 35392 Giessen, Alemania; arndt.pediatría de borkhardt.Mediterráneo.uni-giessen.de
Aceptado el 6 de octubre de 2002
RESUMEN
Se describe un solo caso de leucemia congénita con reordenamiento de 11q23 / MLL en una recién nacida pretérmino. Debido a la aracnofobia, la madre había abusado en gran medida de la permetrina en aerosol, un insecticida doméstico ampliamente utilizado. La permetrina se considera comparativamente segura, pero, en vista de la historia de la madre, se probó su potencial para inducir la escisión del gen MLL en cultivos celulares. La incubación de la línea celular BV173 con permetrina de 50 µM indujo fácilmente la escisión de MLL.
Palabras clave: leucemia congénita; leucemia; permetrina; insecticida; 11q23/MLL
La leucemia congénita es una enfermedad rara que afecta a aproximadamente un niño de cada 200 000 a 250 000 nacidos vivos al año. A pesar de su rareza, la leucemia congénita ha estimulado mucho interés debido a la oportunidad de aprender más sobre las causas subyacentes de la leucemogénesis intrauterina. Hay muchos factores de riesgo que pueden aumentar la probabilidad de inducción temprana de un fenotipo leucémico, por ejemplo, la exposición de los padres a toxinas ocupacionales y ambientales, el uso de tabaco, marihuana, alcohol y otras toxinas.1 La leucemia congénita y del lactante a menudo se relaciona con reordenamientos del gen MLL en el cromosoma 11q23.2 Se han examinado varias sustancias para determinar su potencial de cruzar la barrera placentaria e inducir tal ruptura cromosómica en el cromosoma 11q23/MLL.3,4
Aquí ampliamos la lista de fármacos capaces de escindir el gen MLL, al menos cuando las células se exponen en cultivo. Junto con una historia clínica bastante inusual, nuestros datos experimentales arrojan algo de luz sobre la generación de leucemia congénita y pueden ayudar a prevenir algunos de los casos mortales de esta enfermedad.
REPORTE DE UN CASO
Una mujer sana de 27 años de edad fue ingresada en el departamento de ginecología debido a un parto prematuro. Estaba en la semana 35 de su primer embarazo. Los chequeos prenatales habían sido normales. Como el cardiotocograma no mostró ritmo cardíaco fetal, se planificó una cesárea de emergencia. Sin embargo, seis minutos más tarde, la mujer dio a luz espontáneamente a un bebé prematuro que pesaba 2300 g y no mostraba signos vitales, sino un llamativo color lívido de la piel. La reanimación cardiopulmonar primaria se inició inmediatamente con intubación endotraqueal, compresión torácica y administración repetitiva de adrenalina. Sin embargo, la puntuación de Apgar se mantuvo 0 después de cinco y 10 minutos. El equipo de emergencias pediátricas llegó 10 minutos después y continuó realizando reanimación cardiopulmonar. Se obtuvo una vía central mediante cateterismo de la vena umbilical. A los 25 minutos después del parto, se estableció una circulación estable, con una frecuencia cardíaca de 140 latidos / min. Un examen físico mostró hepatomegalia de 5 cm por debajo del margen costal e infiltraciones lívidas nodulares de la piel (figura 1A a continuación).
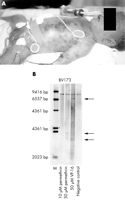 |
Figura 1 (a) El paciente a las 2 horas de edad. Tenga en cuenta la infiltración leucémica de la piel («manchas de arándanos»). B) Mancha sur que muestra un reordenamiento de MLL en la línea celular BV173 incubada con permetrina de 50 µM durante seis horas. Se utilizó como control la escisión de MLL inducida por VP16. |
Aparte de la anatomía normal del corazón, la ecografía mostró hipertensión pulmonar sustancial combinada con insuficiencia de segundo a tercer grado de la válvula tricúspide. Además de hepatomegalia, se encontró hemorragia intracraneal bilateral. Para una oxigenación y eliminación de dióxido de carbono suficientes, se necesitó ventilación de alta frecuencia con 10 Hz, FIO2 = 1, y una presión media en la vía aérea de 13 cm H2O. El recuento inicial de glóbulos blancos fue de 400 000/µl con exceso de blastos mieloides. El examen de la médula ósea confirmó el diagnóstico de leucemia mieloide aguda congénita, con 95% de células blásticas de morfología mielomonocítica (FAB-M5). Se realizó un intercambio sanguíneo completo, que redujo el recuento de glóbulos blancos a 56 000 / µl y resultó en una mejora de la oxigenación y la ventilación. Doce horas después, el recuento de glóbulos blancos había vuelto a aumentar, a 125 000 / µl. Se consideró la oxigenación de la membrana extracorpórea, pero finalmente se rechazó debido a la hemorragia intracraneal progresiva que involucraba una gran área del parénquima. El bebé murió 48 horas después del nacimiento de un fallo multiorgánico. Aparte del daño cerebral severo ya diagnosticado por ultrasonido, la autopsia mostró infiltración difusa de pulmones, hígado, bazo y cutis.
EXPERIMENTOS DE CULTIVO CELULAR: INDUCCIÓN DE REORDENAMIENTOS DE MLL POR PERMETRINA
El ensayo experimental se realizó exactamente como lo describió Strick et al3, quienes analizaron una amplia gama de sustancias naturales en alimentos y suplementos dietéticos para determinar su capacidad de inducir la escisión en un sitio específico dentro del gen MLL.
RESULTADOS Y DISCUSIÓN
El análisis citogenético del aspirado de médula ósea mostró la presencia de una translocación t (11; 19)(q23; p13) en todas las metafases analizadas. Además, se demostró un reordenamiento del oncogén MLL en el cromosoma 11q23 mediante un blot sureño. El inmunofenotipado de rutina mostró expresión de CD15, CD33, CD 65s y MPO (datos no mostrados). En estudios previos, el anticuerpo monoclonal 7.1 surgió como una valiosa herramienta inmunofenotípica para la detección de células leucémicas, con expresión de antígeno NG2 que se correlaciona fuertemente con los reordenamientos de MLL en bebés.5,6 En nuestro caso, sin embargo, la tinción con este anticuerpo monoclonal siguió siendo negativa, lo que nos impidió realizar más experimentos de clasificación celular.
La madre aparentemente había sufrido de aracnofobia desde la primera infancia. Dos años antes de su embarazo, comenzó a usar en exceso permetrina en aerosol. Desde entonces, había vivido sola. La gente evitaba visitarla debido al olor penetrante en su casa. La permetrina es un insecticida doméstico ampliamente utilizado que proporciona protección contra el vector anófeles de la malaria.7,8 También se sabe que es un medicamento eficaz contra la sarna y la pediculosis capitis del piojo de la cabeza.9,10 En comparación con otros medicamentos, se considera seguro y se recomienda su uso tópico incluso para neonatos con sarna.11 Sin embargo, se ha relacionado con la generación de aberraciones cromosómicas en células de médula ósea de ratones y lesiones de ADN en linfocitos humanos.12-14 Por lo tanto, planteamos la hipótesis de que la permetrina cruzó la placenta de la mujer embarazada y afectó a las células precursoras hematopoyéticas en el feto en desarrollo, lo que resultó en leucemogénesis. Por lo tanto, intentamos generar los reordenamientos dentro del oncogén MLL in vitro exponiendo las células BV173 a permetrina de 50 µM. Después de 24 horas de exposición, las células BV173 tratadas con permetrina mostraron un reordenamiento claro de MLL, mientras que las células no tratadas solo mostraron el gen MLL de tipo salvaje (figura 1B anterior). Por lo tanto, recomendamos encarecidamente una gran precaución en el uso de permetrina durante el embarazo. Incluso si no se pueden extraer conclusiones definitivas de un solo caso aislado, nuestros datos sugieren firmemente que la permetrina puede tener efectos secundarios graves cuando las células precursoras hematopoyéticas fetales se exponen en el útero. En el mismo sentido, un informe reciente de una colaboración multinacional indicó que el uso de medicamentos mosquiticidas durante el embarazo está significativamente asociado con la leucemia infantil.4 Es especialmente notable que los autores encontraron esta asociación solo para los casos reordenados de MLL y no para los casos de la línea germinal de MLL. Esto argumenta fuertemente en contra del sesgo de selección en su estudio de casos y controles y apoya la hipótesis de que la exposición intrauterina causa los reordenamientos de MLL.
Finalmente, la madre en nuestro caso fue tratada con éxito por aracnofobia mediante psicoterapia. Dos años más tarde, dio a luz a un niño sano que no tenía signos clínicos de leucemia y que todavía está sano a la edad de 13 meses.
AGRADECIMIENTOS
Se agradece la asistencia técnica experta de Claudia Keller y Stefanie Garkisch. Agradecemos a Jochen Harbott, Giessen, Alemania, por proporcionarnos los datos citogenéticos. Los datos inmunofenotípicos fueron proporcionados amablemente por W-D Ludwig, Centro Oncológico Robert Rössle, Universidad Humboldt, Berlín, Alemania. Los estudios moleculares fueron apoyados por la Fundación Alemana contra el Cáncer (subvención 10-1658-Bo2).
- Sande JE, Arceci RJ, Lampkin BC. Leucemia congénita y neonatal. Semin Perinatol 1999; 23: 274-85.
- Ford AM, Ridge SA, Cabrera ME, et al. Reordenamientos intrauterinos en el oncogén relacionado con el tritórax en leucemias infantiles. Nature 1993;363:358–60.
- Strick R, Strissel PL, Borgers S, et al. Los bioflavonoides dietéticos inducen escisión en el gen MLL y pueden contribuir a la leucemia infantil. Proc Natl Acad Sci USA 2000; 97: 4790-5.
- Alexander FE, Patheal SL, Biondi A, et al. Exposición a químicos transplacentarios y riesgo de leucemia infantil con fusión del gen MLL. Cancer Res 2001; 61: 2542-6.
- Smith FO, Rauch C, Williams DE, et al. El homólogo humano de NG2 de rata, un proteoglicano sulfato de condroitina, no se expresa en la superficie celular de las células hematopoyéticas normales, sino que se expresa en blastos de leucemia mieloide aguda de pacientes de pronóstico precario con anomalías de la banda cromosómica 11q23. Blood 1996; 87: 1123-33.
- Behm FG, Smith FO, Raimondi SC, et al. El homólogo humano del proteoglicano sulfato de condroitina de rata, NG2, detectado por el anticuerpo monoclonal 7.1, identifica leucemias linfoblásticas agudas infantiles con reordenamientos del gen t(4;11)(q21;q23) o t(11;19)(q23;p13) y MLL. Blood 1996; 87: 1134-9.
- Rowland M, Durrani N, Hewitt S, et al. Chaddars y hojas superiores tratados con permetrina: tecnología apropiada para la protección contra la malaria en Afganistán y otras emergencias complejas. Trans R Soc Trop Med Hyg 1999; 93: 465-72.
- Binka FN, Mensah OA, Mills A. The cost-effectiveness of permetrin impregnated bednets in preventing child mortality in Kassena-Nankana district of Northern Ghana. Health Policy 1997; 41:229-39.
- Blanshard ME, Schofield J. Scabies: a practical approach. Prof Care Mother Child 1999; 9:15-16.
- Dodd CS. Intervenciones para el tratamiento de los piojos. Cochrane Database Syst Rev 2000; CD001165.
- Quarterman MJ, Lesher JL, Jr. Sarna neonatal tratada con crema de permetrina al 5%. Pediatr Dermatol 1994; 11: 264-6.
- Cantalamessa F. Toxicidad aguda de dos piretroides, permetrina y cipermetrina en ratas recién nacidas y adultas. Arch Toxicol 1993; 67: 510-13.
- Barrueco C, Herrera A, Caballo C, et al. Inducción de aberraciones cromosómicas estructurales en cultivos de linfocitos humanos y células CHO por permetrina. Teratog Carcinog Mutagen 1994; 14: 31-8.
- Santoni G, Cantalamessa F, Spreghini E, et al. Alteraciones de la distribución y funciones de las células T en ratas expuestas a cipermetrina prenatalmente: posible implicación de catecolaminas. Toxicology 1999; 138: 175-87.
Leave a Reply