Pomada de propionato de Halobetasol
Forma de dosificación:pomada
Revisado médicamente por Drugs.com. Actualizado por última vez el 1 de marzo de 2020.
- Visión general
- Efectos Secundarios
- Dosis
- Profesional
- Interacciones
- Más
Halobetasol Propionato Unguento Descripción
Halobetasol Propionato Unguento, 0.05% contiene halobetasol propionato, una síntesis de corticosteroides de uso tópico uso dermatológico. Los corticosteroides constituyen una clase de esteroides principalmente sintéticos utilizados tópicamente como agentes antiinflamatorios y antipruriginosos.
El propionato de halobetasol químicamente es 21-cloro-6α, 9-difluoro-11β, 17-dihidroxi-16β-metilpregna-1, 4-dieno-3-20-diona, 17-propionato, C25H31ClF2O5. Tiene la siguiente fórmula estructural:
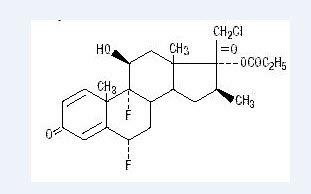
El propionato de halobetasol tiene un peso molecular de 485. Es un polvo cristalino blanco insoluble en agua.
Cada gramo de Pomada de Propionato de Halobetasol contiene 0.5 mg/g de propionato de halobetasol en una base de estearato de aluminio, cera de abeja, cocoato de pentaeritritol, vaselina, propilenglicol, sesquioleato de sorbitano y citrato de estearilo.Pomada de propionato de halobetasol – Farmacología clínica
Al igual que otros corticosteroides tópicos, el propionato de halobetasol tiene acciones antiinflamatorias, antipruriginosas y vasoconstrictoras. El mecanismo de la actividad antiinflamatoria de los corticosteroides tópicos, en general, no está claro. Sin embargo, se cree que los corticosteroides actúan por inducción de proteínas inhibidoras de la fosfolipasa A2, denominadas colectivamente lipocortinas. Se postula que estas proteínas controlan la biosíntesis de mediadores potentes de la inflamación, como las prostaglandinas y los leucotrienos, inhibiendo la liberación de su precursor común ácido araquidónico. El ácido araquidónico es liberado de los fosfolípidos de membrana por la fosfolipasa A2.
Farmacocinética
El grado de absorción percutánea de corticosteroides tópicos está determinado por muchos factores, incluidos el vehículo y la integridad de la barrera epidérmica. No se ha demostrado que los apósitos oclusivos con hidrocortisona durante hasta 24 horas aumenten la penetración; sin embargo, la oclusión de la hidrocortisona durante 96 horas mejora notablemente la penetración. Los corticosteroides tópicos se pueden absorber de la piel intacta normal. La inflamación y / u otros procesos de enfermedad en la piel pueden aumentar la absorción percutánea.
Los estudios en humanos y animales indican que menos del 6% de la dosis aplicada de propionato de halobetasol entra en circulación dentro de las 96 horas posteriores a la administración tópica de la pomada de propionato de Halobetasol.
Los estudios realizados con pomada de propionato de Halobetasol indican que se encuentra en el rango de potencia súper alto en comparación con otros corticosteroides tópicos.
Indicaciones y uso de pomada de propionato de Halobetasol
La pomada de propionato de Halobetasol es un corticosteroide de potencia súper alta indicado para el alivio de las manifestaciones inflamatorias y pruriginosas de dermatosis con respuesta a corticosteroides. No se recomienda el tratamiento más allá de dos semanas consecutivas, y la dosis total no debe exceder los 50 g/semana debido a la posibilidad de que el medicamento suprima el eje hipotalámico-hipofisario-suprarrenal (HPA). No se recomienda el uso en niños menores de 12 años.
Al igual que con otros corticosteroides de alta actividad, el tratamiento debe interrumpirse cuando se haya logrado el control. Si no se observa mejoría en 2 semanas, puede ser necesario reevaluar el diagnóstico.
Contraindicaciones
La pomada de propionato de halobetasol está contraindicada en aquellos pacientes con antecedentes de hipersensibilidad a cualquiera de los componentes de la preparación.
Precauciones
General
La absorción sistémica de corticosteroides tópicos puede producir supresión reversible del eje hipotalámico – hipofisario-suprarrenal (HPA) con la posibilidad de insuficiencia de glucocorticosteroides después de la retirada del tratamiento. Las manifestaciones del síndrome de Cushing, hiperglucemia y glucosuria también se pueden producir en algunos pacientes por absorción sistémica de corticosteroides tópicos durante el tratamiento.
Los pacientes que aplican un esteroide tópico en una superficie grande o en áreas bajo oclusión deben ser evaluados periódicamente para detectar evidencia de supresión del eje HPA. Esto se puede hacer mediante la estimulación de ACTH, cortisol plasmático a.M. y pruebas de cortisol libre urinario. Los pacientes que reciben corticosteroides súper potentes no deben ser tratados durante más de 2 semanas a la vez y solo se deben tratar áreas pequeñas en un momento dado debido al mayor riesgo de supresión de HPA.
La pomada de propionato de halobetasol produce supresión del eje HPA cuando se utiliza en dosis divididas de 7 gramos al día durante una semana en pacientes con psoriasis. Estos efectos fueron reversibles tras la interrupción del tratamiento.
Si se observa supresión del eje HPA, se debe intentar retirar el medicamento, reducir la frecuencia de aplicación o sustituir un corticosteroide menos potente. La recuperación de la función del eje HPA es generalmente inmediata tras la interrupción de los corticosteroides tópicos. Con poca frecuencia, pueden aparecer signos y síntomas de insuficiencia de glucocorticosteroides que requieran corticosteroides sistémicos suplementarios. Para obtener información sobre la suplementación sistémica, consulte información de prescripción de esos productos.
Los pacientes pediátricos pueden ser más susceptibles a la toxicidad sistémica a partir de dosis equivalentes debido a sus proporciones más grandes de superficie de la piel a masa corporal (consulte PRECAUCIONES: Uso pediátrico).
Si se desarrolla irritación, se debe interrumpir el tratamiento con pomada de propionato de Halobetasol e instituir el tratamiento adecuado. La dermatitis alérgica de contacto con corticosteroides generalmente se diagnostica observando la falta de curación en lugar de notar una exacerbación clínica, como ocurre con la mayoría de los productos tópicos que no contienen corticosteroides. Esta observación debe corroborarse con pruebas diagnósticas adecuadas de parche.
Si se presentan o desarrollan infecciones cutáneas concomitantes, se debe utilizar un agente antimicótico o antibacteriano adecuado. Si no se produce una respuesta favorable con prontitud, se debe suspender el uso de la pomada de propionato de Halobetasol hasta que la infección se haya controlado adecuadamente.
El ungüento de propionato de halobetasol no se debe usar en el tratamiento de la rosácea o la dermatitis perioral, y no se debe usar en la cara, la ingle o las axilas.
Información para los pacientes
Los pacientes que usan corticosteroides tópicos deben recibir la siguiente información e instrucciones:
- El medicamento debe usarse según las indicaciones del médico. Es solo para uso externo. Evite el contacto con los ojos.
- El medicamento no debe usarse para ningún trastorno que no sea para el que se recetó.
- El área de la piel tratada no debe vendarse, cubrirse o envolverse de otro modo para que sea oclusiva a menos que lo indique el médico.
- los Pacientes deben informar a su médico cualquier signo de reacciones adversas locales.\
Pruebas de laboratorio
Las siguientes pruebas pueden ser útiles para evaluar a los pacientes para la supresión del eje HPA: Prueba de estimulación de ACTH; prueba de cortisol plasmático A. M.; prueba de cortisol libre en orina.
Carcinogénesis, Mutagénesis, Alteración de la fertilidad
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico del propionato de halobetasol. Se observaron efectos mutagénicos positivos en dos ensayos de genotoxicidad. El propionato de halobetasol dio positivo en una prueba de micronúcleos de hámster chino y en un ensayo de mutación genética de linfoma de ratón in vitro.
Los estudios en ratas tras la administración oral a niveles de dosis de hasta 50 mcg/kg / día no indicaron alteración de la fertilidad ni del rendimiento reproductivo general.
En otros ensayos de genotoxicidad, el propionato de halobetasol no resultó genotóxico en el ensayo de Ames/Salmonella, en el ensayo de intercambio de cromátidas hermanas en células somáticas de hámster chino, en estudios de aberración cromosómica de células germinales y somáticas de roedores y en un ensayo puntual en mamíferos para determinar mutaciones puntuales.
Embarazo
Efectos teratogénicos: Los corticosteroides de categoría C
durante el embarazo han demostrado ser teratogénicos en animales de laboratorio cuando se administran sistémicamente a dosis relativamente bajas. Se ha demostrado que algunos corticosteroides son teratogénicos después de la aplicación cutánea en animales de laboratorio.
El propionato de halobetasol ha demostrado ser teratogénico en ratas con FPS y conejos de tipo chinchilla cuando se administra sistémicamente durante la gestación a dosis de 0,04 a 0,1 mg/kg en ratas y 0,01 mg/kg en conejos. Estas dosis son aproximadamente 13, 33 y 3 veces, respectivamente, la dosis tópica humana de pomada de propionato de Halobetasol. El propionato de halobetasol fue embriotóxico en conejos, pero no en ratas.
Se observó paladar hendido en ratas y conejos. Se observó onfalocele en ratas, pero no en conejos.
No existen estudios adecuados y bien controlados del potencial teratogénico del propionato de halobetasol en mujeres embarazadas. El ungüento de propionato de halobetasol se debe usar durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Las madres lactantes
Los corticosteroides administrados sistémicamente aparecen en la leche materna y pueden suprimir el crecimiento, interferir con la producción endógena de corticosteroides o causar otros efectos adversos. Se desconoce si la administración tópica de corticosteroides puede producir una absorción sistémica suficiente para producir cantidades detectables en la leche materna. Debido a que muchos medicamentos se excretan en la leche materna, se debe tener precaución cuando se administra ungüento de propionato de halobetasol a una mujer lactante.
Uso pediátrico
No se ha establecido la seguridad y eficacia de la pomada de propionato de Halobetasol en pacientes pediátricos y no se recomienda su uso en pacientes pediátricos menores de 12 años. Debido a una relación más alta entre el área de superficie de la piel y la masa corporal, los pacientes pediátricos tienen un mayor riesgo que los adultos de supresión del eje HPA y síndrome de Cushing cuando se tratan con corticosteroides tópicos. Por lo tanto, también tienen un mayor riesgo de insuficiencia suprarrenal durante o después de la retirada del tratamiento. Se han notificado efectos adversos, incluyendo estrías, con el uso inadecuado de corticosteroides tópicos en lactantes y niños.
Se ha notificado supresión del eje HPA, síndrome de Cushing, retraso del crecimiento lineal, aumento de peso retardado e hipertensión intracraneal en niños que reciben corticosteroides tópicos. Las manifestaciones de supresión suprarrenal en niños incluyen niveles bajos de cortisol en plasma y ausencia de respuesta a la estimulación de ACTH. Las manifestaciones de hipertensión intracraneal incluyen fontanelas abultadas, dolores de cabeza y papiledema bilateral.
Uso geriátrico
De 850 pacientes tratados con pomada de Propionato de Halobetasol en ensayos clínicos, el 21% tenían 61 años o más y el 6% tenían 71 años o más. No se observaron diferencias generales en la seguridad o la eficacia entre estos pacientes y los pacientes más jóvenes; y otras experiencias clínicas notificadas no han identificado diferencias en las respuestas entre los pacientes de edad avanzada y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos pacientes de edad avanzada.
Reacciones adversas
En ensayos clínicos controlados, las reacciones adversas más frecuentes notificadas para la pomada de Propionato de Halobetasol incluyeron escozor o ardor en el 1,6% de los pacientes. Las reacciones adversas notificadas con menos frecuencia fueron pustulación, eritema, atrofia cutánea, leucodermia, acné, picor, infección secundaria, telangiectasia, urticaria, piel seca, miliaria, parestesia y erupción cutánea.
Las siguientes reacciones adversas locales adicionales se notifican con poca frecuencia con corticosteroides tópicos, y pueden ocurrir con más frecuencia con corticosteroides de alta potencia, como la pomada de propionato de Halobetasol. Estas reacciones se enumeran en orden decreciente aproximado de aparición: foliculitis, hipertricosis, erupciones acneiformes, hipopigmentación, dermatitis perioral, dermatitis alérgica de contacto, infección secundaria, estrías y miliaria.Para notificar SOSPECHAS DE REACCIONES ADVERSAS, póngase en contacto con Teligent Pharma, Inc. al 1-856-697-1441, o FDA al 1-800-FDA-1088 o www.FDA.gov / medwatch.
Sobredosis
Aplicado tópicamente, el Ungüento de Propionato de Halobetasol se puede absorber en cantidades suficientes para producir efectos sistémicos (consulte PRECAUCIONES)h
Dosis y Administración de la pomada de Propionato de Halobetasol
Aplique una capa delgada de Ungüento de Propionato de Halobetasol en la piel afectada una o dos veces al día, según las indicaciones de su médico, y frote suave y completamente.
El ungüento de propionato de halobetasol es un corticosteroide tópico de potencia súper alta; por lo tanto, el tratamiento debe limitarse a dos semanas y no deben utilizarse cantidades superiores a 50 g/semana. Al igual que con otros corticosteroides, el tratamiento debe interrumpirse cuando se logre el control. Si no se observa mejoría en 2 semanas, puede ser necesario reevaluar el diagnóstico.
La pomada de propionato de halobetasol no se debe usar con apósitos oclusivos.
Cómo se suministra la pomada de Propionato de Halobetasol
La pomada de propionato de Halobetasol, al 0,05%, se suministra en los siguientes tamaños de tubo:
50 g (NDC 63739-998-67)
ALMACENAMIENTO
Almacenar pomada de propionato de Halobetasol entre 15°C y 30°C (59°F y 86°F).Fabricado por: Teligent Pharma, Inc.Buena, NJ 08310 Distribuido por: McKesson Corporation dba Sky Packaging 4971 Southridge Blvd., Suite 101
Memphis, TN 38141
PI-073-00
C101430 Rev 02/2020
ETIQUETA DEL PAQUETE.PANEL DE VISUALIZACIÓN PRINCIPAL Caja de cartón de 50 gramos
NDC 63739-998-67
Propionato de halobetasol
Pomada, 0,05%
Solo para uso tópico.No para uso en ojos.Peso neto 50 grams
Rx Only

| HALOBETASOL PROPIONATE Halobetasol Propionate Ointment |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – McKesson Corporation (140529962)
Registrant – Teligent Pharma, Inc. (011036910)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Teligent Pharma, Inc. | 011036910 | manufacture(63739-998) | |
Frequently asked questions
- Halobetasol vs. clobetasol – how do they compare?
- ¿Se puede utilizar para la hiedra venenosa?
- ¿Se puede usar en el cuero cabelludo?
Más información sobre halobetasol tópico
- Efectos secundarios
- Durante el embarazo o la lactancia
- Información de dosis
- Interacciones con medicamentos
- Comparar alternativas
- Precios & Cupones
- 25 Opiniones
- Clase de medicamentos: topical steroids
Consumer resources
- Patient Information
- Halobetasol Topical application (Advanced Reading)
Professional resources
- Prescribing Information
- Halobetasol (FDA)
- Halobetasol Cream (FDA)
- Halobetasol Foam (FDA)
Other brands Ultravate, Lexette, Bryhali, Halonate
Related treatment guides
- Plaque Psoriasis
- Eczema
- Psoriasis
- Atopic Dermatitis
- Granuloma Annulare
- Dermatitis
Medical Disclaimer
Leave a Reply