Química Orgánica II

Experimentalmente, sin embargo, se observa que hay una barrera significativa a la rotación sobre el enlace C2-C3, y que toda la molécula es plana. Además, el enlace C2-C3 es de 148 pm de largo, más corto que un enlace simple carbono-carbono típico (aproximadamente 154 pm), aunque más largo que un enlace doble típico (aproximadamente 134 pm).
La teoría de orbitales moleculares explica estas observaciones con el concepto de enlaces pi deslocalizados. En esta imagen, los cuatro orbitales atómicos 2p se combinan matemáticamente para formar cuatro orbitales moleculares pi de energía creciente. Dos de ellos, los orbitales pi enlazantes, tienen menor energía que los orbitales atómicos p a partir de los cuales se forman, mientras que dos, los orbitales pi* antibondantes, tienen mayor energía.

El orbital molecular de menor energía, pi1, solo tiene interacción constructiva y nodos cero. Más alto en energía, pero aún más bajo que los orbitales p aislados, el orbital pi2 tiene un nodo pero dos interacciones constructivas, por lo que sigue siendo un orbital de enlace en general. Mirando los dos orbitales antibonding, pi3 * tiene dos nodos y una interacción constructiva, mientras que pi4 * tiene tres nodos y cero interacciones constructivas.
Por el principio de aufbau, los cuatro electrones de los orbitales atómicos aislados de 2 pz se colocan en los MO de enlace pi1 y pi2. Debido a que pi1 incluye la interacción constructiva entre C2 y C3, hay un grado, en la molécula de 1,3-butadieno, de interacción de unión pi entre estos dos carbonos, lo que explica su longitud más corta y la barrera a la rotación. La imagen de enlace de valencia del 1,3-butadieno muestra los dos enlaces pi aislados el uno del otro, con cada par de electrones pi «atascados» en su propio enlace pi. Sin embargo, la teoría de orbitales moleculares predice (con precisión) que los cuatro electrones pi están hasta cierto punto deslocalizados, o ‘esparcidos’, sobre todo el sistema pi.

1,3-butadieno es el ejemplo más simple de un sistema de enlaces pi conjugados. Para ser considerados conjugados, dos o más enlaces pi deben estar separados por un solo enlace, en otras palabras, no puede haber un carbono hibridado sp3 intermedio, porque esto rompería el sistema superpuesto de orbitales p paralelos. En el compuesto a continuación, por ejemplo, los enlaces dobles C1-C2 y C3-C4 se conjugan, mientras que el enlace doble C6-C7 se aísla de los otros dos enlaces pi por C5 hibridado con sp3.

Un concepto muy importante a tener en cuenta es que hay una estabilidad termodinámica inherente asociada con la conjugación. Esta estabilidad se puede medir experimentalmente comparando el calor de hidrogenación de dos dienos diferentes. (La hidrogenación es un tipo de reacción del que aprenderemos mucho más en el capítulo 15: esencialmente, es el proceso de agregar una molécula de hidrógeno – dos protones y dos electrones – a un enlace p). Cuando los dos enlaces dobles conjugados del 1,3-pentadieno se «hidrogenan» para producir pentano, se liberan aproximadamente 225 kJ por mol de pentano formado. Compare eso con los aproximadamente 250 kJ / mol liberados cuando los dos enlaces dobles aislados en el 1,4-pentadieno se hidrogenan, formando también pentano.
La formación de polímeros sintéticos a partir de dienos como el 1,3-butadieno y el isopreno se analiza en la sección 18.5. Los polímeros sintéticos son moléculas grandes formadas por unidades repetitivas más pequeñas. Probablemente esté un poco familiarizado con algunos de estos polímeros; por ejemplo, polietileno, polipropileno, poliestireno y poli(cloruro de vinilo).

la Figura 13.6: diagrama de Energía para la hidrogenación de 1,3-butadieno (no a escala).
Como la hidrogenación del 1,3-butadieno libera menos de la cantidad de energía prevista, el contenido de energía del 1,3-butadieno debe ser inferior a lo que esperábamos. En otras palabras, el 1,3-butadieno es más estable de lo que sugiere su fórmula.
El dieno conjugado es más bajo en energía: en otras palabras, es más estable. En general, los enlaces pi conjugados son más estables que los enlaces pi aislados.
Aquí hay un diagrama de energía que compara diferentes tipos de enlaces con sus calores de hidrogenación (por mol) para mostrar la estabilidad relativa de cada molécula (1 kcal = 4,18 kJ). (Cuanto menor sea el calor de hidrogenación (enlace por pi), más estable será la estructura.)
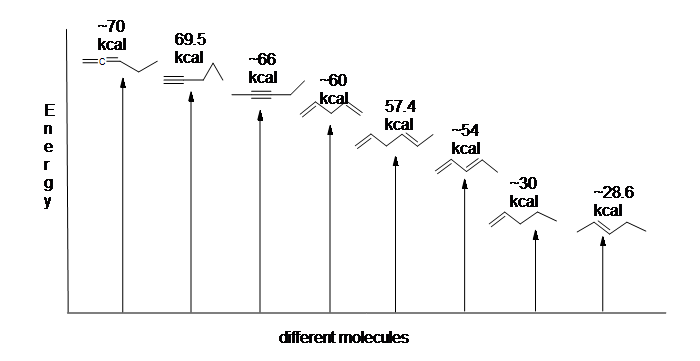
La estabilización de dienos por conjugación es menos dramática que la estabilización aromática del benceno. Sin embargo, se pueden escribir descripciones similares de conjugación de resonancia y orbitales moleculares.
Síntesis de dienos
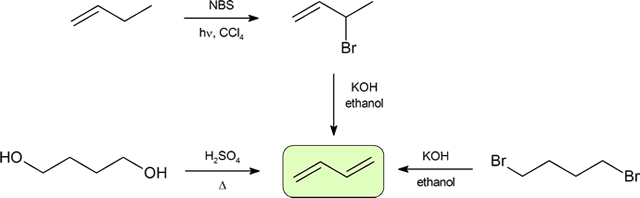
Las dos formas más frecuentes de sintetizar dienos conjugados son la deshidratación de alcoholes y la deshidrohalogenación de organohalidos, que se introdujeron en la preparación de alquenos (Sección 9.9). El siguiente esquema ilustra algunas de las rutas para preparar un dieno conjugado.
Conjugado sistemas de pi puede implicar el oxígeno y los átomos de nitrógeno así como el carbón. En el metabolismo de las moléculas de grasa, algunas de las reacciones clave involucran alquenos que se conjugan con grupos carbonilos.

MO es muy útil para explicar por qué las moléculas orgánicas que contienen sistemas extendidos de enlaces pi conjugados a menudo tienen colores distintivos. el betacaroteno, el compuesto responsable del color naranja de las zanahorias, tiene un sistema extendido de 11 enlaces pi conjugados.

Ejercicios
el Ejercicio 2.9: Identifique todos los enlaces dobles conjugados y aislados en las estructuras de abajo. Para cada sistema pi conjugado, especifique el número de orbitales p superpuestos y cuántos electrones pi se comparten entre ellos.

Ejercicio 2.10: Identificar todos los enlaces pi aislados y conjugados en licopeno, el compuesto de color rojo en los tomates. ¿Cuántos electrones pi están contenidos en el sistema pi conjugado?
Leave a Reply