7.2: Chymotrypsine
Introduction
La chymotrypsine est l’une des enzymes les plus étudiées en raison de sa cinétique à deux phases: pré-état d’équilibre et état d’équilibre. L’étude de ces deux états cinétiques met en évidence le mécanisme du « Ping-Pong », la formation de complexes covalents conduisant à des réactions d’hydrolyse covalentes et la vitesse des réactions catalysées. La synthèse de la chymotrypsine se produit principalement dans le pancréas. Au lieu de la forme active, cependant, il est produit sous forme de zymogène inactif appelé chymotrypsinogène pour empêcher son activité protéase de digérer le pancréas. Lors de la sécrétion dans la lumière de l’intestin grêle, il est converti en sa forme active par une autre enzyme appelée trypsine. Cette dépendance d’une enzyme différente pour l’activation d’une protéase est un moyen courant pour le corps d’empêcher la digestion des organes et d’autres effets secondaires enzymatiques nocifs.
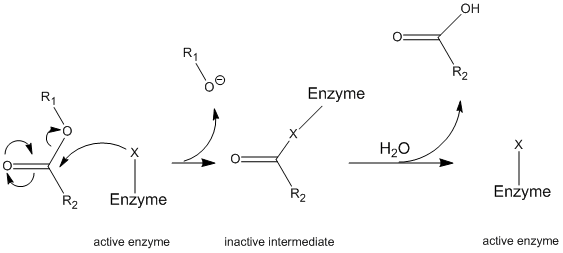
La chymotrypsine fonctionne par un mécanisme général connu sous le nom de mécanisme de ping-pong (Figure\(\PageIndex{1}\)) par lequel l’enzyme réagit avec un substrat pour former un intermédiaire enzymatique. Cet intermédiaire a des propriétés différentes de l’enzyme initiale, donc pour régénérer l’activité enzymatique initiale, il doit réagir avec un substrat secondaire. Ce processus est illustré ci-dessous :

Plus précisément, la chymotrypsine fonctionne par un type particulier de mécanisme de ping-pong appelé hydrolyse covalente. Cela signifie que l’enzyme forme d’abord une liaison covalente avec le substrat cible, déplaçant la fraction la plus stable en solution. Ce complexe enzyme-substrat est appelé intermédiaire enzymatique. L’intermédiaire réagit alors avec l’eau, ce qui déplace la partie restante du substrat initial et réforme l’enzyme initiale.
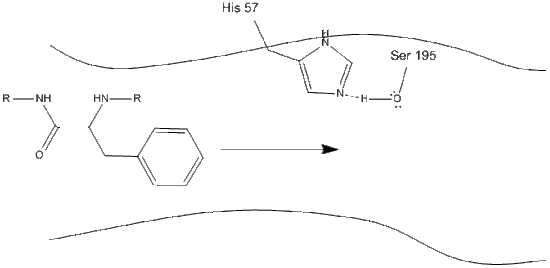
La chymotrypsine, comme la plupart des enzymes, est spécifique des types de substrats avec lesquels elle réagit. En tant que protéase, elle clive les polypeptides et sa spécificité inhérente lui permet d’agir uniquement sur le carboxy-terminal des résidus aromatiques. C’est un mécanisme quelque peu compliqué, et il est préférable de l’expliquer en une série d’étapes.
1. La cible pénètre dans le site actif de la chymotrypsine et y est maintenue par des interactions hydrophobes entre des groupes non polaires de résidus d’enzymes exposés et la chaîne latérale aromatique non polaire du substrat. Il est important de noter la liaison hydrogène entre l’azote de Schiff sur l’histidine-57 et la chaîne latérale d’oxygène de la sérine-195.
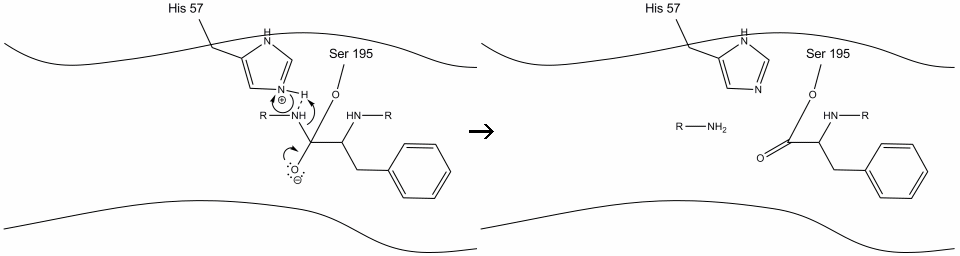
2. Aidé par la liaison hydrogène histidine-sérine, le groupe hydroxyle sur la sérine-195 effectue une attaque nucléophile sur le carbone carbonyle d’un acide aminé aromatique tout en transférant simultanément l’hydrogène hydroxyle à l’azote de Schiff de l’histidine. Cette attaque pousse les électrons carbonyles pi sur l’oxygène carbonyle, formant un intermédiaire de courte durée constitué d’un carbone c-terminal avec quatre liaisons simples: un anion oxygène, le bêta-carbone de l’acide aminé aromatique, l’extrémité n de l’acide aminé ultérieur de la protéine de substrat et l’oxygène de la chaîne latérale sérine-195.
.gif?revision=1&size=bestfit&width=720&height=192)
3. Cet intermédiaire est de courte durée, car les électrons de l’oxyanion reforment la liaison pi avec l’extrémité c de l’acide aminé aromatique. La liaison entre l’extrémité carboxy de l’acide aminé aromatique et l’extrémité n du résidu suivant est clivée et ses électrons sont utilisés pour extraire l’hydrogène de l’azote Schiff protoné sur l’histidine-57. Les liaisons entre le carbone carbonyle et l’oxygène sérine-195 restent dans une configuration ester. C’est ce qu’on appelle l’intermédiaire acyl-enzyme. Le côté c-terminal du polypeptide est maintenant libre de se dissocier du site actif de l’enzyme.
4. Les molécules d’eau sont maintenant capables d’entrer et de se lier au site actif par liaison hydrogène entre les atomes d’hydrogène de l’eau et l’azote de Schiff histidine-57.
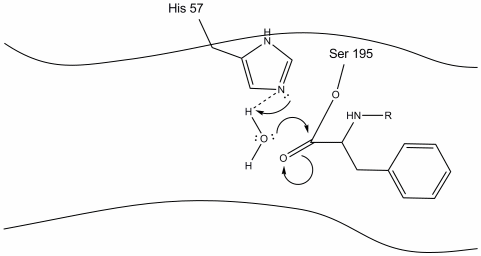
5. L’oxygène de l’eau fait maintenant une attaque nucléophile sur le carbone carbonyle de l’intermédiaire de l’enzyme acyle, poussant les électrons pi du carbonyle sur le carbone carbonyle alors que l’histidine-57 extrait un proton de l’eau. Cela forme un autre carbone quaternaire lié de manière covalente avec la sérine, un hydroxyle, un oxyanion et l’acide aminé aromatique. Le proton de l’histidine-57 récemment protonée est maintenant capable de créer une liaison hydrogène avec l’oxygène de la sérine.
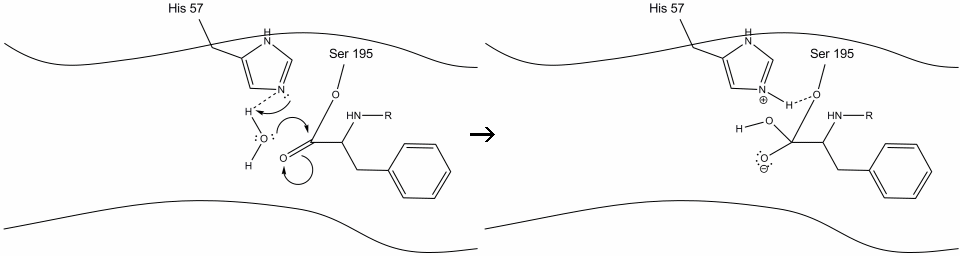
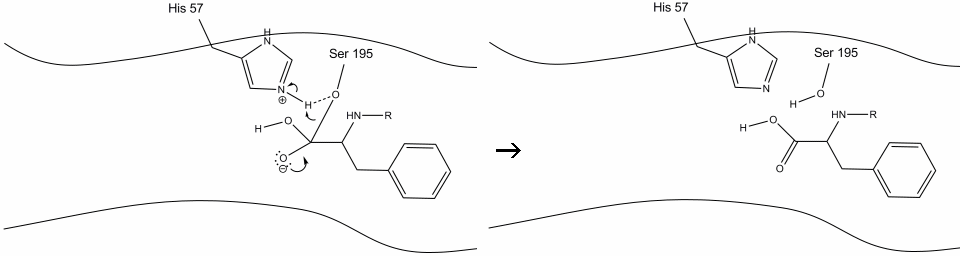
6. Les électrons de l’oxyanion reforment la liaison carbonyle pi, coupant la liaison entre le carbone carbonyle et l’hydroxyle sérine. Les électrons de cette liaison sont utilisés par l’oxygène de la sérine pour déprotoner l’azote de l’histidine Schiff et reformer l’enzyme d’origine. Le substrat n’a plus d’affinité pour le site actif, et il se dissocie rapidement du complexe.
Leave a Reply