Chimie organique II

Expérimentalement, cependant, on observe qu’il existe une barrière significative à la rotation autour de la liaison C2-C3, et que la molécule entière est plane. De plus, la liaison C2-C3 est longue de 148 pm, plus courte qu’une liaison simple carbone-carbone typique (environ 154 pm), bien que plus longue qu’une double liaison typique (environ 134 pm).
La théorie des orbitales moléculaires rend compte de ces observations avec le concept de liaisons pi délocalisées. Sur cette image, les quatre orbitales atomiques 2p se combinent mathématiquement pour former quatre orbitales moléculaires pi d’énergie croissante. Deux de ces orbitales – les orbitales pi de liaison – ont une énergie plus faible que les orbitales atomiques p à partir desquelles elles sont formées, tandis que deux – les orbitales pi* anti–liantes – ont une énergie plus élevée.

L’orbitale moléculaire de plus basse énergie, pi1, n’a qu’une interaction constructive et zéro nœud. Plus élevée en énergie, mais toujours plus faible que les orbitales p isolées, l’orbitale pi2 a un nœud mais deux interactions constructives – c’est donc toujours une orbitale de liaison dans son ensemble. En examinant les deux orbitales opposées, pi3* a deux nœuds et une interaction constructive, tandis que pi4 * a trois nœuds et zéro interaction constructive.
Selon le principe d’aufbau, les quatre électrons des orbitales atomiques 2pz isolées sont placés dans les MO de liaison pi1 et pi2. Comme pi1 inclut une interaction constructive entre C2 et C3, il existe un degré, dans la molécule de butadiène-1,3, d’interaction de liaison pi entre ces deux carbones, ce qui explique sa longueur plus courte et la barrière à la rotation. L’image de la liaison de valence du 1,3-butadiène montre que les deux liaisons pi sont isolées l’une de l’autre, chaque paire d’électrons pi étant « coincée » dans sa propre liaison pi. Cependant, la théorie des orbitales moléculaires prédit (avec précision) que les quatre électrons pi sont dans une certaine mesure délocalisés, ou « répartis », sur l’ensemble du système pi.

le 1,3-butadiène est l’exemple le plus simple d’un système de liaisons pi conjuguées. Pour être considérées comme conjuguées, deux liaisons pi ou plus doivent être séparées par une seule liaison unique – en d’autres termes, il ne peut pas y avoir de carbone hybride sp3 intermédiaire, car cela briserait le système de chevauchement des orbitales p parallèles. Dans le composé ci-dessous, par example, les doubles liaisons C1-C2 et C3-C4 sont conjuguées, tandis que la double liaison C6-C7 est isolée des deux autres liaisons pi par C5 hybridé sp3.

Un concept très important à garder à l’esprit est qu’il existe une stabilité thermodynamique inhérente associée à la conjugaison. Cette stabilité peut être mesurée expérimentalement en comparant la chaleur d’hydrogénation de deux diènes différents. (L’hydrogénation est un type de réaction sur lequel nous en apprendrons beaucoup plus au chapitre 15: il s’agit essentiellement du processus d’ajout d’une molécule d’hydrogène – deux protons et deux électrons – à une liaison p). Lorsque les deux doubles liaisons conjuguées du 1,3-pentadiène sont « hydrogénées » pour produire du pentane, environ 225 kJ sont libérés par mole de pentane formé. Comparez cela aux environ 250 kJ / mol libérés lorsque les deux doubles liaisons isolées dans le 1,4-pentadiène sont hydrogénées, formant également du pentane.
La formation de polymères synthétiques à partir de diènes tels que le butadiène-1,3 et l’isoprène est discutée à la section 18.5. Les polymères synthétiques sont de grosses molécules composées d’unités répétitives plus petites. Vous connaissez probablement un certain nombre de ces polymères; par exemple, le polyéthylène, le polypropylène, le polystyrène et le poly (chlorure de vinyle).

Figure 13.6: Diagramme d’énergie pour l’hydrogénation du 1,3-butadiène (pas à l’échelle).
Comme l’hydrogénation du 1,3-butadiène libère moins d’énergie que la quantité d’énergie prévue, la teneur en énergie du 1,3-butadiène doit être inférieure à ce que nous aurions pu prévoir. En d’autres termes, le butadiène-1,3 est plus stable que sa formule ne le suggère.
Le diène conjugué est plus faible en énergie : en d’autres termes, il est plus stable. En général, les liaisons pi conjuguées sont plus stables que les liaisons pi isolées.
Voici un diagramme d’énergie comparant différents types de liaisons avec leurs chaleurs d’hydrogénation (par mole) pour montrer la stabilité relative de chaque molécule (1 kcal = 4,18 kJ). (Plus la chaleur d’hydrogénation est faible (par liaison pi), plus la structure est stable.)

La stabilisation des diènes par conjugaison est moins spectaculaire que la stabilisation aromatique du benzène. Néanmoins, des descriptions similaires de la conjugaison par résonance et orbitale moléculaire peuvent être écrites.
Synthèse des diènes
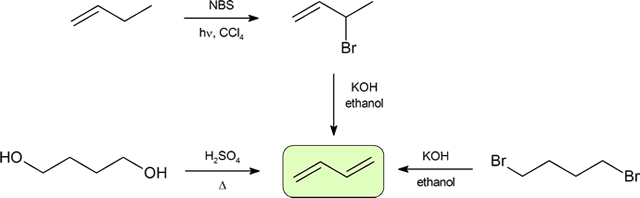
Les deux méthodes les plus fréquentes de synthèse des diènes conjugués sont la déshydratation des alcools et la déhydrohalogénation des organohalogénures, qui ont été introduites dans la préparation des alcènes (section 9.9). Le schéma suivant illustre certaines des voies de préparation d’un diène conjugué.
Les systèmes pi conjugués peuvent impliquer des atomes d’oxygène et d’azote ainsi que du carbone. Dans le métabolisme des molécules de graisse, certaines des réactions clés impliquent des alcènes conjugués à des groupes carbonyles.

La théorie MO est très utile pour expliquer pourquoi les molécules organiques qui contiennent des systèmes étendus de liaisons pi conjuguées ont souvent des couleurs distinctives. le bêta-carotène, le composé responsable de la couleur orange des carottes, possède un système étendu de 11 liaisons pi conjuguées.

Exercices
Exercice 2.9: Identifiez toutes les doubles liaisons conjuguées et isolées dans les structures ci-dessous. Pour chaque système pi conjugué, spécifiez le nombre d’orbitales p qui se chevauchent et combien d’électrons pi sont partagés entre eux.

Exercice 2.10: Identifier toutes les liaisons pi isolées et conjuguées dans le lycopène, le composé de couleur rouge des tomates. Combien d’électrons pi sont contenus dans le système pi conjugué?
Leave a Reply