Frontières en pharmacologie
Introduction
Les liposomes sont un type de nanocarrier qui a été largement étudié à des fins d’administration de médicaments. Ils sont composés de bicouches de phospholipides qui renferment un espace aqueux distinct, permettant ainsi l’encapsulation de composés hydrophiles et hydrophobes (Metselaar et Storm, 2005). Les liposomes sont capables de stabiliser les composés thérapeutiques et de surmonter les obstacles à l’absorption cellulaire et tissulaire (Ding et al., 2006; Hua et Wu, 2013). Cela leur permet d’améliorer le ciblage des composés sur les sites de la maladie et par conséquent de réduire l’accumulation dans les organes non ciblés (Bakker-Woudenberg et al., 1994; Mastrobattista et coll., 1999; Hua, 2013; Hua et coll., 2015; Sercombe et coll., 2015; Zununi Vahed et coll., 2017). Il existe quatre principaux types de liposomes en fonction de leurs caractéristiques de surface: les liposomes conventionnels, les liposomes pégylés, les liposomes ciblés par ligand et les liposomes théranostiques (Figure 1; Sercombe et al., 2015). Les liposomes ciblés par ligand offrent la possibilité d’administrer des médicaments spécifiques au site à certains tissus ou organes qui expriment sélectivement le ligand ciblé (Willis et Forssen, 1998; Bendas, 2001; Sawant et Torchilin, 2012), tandis que les liposomes pégylés confèrent un obstacle stérique pour améliorer la demi-vie de circulation du système d’administration après administration systémique (Torchilin, 1994; Wang et al., 2015). Les liposomes incorporant une combinaison des différentes plates-formes d’administration peuvent améliorer encore l’administration de composés encapsulés, en fonction de la voie d’administration et du site de la maladie.
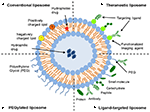
FIGURE 1. Représentation schématique des différents types de systèmes d’administration de médicaments liposomaux – (A) liposome conventionnel, (B) liposome pégylé, (C) liposome ciblé par ligand et (D) liposome théranostique (Sercombe et al., 2015).
Après le processus de fabrication, les liposomes sont caractérisés pour assurer l’homogénéité à travers un certain nombre de paramètres, y compris l’encapsulation du médicament, la conjugaison du ligand, la composition lipidique, la charge de surface et les propriétés morphologiques (par exemple, la taille, la forme et le nombre de lamelles) (Kuntsche et al., 2011). Ces caractéristiques sont importantes car elles peuvent avoir un impact majeur sur le comportement des liposomes in vitro et in vivo (Sawant et Torchilin, 2012; Sercombe et al., 2015). La reconnaissance et la clairance des liposomes par les défenses de l’organisme, y compris le système réticulo-endothélial (RES) et l’adsorption des opsonines avec absorption ultérieure par le système phagocytaire mononucléaire, contribuent grandement à la clairance et à la dégradation des liposomes (Senior, 1987; Cullis et al., 1998; Ishida et coll., 2001). Par conséquent, il est important de pouvoir déterminer les propriétés physico-chimiques des liposomes fabriqués pour optimiser une formulation en vue d’une évaluation translationnelle ultérieure.
Un aspect majeur de l’évaluation physico-chimique des liposomes est la visualisation de la morphologie des nanoparticules par microscopie. Il existe un certain nombre de techniques disponibles pour l’imagerie des liposomes et d’autres nanoparticules qui peuvent être largement classées en microscopie à la lumière, à l’électron ou à la force atomique (Bibi et al., 2011). Chaque technique a ses propres avantages et limites, qui devraient être pris en compte lors de l’évaluation des études sur les systèmes d’administration de médicaments à base de nanoparticules (tableau 1). Cette revue évaluera chaque technique d’imagerie utilisée pour évaluer les caractéristiques morphologiques des liposomes.

TABLEAU 1. Résumé des techniques d’imagerie actuelles pour caractériser la morphologie des liposomes.
Microscopie optique
La microscopie optique ou optique fait référence aux microscopes qui utilisent la lumière visible et un agencement de lentilles pour agrandir un champ de vision (Murphy et Davidson, 2012c). La microscopie optique de base elle-même est incapable de fournir des informations complètes sur la bicouche lipidique par rapport aux détails offerts par d’autres techniques de microscopie. Cependant, il peut être utilisé pour obtenir rapidement une image de vésicules à l’aide d’équipements de laboratoire de base (Bibi et al., 2011). Cette technique peut être particulièrement utile lors de la collecte d’informations générales sur la taille, la forme, l’homogénéité et le degré d’agrégation d’un échantillon de liposomes (Nallamothu et al., 2006). Les microscopes optiques ont une résolution finale de ∼250 nm (régie par la plus petite taille de tache limitée à la diffraction pouvant être atteinte par l’instrument) et, en tant que tels, sont généralement incapables de fournir des informations détaillées sur les structures des petites vésicules unilamellaires (SUVs) et la lamellarité des vésicules (Bibi et al., 2011). En règle générale, la microscopie optique ne peut fournir que des informations significatives sur les vésicules unilamellaires géantes (GUV), dont le diamètre peut varier d’un à plusieurs centaines de micromètres (Bagatolli, 2009). L’incorporation de sondes fluorescentes, les techniques de polarisation et l’application de la microscopie confocale à haute résolution peuvent fournir plus d’informations sur la structure 3D et la lamellarité des vésicules (Bagatolli, 2009).
Microscopie à polarisation
Ce type de microscopie optique utilise la capacité unique de la lumière polarisée à interagir avec des liaisons polarisables de molécules ordonnées (Murphy et Davidson, 2012d). L’absorption de lumière améliorée se produit lorsque les dipôles moléculaires de l’échantillon sont alignés avec le vecteur de polarisation de l’onde lumineuse incidente; il en résulte des différences de phase entre les rayons lumineux d’échantillonnage, qui à leur tour produisent des changements d’amplitude dépendants des interférences dans le plan image (Murphy et Davidson, 2012d). Le contraste de l’image résulte alors non seulement des effets d’interférence et de diffraction, mais également de la présence d’arrangements moléculaires ordonnés (Murphy et Davidson, 2012d). Il peut être utilisé pour étudier la forme et la dynamique de nombreuses structures cellulaires ordonnées, y compris les bicouches lipidiques des membranes plasmiques (Bibi et al., 2011; Murphy et Davidson, 2012d). Les images peuvent être obtenues en monochrome ou en couleur. Cette technique fournit une méthode alternative pour visualiser les liposomes, notamment pour confirmer la formation de vésicules. Il ne fournit pas d’observations concluantes concernant les caractéristiques bicouches ou la lamellarité des vésicules (Bibi et al., 2011). De plus, la microscopie à polarisation est également limitée par la taille des vésicules pouvant être visualisées, les grandes vésicules de l’ordre du micromètre ayant la clarté optimale. Cette technique ne fournit pas d’images claires de particules de l’ordre du nanomètre.
Microscopie à fluorescence
La microscopie à fluorescence ou « épifluorescence” est une forme particulière de microscopie optique qui exploite la capacité des fluorochromes à émettre de la lumière après avoir été excités avec une lumière d’une certaine longueur d’onde (Murphy et Davidson, 2012b). Cette technique est largement utilisée en biophysique pour fournir des informations essentielles sur la structure et la dynamique des composants membranaires (Bouvrais et al., 2010). Dans ces études, des sondes fluorescentes sont spécifiquement incorporées dans la membrane étudiée, ce qui permet de visualiser la structure. Une large gamme de colorants fluorescents aux propriétés chimiques et photoniques variées est disponible dans le commerce, répondant à une variété de questions de recherche. Par example, certains colorants fluorescents peuvent préférer des environnements membranaires spécifiques présentant des dispositions et un garnissage latéral différents (Bouvrais et al., 2010). En tant que telle, la microscopie à fluorescence permet d’appliquer simultanément plusieurs sondes dans un échantillon pour fournir des informations sur la structure de la membrane elle-même. Les sondes fluorescentes peuvent être placées à l’intérieur du compartiment aqueux ainsi que de la bicouche lipidique des liposomes (Bibi et al., 2011). Cette disposition peut être particulièrement utile lors de la visualisation de GUV, où des informations peuvent être obtenues concernant la forme, la taille et la fluidité des vésicules lipidiques (Klymchenko et al., 2009; Bouvrais et coll., 2010). L’incorporation de sondes, telles que des lipides marqués à la rhodamine, directement dans la bicouche lipidique peut également permettre de visualiser la lamellarité des liposomes (Bibi et al., 2011).
L’inconvénient de la microscopie fluorescente est que l’ajout de sondes et de colorants à un système membranaire peut potentiellement interférer avec les propriétés du système d’administration liposomale (Bouvrais et al., 2010; Bibi et coll., 2011; Murphy et Davidson, 2012b). Cependant, il a été démontré que l’utilisation de faibles concentrations de colorant (≤1 % en moles) avait un impact minimal sur les propriétés physiques de la membrane (Bouvrais et al., 2010). Il est également important de noter que le choix du colorant fluorescent est une étape critique, car certains colorants peuvent induire de grands changements dans la membrane hôte et / ou provoquer des artefacts expérimentaux, entraînant une interprétation inexacte des données (Bouvrais et al., 2010). De plus, la peroxydation lipidique photo-induite peut également conduire à la formation de domaines même dans des systèmes de teinture simples. Ce processus peut entraîner la formation de grands radeaux et la formation spontanée de facettes (Bouvrais et al., 2010). Une exposition prolongée à la lumière fluorescente peut également entraîner un blanchiment et une perte d’intensité de fluorescence. Par conséquent, le choix du colorant fluorescent et le développement de nouvelles sondes membranaires sont des considérations importantes lors de l’utilisation de la microscopie à fluorescence (Klymchenko et al., 2009).
Microscopie confocale
La microscopie confocale à balayage a été un progrès dans le domaine de la microscopie à fluorescence. Plutôt que d’éclairer l’échantillon entier, une image est construite en balayant un (ou plusieurs) faisceaux de lumière focalisés à travers l’échantillon. La lumière renvoyant de l’échantillon éclairé traverse une ouverture qui rejette la lumière non focalisée du dessus et du dessous du plan d’intérêt; s’assurer que seules les images d’une faible profondeur de champ sont obtenues, améliorant considérablement la résolution hors plan (Bibi et al., 2011; Murphy et Davidson, 2012a). En utilisant cette technique, une ”pile z » d’images est collectée, en partant du haut de la vésicule suivie d’images prises par incréments z définis jusqu’au bas de l’échantillon, ce qui donne une image 3D composite de l’échantillon (Bibi et al., 2011; Murphy et Davidson, 2012a). La microscopie confocale à balayage est devenue une technique plus attrayante que les microscopes optiques épifluorescents en raison de sa clarté d’image supérieure. Dans le cas des GUV, cette technique est capable de visualiser la structure interne des systèmes lipidiques, ce qui n’est souvent pas possible avec d’autres méthodes de microscopie (Ruozi et al., 2011; Mertins et Dimova, 2013). Par exemple, la séparation de la phase bicouche aqueuse et lipidique peut être clairement visualisée dans de plus grandes vésicules (Mertins et Dimova, 2013). Cependant, la microscopie confocale est encore limitée par la diffraction et, par conséquent, incapable de produire des images haute définition de SUVs ou de liposomes oligolamellaires (Ruozi et al., 2011).
Techniques de microscopie électronique
La microscopie électronique est une méthode de visualisation de vésicules à très fort grossissement (Henry, 2005). Il est largement utilisé dans la caractérisation des vésicules lipidiques en tant que longueur d’onde électronique (et donc résolution limitée par diffraction), est de plusieurs ordres de grandeur inférieur à celui de la microscopie optique et fournit donc une super-résolution pour une visualisation claire des petits liposomes (Bibi et al., 2011; Ruozi et coll., 2011). Cette technique utilise un faisceau d’électrons focalisés sur la surface de l’échantillon par diverses lentilles électromagnétiques. Les électrons sont ensuite dispersés par l’échantillon, puis recentrés et agrandis par une autre série de lentilles électromagnétiques dans la colonne d’imagerie pour produire une image projetée (Henry, 2005). Il existe différents types de microscopes électroniques, chacun nécessitant une méthode de préparation d’échantillon différente.
Microscopie électronique à balayage (MEB)
Les microscopes électroniques à balayage (MEB) utilisent un faisceau d’électrons qui est balayé à travers ou au-dessus d’un échantillon (plutôt qu’à travers un échantillon) pour produire une image agrandie d’un objet (Adler et Schiemann, 1985). Alder et coll. première tentative d’utilisation de la MEB pour caractériser les liposomes en 1984 (Adler et Schiemann, 1985). Ils ont montré que l’utilisation de la méthode de lyophilisation pour préparer les échantillons de liposomes pour la MEB entraînait une grande proportion de grumeaux visibles et de matériaux en croûte (Adler et Schiemann, 1985). Des études plus récentes ont montré que la structure des liposomes elle-même peut subir des perturbations dues aux conditions de vide poussé et aux processus de coloration nécessaires à cette technique de préparation (Ruozi et al., 2011). Le MEB n’est plus couramment utilisé pour l’analyse des liposomes car il nécessite que l’échantillon soit séché ou fixé avant l’imagerie (Ruozi et al., 2011). Cependant, la MEB peut fournir des informations générales sur la structure concentrique des différentes couches lipidiques, ainsi que des détails sur la taille et la morphologie sphérique d’une préparation (Nirale et al., 2009).
La microscopie électronique à transmission (TEM)
La microscopie électronique à transmission (TEM) est la méthode d’imagerie la plus fréquemment utilisée pour l’évaluation de la structure des nanoparticules (Henry, 2005; Kuntsche et al., 2011). Elle implique la préparation d’un échantillon mince (< de 100 nm d’épaisseur) qui est placé dans une chambre à vide. Le faisceau d’électrons traverse l’échantillon, où il est ensuite focalisé par l’objectif pour former une image. La GFT peut facilement imager des échantillons de matière molle avec une résolution spatiale bien inférieure à 1 nm (Henry, 2005; Kuntsche et al., 2011; Ruozi et coll., 2011). Cette technique peut être encore catégorisée en fonction de la méthode de préparation de l’échantillon utilisée – en particulier, coloration négative, gel–fracture et TEM cryogénique. Il peut fournir des informations sur les modifications de surface des nanoparticules car il fournit un meilleur contraste et un meilleur contour des images que d’autres techniques de microscopie. Par exemple, la conjugaison de la transferrine à la surface des liposomes DSPC / cholestérol a montré un revêtement de surface particulaire avec du TEM négatif, qui était absent dans les préparations de liposomes non conjuguées (Anabousi et al., 2005). Dans une expérience distincte, des anticorps spécifiques élevés contre la transferrine humaine ont été ajoutés avant la procédure de coloration négative pour confirmer l’identité du revêtement de surface particulaire (Anabousi et al., 2005). Par conséquent, la TEM offre la possibilité d’obtenir une résolution beaucoup améliorée lors de l’évaluation de la conjugaison des ligands à la surface des liposomes.
Technique de coloration négative
Dans le TEM de coloration négative, la préparation de l’échantillon consiste à placer une petite quantité d’échantillon hydraté sur une grille. Comme les vésicules sont en contact direct avec la grille, leur orientation et leur morphologie peuvent être affectées, ce qui doit donc être pris en compte (Bibi et al., 2011). Il est également nécessaire d’intégrer les liposomes dans un matériau dense en électrons approprié (p.ex., des sels de métaux lourds comme l’acétate d’uranyle ou l’acide phosphotungstique) qui fournissent un contraste élevé, de sorte que les vésicules peuvent être vues sur un fond teinté de noir (Ruozi et al., 2011). La technique de coloration négative est relativement rapide et simple; cependant, il a été démontré qu’elle provoque des modifications de la structure originale des liposomes et peut conduire à la création de franges claires et sombres qui peuvent être confondues avec des structures lamellaires (Bibi et al., 2011; Ruozi et coll., 2011). De plus, la mise sous vide de l’échantillon peut entraîner une déshydratation supplémentaire de l’échantillon, ce qui peut à nouveau provoquer des modifications de la structure des vésicules (Bibi et al., 2011). Alors que la technique TEM à coloration négative peut fournir un grossissement beaucoup plus élevé pour l’imagerie des nanoparticules, les dommages causés à la structure du liposome rendent difficile l’évaluation précise des caractéristiques morphologiques de l’échantillon. Par conséquent, d’autres techniques d’imagerie sont généralement nécessaires pour confirmer les résultats.
Technique de lyophilisation
La technique de lyophilisation ne nécessite aucun processus de séchage et peut fournir des informations supplémentaires sur la structure interne des nanoparticules (Kuntsche et al., 2011). Cette méthode consiste à placer un échantillon sur une grille TEM prise en sandwich entre deux supports en cuivre ou en or (Severs, 2007). L’échantillon est vitrifié par congélation rapide, généralement avec du propane liquide ou de l’azote liquide, avant d’être fracturé le long de zones de l’échantillon présentant de faibles interactions moléculaires. Cette surface de fracture peut être encore gravée et ombrée d’une fine couche de platine ou de carbone pour fournir une réplique « négative » du plan d’échantillon de fracture (Severs, 2007; Kuntsche et al., 2011). La réplique est ensuite nettoyée avec un solvant organique pour éliminer tous les résidus avant la visualisation au microscope GFT. Comme ces répliques sont si stables, elles peuvent être stockées et visualisées plus tard (Kuntsche et al., 2011). L’avantage majeur de cette technique est que les répliques reflètent étroitement l’état natif de l’échantillon, et peuvent fournir des informations détaillées sur la structure 3D des vésicules et l’organisation bicouche (Bibi et al., 2011; Kuntsche et coll., 2011). Ces informations comprennent la construction multilamellaire et l’emballage bicouche des vésicules multilamellaires. Cette technique permet également d’évaluer la taille des agrégats et peut être particulièrement utile pour examiner l’interaction des liposomes cationiques avec l’ADN (Bibi et al., 2011). Cependant, des artefacts peuvent encore se produire dans l’échantillon pendant la préparation en raison d’un taux de congélation insuffisant, d’un dépôt de molécules de solvant et / ou d’une contrainte mécanique (Severs, 2007; Kuntsche et al., 2011). Par exemple, un ”effet d’ondulation » peut se produire sur les VUS de l’échantillon (Bibi et al., 2011). Il s’agit d’une déformation bicouche courante due à un trouble des transitions des chaînes acyles avant la congélation. L’incubation de vésicules entre la température de pré-transition et la température de transition réelle peut également provoquer des ondulations (Bibi et al., 2011). Fait intéressant, cela peut être utilisé pour fournir des informations sur les transitions de phase lipidiques qui se produisent avec la nature variable des lipides utilisés pour les préparations liposomales (Bibi et al., 2011).
TEM cryogénique
Le TEM cryogénique (cryo-TEM) est une variante du TEM où de minces films hydratés aqueux vitrifiés dans de l’éthane liquide sont utilisés avant l’imagerie. Cette technique permet l’analyse des liposomes dans leur état le plus natif et constitue un outil précieux pour déterminer la taille, la forme, la structure interne et la lamellarité des liposomes (Weisman et al., 2004; Bibi et coll., 2011; Kuntsche et coll., 2011). L’avantage majeur de la congélation rapide des échantillons de liposomes est de minimiser la formation de cristaux de glace et de préserver les protéines ou d’autres matériaux (Bibi et al., 2011; Kuntsche et coll., 2011). Ceci est bénéfique lorsque des protéines ou de l’ADN ont été encapsulés dans les nanoparticules (Weisman et al., 2004; Kuntsche et coll., 2011). La cryo-TEM est la forme de microscopie la plus utile actuellement disponible pour étudier les liposomes, car elle évite les problèmes de fixation chimique, de déshydratation, de coupe et de coloration – qui peuvent tous affecter la morphologie des vésicules (Bibi et al., 2011). La plage de résolution est comprise entre ∼5 et 500 nm, telle que définie par l’épaisseur du film (Almgren et al., 2000). Cependant, plusieurs limitations sont à noter avec cette technique, notamment le fait que seule une image 2D est obtenue à partir d’objets 3D (ce qui s’applique généralement également à la plupart des autres techniques de microscopie). Pour surmonter cette limitation, la reconstruction de formes 3D à partir d’un nombre suffisamment important d’images 2D de particules non sphériques orientées aléatoirement est possible (Orlova et al., 1999), ainsi que la visualisation de l’échantillon sous différents angles d’inclinaison pour obtenir des informations sur la forme 3D (Van Antwerpen et Gilkey, 1994). La tomographie électronique cryogénique (cryo-ET) peut également être utilisée à la place pour obtenir des images 3D (Le Bihan et al., 2009). Cryo-TEM utilise également des doses d’électrons plus faibles, ce qui signifie qu’il a souvent une résolution plus faible par rapport aux autres méthodes (Bibi et al., 2011; Kuntsche et coll., 2011). Des artefacts sont encore possibles grâce à la formation d’un film mince de glace amorphe et à l’utilisation de buvard sur l’échantillon en appliquant des forces de cisaillement pendant la formation du film (Almgren et al., 2000; Bibi et coll., 2011).
La microscopie électronique à balayage environnemental (ESEM)
La microscopie électronique à balayage environnemental (ESEM) est un système d’imagerie qui ne nécessite pas l’utilisation de la fixation, de la coloration ou de la congélation des vésicules et qui peut permettre l’imagerie des changements dynamiques des systèmes humides sans préparation préalable d’échantillon (Muscariello et al., 2005; Ruozi et coll., 2011). La principale caractéristique de l’ESEM est la présence de vapeur d’eau dans la chambre du microscope. La capacité de maintenir une atmosphère contenant de l’eau autour de l’échantillon qui peut être partiellement ou même complètement hydratée est rendue possible par l’utilisation d’un système de vide gradué à ouvertures multiples qui permet de maintenir la chambre d’imagerie à des pressions allant jusqu’à 55 hPa (Bibi et al., 2011; Ruozi et coll., 2011). Le faisceau d’électrons primaire peut générer des électrons secondaires qui rencontrent ensuite des molécules de vapeur, conduisant à une amplification en cascade du signal avant d’atteindre le détecteur. Pour cette raison, ESEM ne nécessite pas de préparation d’échantillon (Muscariello et al., 2005). Cette technique permet de varier l’environnement de l’échantillon grâce à une série de compositions de pression, de température et de gaz (Mohammed et al., 2004), ce qui est utile pour déterminer comment les changements environnementaux affectent les vésicules. Ceci est applicable aux études de formulation et de stabilité nanopharmaceutiques (Bibi et al., 2011). ESEM a également été utilisé pour analyser la charge de médicaments dans la bicouche des liposomes (Mohammed et al., 2004), ainsi que la détermination de la taille et de la forme des vésicules. Une limite de l’ESEM est qu’il ne peut pas fournir d’informations détaillées sur la lamellarité et l’architecture interne des structures à l’échelle nanométrique (Ruozi et al., 2011).
La microscopie à force atomique (AFM)
La microscopie à force atomique (AFM), également connue sous le nom de microscopie à force de balayage (SFM), est un type de technique de microscope à sonde à balayage. Il fonctionne en faisant passer une pointe tranchante attachée à un porte-à-faux et à un capteur sur la surface d’un échantillon et en mesurant les forces de surface entre la sonde et l’échantillon (Sitterberg et al., 2010). Lorsque le porte-à-faux longe la surface de l’échantillon, il se déplace de haut en bas en raison des caractéristiques de la surface et le porte-à-faux dévie en conséquence. Cette déviation est généralement quantifiée à l’aide d’un capteur optique, le faisceau laser étant réfléchi à l’arrière du porte-à-faux sur le détecteur de lumière (Sitterberg et al., 2010). L’AFM n’a pas besoin de fonctionner dans le vide et peut fonctionner dans l’air ambiant ou sous liquide; par conséquent, il est de plus en plus utilisé pour imager des échantillons biologiques ainsi que des nanoparticules (Liang et al., 2004a, b; Ruozi et coll., 2005, 2009). L’AFM a une résolution exceptionnelle de l’ordre des fractions de nanomètre et peut fournir une image 3D des liposomes ainsi que des détails sur la morphologie, la distribution des tailles, l’homogénéité et la stabilité (Liang et al., 2004a, b; Ruozi et coll., 2005, 2007, 2009). Il est important de noter que l’AFM peut être utilisée pour caractériser les modifications de surface des liposomes et détecter des ligands (par exemple, des anticorps et des polymères) conjugués à la surface de la membrane liposomale (Bendas et al., 1999; Moutardier et coll., 2003; Anabousi et coll., 2005; Liang et coll., 2005). Par exemple, Bendas et al. a utilisé l’AFM pour agrandir la bordure de la membrane liposomale et a pu imager des structures trimériques, d’environ 8 à 10 nm de diamètre, qui représentaient le couplage des anticorps IgG à la surface du liposome (Bendas et al., 1999). Les résultats ont montré que l’efficacité de la technique dépendait fortement de la méthode de conjugaison utilisée, les anticorps conjugués directement à la surface liposomale étant visibles avec AFM (restricted protein mobility), par rapport aux anticorps attachés aux chaînes de CHEVILLE. Il a été suggéré que les chaînes de CHEVILLE entraînaient une mobilité élevée des protéines et, par conséquent, ne pouvaient pas être scannées (Bendas et al., 1999). Inversement, Anabousi et al ont montré que l’incorporation de lipides pégylés dans les liposomes induisait une stabilisation stérique avec des liposomes conservant une forme sphérique (Anabousi et al., 2005). Les images AFM de la surface des liposomes non conjugués étaient lisses et aucune structure n’a pu être observée, tandis que la conjugaison de la transferrine à la surface des liposomes pégylés était visualisée sous forme de petites structures globulaires (Anabousi et al., 2005). De même, Moutardier et al ont fabriqué des liposomes avec des noyaux polymères (LSP) constitués de médicaments chargés dans des particules polymères formant le noyau des vésicules lipidiques (Moutardier et al., 2003). Les images prises à l’aide de l’AFM ont montré la présence d’un réseau polymère sur la surface extérieure, ce qui suggère que le noyau polymère de collagène rayonnait et formait une couche superficielle sur le LSP (Moutardier et al., 2003). En plus des détails structurels de la surface, l’AFM peut fournir des informations sur les propriétés mécaniques et chimiques d’une surface d’échantillon grâce à des mesures de force (Ruozi et al., 2007). Par exemple, Mao et al. utilisé cette technique pour évaluer l’élasticité et les propriétés adhésives des liposomes (Mao et al., 2004). L’une des limites de l’AFM est la nécessité d’adsorber les nanoparticules sur les surfaces de support, telles que le mica ou les plaquettes de silicium. L’adsorption de liposomes sur un substrat solide a le potentiel de modifier la taille et la forme des vésicules, et de provoquer leur aplatissement. (Ruozi et coll., 2007). De plus, le contact périodique de la pointe de sondage peut entraîner les liposomes lorsqu’ils se déplacent à travers les vésicules d’un échantillon (Jass et al., 2000). Malgré cela, l’AFM reste un outil utile dans l’évaluation des liposomes.
Conclusion
Il existe un large éventail de techniques d’imagerie disponibles pour évaluer la morphologie des liposomes, chacune ayant ses propres avantages et inconvénients. La microscopie optique peut fournir des détails généraux concernant la taille et la forme de vésicules plus grandes et l’homogénéité d’un échantillon de manière relativement rapide. Inversement, la TEM est la technique la plus couramment utilisée pour examiner beaucoup plus en détail la morphologie des liposomes; cependant, le potentiel de changements structurels avec chaque sous-type de TEM en raison de la coloration et / ou de l’exposition à des conditions de vide doit être pris en compte lors de l’interprétation des résultats. L’ESEM est particulièrement utile pour déterminer les changements liposomiques en réponse à l’environnement, alors que l’AFM apparaît comme une méthode utile dans l’analyse morphologique des nanoparticules et fournit une résolution maximale de la surface liposomique. L’AFM et le TEM sont tous deux capables d’imager des ligands conjugués à la surface des liposomes et fournissent des informations complémentaires sur les modifications de surface. Dans l’ensemble, le choix de la technique dépend des caractéristiques morphologiques et du degré de détail requis. De plus, il est important de comprendre les effets potentiels de la méthode de préparation des échantillons de chaque technique d’imagerie dans le processus de sélection.
Contributions de l’auteur
Rédaction du manuscrit: A-LR et SH. Révision critique de l’article pour son contenu intellectuel important: SH, PD, JF, WP, AM, DS et AW.
Déclaration sur les conflits d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Les auteurs souhaitent remercier le Pharmacy Research Trust of New South Wales, la Rebecca L. Cooper Medical Research Foundation, la Gladys M. Brawn Fellowship, la ausEE Research Foundation et l’Université de Newcastle pour leur soutien financier à nos recherches.
Adler, K., et Schiemann, J. (1985). Caractérisation des liposomes par microscopie électronique à balayage et technique de gel-fracture. Micron Microsc. Acta 16, 109-113. doi: 10.1016/0739-6260(85)90039-5
CrossRef Texte intégral|Google Scholar
Almgren, M., Edwards, K. et Karlsson, G. (2000). Microscopie électronique à transmission cryogénique des liposomes et des structures connexes. Les colloïdes Surfent. Un Physico-chimie. Eng. ASP. 174, 3–21. doi: 10.1016/S0927-7757 (00) 00516-1
CrossRef Texte intégral/Google Scholar
Anabousi, S., Laue, M., Lehr, C. M., Bakowsky, U., et Ehrhardt, C. (2005). Evaluating transferrin modification of liposomes by atomic force microscopy and transmission electron microscopy. EUR. J. Pharm. Biopharmaceutique. 60, 295–303. doi: 10.1016/j.ejpb.2004.12.009
Résumé PubMed |CrossRef Texte intégral/Google Scholar
Bagatolli, L.A. (2009). Membranes et microscopie à fluorescence. Avis en fluorescence 2007. New York, NY : Springer, 33-51. doi:10.1007/978-0-387-88722-7_2
CrossRef Texte intégral/Google Scholar
Bakker-Woudenberg, I. A., Storm, G., et Woodle, M. C. (1994). Liposomes dans le traitement des infections. J. Cible de drogue. 2, 363–371. doi: 10.3109/ 10611869408996811
Résumé publié/Texte intégral croisé/Google Scholar
Bendas, G. (2001). Immunoliposomes: une approche prometteuse pour cibler le traitement du cancer. BioDrugs 15, 215-224. doi: 10.2165/00063030-200115040-00002
CrossRef Texte intégral/Google Scholar
Bendas, G., Krause, A., Bakowsky, U., Vogel, J., et Rothe, U. (1999). Ciblabilité de nouveaux immunoliposomes préparés par une nouvelle technique de conjugaison d’anticorps. Int. J. Pharm. 181, 79–93. doi:10.1016/S0378-5173 (99) 00002-2
Résumé publié|Texte intégral croisé|Google Scholar
Bibi, S., Kaur, R., Henriksen-Lacey, M., McNeil, S. E., Wilkhu, J., Lattmann, E., et al. (2011). Imagerie microscopique des liposomes : des lamelles de couverture au MEB environnemental. Int. J. Pharm. 417, 138–150. doi: 10.1016/ j. ijpharm.2010.12.021
Résumé publié / Texte intégral croisé |Google Scholar
Bouvrais, H., Pott, T., Bagatolli, L.A., Ipsen, J. H. et Meleard, P. (2010). Impact of membrane-anchored fluorescent probes on the mechanical properties of lipid bicayers. Biochimie. Biophys. Acta 1798, 1333-1337. doi: 10.1016/ j.bbamem.2010.03.026
Résumé PubMed /Texte intégral CrossRef/Google Scholar
Cullis, P. R., Chonn, A., et Semple, S. C. (1998). Interactions des liposomes et des systèmes porteurs à base de lipides avec les protéines sanguines: relation avec le comportement de clairance in vivo. Adv. Livraison de médicaments. Rév. 32, 3-17. doi: 10.1016/S0169-409X(97) 00128-2
Résumé publié|Texte intégral croisé|Google Scholar
Ding, B. S., Dziubla, T., Shuvaev, V. V., Muro, S. et Muzykantov, V. R. (2006). Systèmes d’administration de médicaments avancés qui ciblent l’endothélium vasculaire. Mol. Interv. 6, 98–112. doi: 10.1124/ mi.6.2.7
Résumé PubMed / Texte intégral CrossRef /Google Scholar
Henry, C. R. (2005). Morphologie des nanoparticules supportées. Prog. Surf. Sci. 80, 92–116. doi: 10.1016/j.progsurf.2005.09.004
CrossRef Texte intégral/Google Scholar
Hua, S. (2013). Ciblage des sites d’inflammation: molécule d’adhésion intercellulaire-1 comme cible pour de nouvelles thérapies inflammatoires. Devant. Pharmacol. 4:127. doi: 10.3389/ fphar.2013.00127
Résumé PubMed | Texte intégral CrossRef/Google Scholar
Hua, S., Marks, E., Schneider, J. J. et Keely, S. (2015). Avancées dans les systèmes de nano-administration orale pour l’administration ciblée de médicaments du côlon dans les maladies inflammatoires de l’intestin: ciblage sélectif des tissus malades par rapport aux tissus sains. Nanomédecine 11, 1117-1132. doi: 10.1016/j. nano.2015.02.018
Résumé PubMed |Texte intégral CrossRef/Google Scholar
Hua, S., et Wu, S. Y. (2013). L’utilisation de nanocarriers à base de lipides pour des thérapies ciblées contre la douleur. Devant. Pharmacol. 4:143. doi: 10.3389/ fphar.2013.00143
Résumé publié par PubMed | Texte intégral croisé/Google Scholar
Ishida, T., Harashima, H. et Kiwada, H. (2001). Interactions des liposomes avec les cellules in vitro et in vivo: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L., Duportail, G., et al. (2009). Visualisation de domaines lipidiques dans des vésicules unilamellaires géantes à l’aide d’une sonde membranaire sensible à l’environnement à base de 3-hydroxyflavone. Biochimie. Biophys. Acta 1788, 495-499. doi: 10.1016/ j.bbamem.2008.10.019
Résumé PubMed |Texte intégral CrossRef/Google Scholar
Kuntsche, J., Horst, J. C. et Bunjes, H. (2011). Microscopie électronique à transmission cryogénique (cryo-TEM) pour l’étude de la morphologie des systèmes d’administration de médicaments colloïdaux. Int. J. Pharm. 417, 120–137. doi: 10.1016/ j. ijpharm.2011.02.001
Résumé publié / CrossRef Texte intégral |Google Scholar
Le Bihan, O., Bonnafous, P., Marak, L., Bickel, T., Trepout, S., Mornet, S., et al. (2009). Tomographie par cryo-électron de la transmigration des nanoparticules en liposome. J. Structure. Biol. 168, 419–425. doi: 10.1016/j.jsb.2009.07.006
Résumé PubMed /CrossRef Texte intégral/Google Scholar
Liang, X., Mao, G. et Ng, K. Y. (2004a). Mesure des propriétés mécaniques et de la stabilité du liposome contenant du cholestérol sur mica par microscopie à force atomique. J. Interface colloïdale Sci. 278, 53–62.
Résumé PubMed/Google Scholar
Liang, X., Mao, G. et Ng, K. Y. (2005). Effect of chain lengths of PEO-PPO-PEO on small unilamellar liposome morphology and stability: an AFM investigation. J. Interface colloïdale Sci. 285, 360–372. doi: 10.1016/j.jcis.2004.11.042
Résumé publié/Texte intégral croisé/Google Scholar
Liang, X., Mao, G. et Simon Ng, K. Y. (2004b). Sonder de petites vésicules d’EggPC unilamellaires à la surface du mica par microscopie à force atomique. Les colloïdes Surfent. B Biointerfaces 34, 41-51.
Résumé PubMed/Google Scholar
Mao, G., Liang, X. et Ng, K. Y. S. (2004). Encyclopédie des Nanosciences et des nanotechnologies. Il s’agit de Marcel Dekker.
Google Scholar
Mastrobattista, E., Koning, G. A., et Storm, G. (1999). Immunoliposomes pour l’administration ciblée de médicaments antitumoraux. Adv. Livraison de médicaments. Rév. 40, 103 à 127. doi:10.1016/S0169-409X(99) 00043-5
CrossRef Texte intégral/Google Scholar
Mertins, O., et Dimova, R. (2013). Informations sur les interactions du chitosane avec les vésicules phospholipidiques. Partie II: raidissement de la membrane et formation des pores. Langmuir 29, 14552-14559. doi: 10.1021/la4032199
Résumé publié|Texte intégral croisé/Google Scholar
Metselaar, J. M., et Storm, G. (2005). Liposomes dans le traitement des troubles inflammatoires. Avis d’expert. Livraison de drogue. 2, 465–476. doi: 10.1517/17425247.2.3.465
Résumé publié|Texte intégral croisé|Google Scholar
Mohammed, A. R., Weston, N., Coombes, A. G., Fitzgerald, M., et Perrie, Y. (2004). Formulation de liposomes de médicaments peu solubles dans l’eau: optimisation de la charge de médicaments et analyse ESEM de la stabilité. Int. J. Pharm. 285, 23–34. doi: 10.1016/ j. ijpharm.2004.07.010
Résumé PubMed |CrossRef Texte intégral/Google Scholar
Moutardier, V., Tosini, F., Vlieghe, P., Cara, L., Delpero, J. R., et Clerc, T. (2003). Biodisponibilité des médicaments anticancéreux colloïdaux dans les modèles d’administration orale. Int. J. Pharm. 260, 23–38. doi: 10.1016/S0378-5173(03) 00231-X
Résumé publié|Texte intégral croisé /Google Scholar
Murphy, D. B., et Davidson, M. W. (2012a). Microscopie Confocale à Balayage Laser. Principes fondamentaux de la Microscopie Optique et de l’Imagerie électronique, 2e Edn. Hoboken, New Jersey : John Wiley &Fils, 265-305. doi: 10.1002/9781118382905.ch13
CrossRef Texte intégral/Google Scholar
Murphy, D. B., et Davidson, M. W. (2012b). Microscopie à fluorescence. Principes fondamentaux de la Microscopie Optique et de l’imagerie électronique. Weinheim: John Wiley &Fils, 199-231. doi: 10.1002/9781118382905.ch11
CrossRef Texte intégral/Google Scholar
Murphy, D. B., et Davidson, M. W. (2012c). Principes fondamentaux de la Microscopie Optique et de l’imagerie électronique. Hoboken, New Jersey: John Wiley &Fils, 1-19. doi: 10.1002/ 9781118382905
CrossRef Texte intégral/Google Scholar
Murphy, D. B., et Davidson, M. W. (2012d). Microscopie à polarisation. Principes fondamentaux de la Microscopie Optique et de l’imagerie électronique. Hoboken, New Jersey: John Wiley &Fils, 153-171. doi:10.1002/9781118382905.ch9
CrossRef Texte intégral/Google Scholar
Muscariello, L., Rosso, F., Marino, G., Giordano, A., Barbarisi, M., Cafiero, G., et al. (2005). Un aperçu critique des applications ESEM dans le domaine biologique. J. Cell. Physiol. 205, 328–334. doi: 10.1002/jcp.20444
Résumé publié par PubMed / CrossRef Texte intégral |Google Scholar
Nallamothu, R., Wood, G. C., Pattillo, C. B., Scott, R. C., Kiani, M. F., Moore, B. M., et al. (2006). Un système d’administration de liposomes ciblé par vascularisation tumorale pour la combretastatine A4: conception, caractérisation et évaluation in vitro. AAP PharmSciTech 7: E32. doi: 10.1208/pt070232
Résumé publié/Texte intégral croisé/Google Scholar
Nirale, N. M., Vidhate, R. D., et Nagarsenker, M.S. (2009). Liposomes de propionate de fluticasone pour l’administration pulmonaire. L’Indien J. Pharm. Sci. 71, 709–711.
Google Scholar
Orlova, E. V., Sherman, MB, Chiu, W., Mowri, H., Smith, L. C. et Gotto, A. M. Jr. (1999). Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Forni, F., Fresta, M. et Vandelli, M. A. (2005). Microscopie à force atomique et spectroscopie de corrélation de photons: deux techniques de caractérisation rapide des liposomes. EUR. J. Pharm. Sci. 25, 81–89. doi: 10.1016/j.ejps.2005.01.020
Résumé PubMed |CrossRef Texte intégral/Google Scholar
Ruozi, B., Tosi, G., Leo, E. et Vandelli, M.A. (2007). Application de la microscopie à force atomique pour caractériser les liposomes comme porteurs de médicaments et de gènes. Talanta 73, 12-22. doi: 10.1016 / j. talanta.2007.03.031
Résumé PubMed / CrossRef Texte intégral /Google Scholar
Ruozi, B., Tosi, G., Tonelli, M., Bondioli, L., Mucci, A., Forni, F., et al. (2009). Imagerie de phase AFM d’échantillons hydratés en douceur: un outil polyvalent pour compléter l’étude physico-chimique des liposomes. J. Liposome Res. 19, 59-67. doi: 10.1080/08982100802584071
Résumé PubMed/Texte intégral CrossRef/Google Scholar
Sawant, R. R., et Torchilin, V.P. (2012). Défis dans le développement de thérapies liposomales ciblées. AAP J. 14, 303-315. doi: 10.1208/s12248-012-9330-0
Résumé PubMed / Texte intégral CrossRef /Google Scholar
Senior, J. H. (1987). Destin et comportement des liposomes in vivo: examen des facteurs de contrôle. Crit. Rév. Ther. Syst de support de drogue. 3, 123–193.
Résumé publié par Google Scholar
Sercombe, L., Veerati, T., Moheimani, F., Wu, S. Y., Sood, A. K. et Hua, S. (2015). Progrès et défis de l’administration de médicaments assistée par liposome. Devant. Pharmacol. 6:286. doi: 10.3389/ fphar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
Résumé PubMed / Texte intégral CrossRef /Google Scholar
Torchilin, V.P. (1994). Immunoliposomes et immunoliposomes pégylés: utilisation possible pour l’administration ciblée d’agents d’imagerie. Immunométhodes 4, 244-258. doi: 10.1006/immu.1994.1027
Résumé PubMed | Texte intégral CrossRef /Google Scholar
Van Antwerpen, R., et Gilkey, J. C. (1994). La microscopie cryo-électronique révèle une sous-structure humaine de lipoprotéines de basse densité. J. Lipid Res. 35, 2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
Résumé PubMed / Texte intégral CrossRef /Google Scholar
Willis, M., et Forssen, E. (1998). Liposomes ciblés par ligand. Adv. Livraison de médicaments. Rév. 29, 249-271. doi: 10.1016/S0169-409X(97) 00083-5
CrossRef Texte intégral/Google Scholar
Zununi Vahed, S., Salehi, R., Davaran, S. et Sharifi, S. (2017). Systèmes de co-administration de médicaments à base de liposomes dans les cellules cancéreuses. Mater. Sci. Eng. C Mater. Biol. Appl. 71, 1327–1341. doi: 10.1016/j. msec.2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply