Frontiers in Oncology
Introduction
Environ 25% des patientes atteintes d’un cancer du sein précoce présentent encore une récidive locale et développent des métastases à distance après un traitement actif (1), et près de 10% des patientes sont en stade IV au diagnostic initial dans les pays développés, ce qui est appelé cancer du sein métastatique de novo (MBC) (2). Malgré les progrès du traitement, la MBC reste incurable et jusqu’à 70 à 80% des patients atteints de MBC meurent d’un cancer dans les 5 ans (2). En raison de l’hétérogénéité de la CBM, plusieurs modèles pronostiques basés sur des facteurs pronostiques ou des scores sont développés pour prédire leurs résultats cliniques et demander aux cliniciens de prendre les décisions thérapeutiques appropriées (3-5). En outre, il existe également une variété de modèles pronostiques pour le cancer du sein avec métastase cérébrale (BCBM) permettant aux cliniciens de prédire avec précision la survie de ces patientes (6, 7).
Le cancer du sein peut métastaser n’importe où dans le corps, mais principalement au poumon, aux os, au foie, aux ganglions lymphatiques non axillaires et au cerveau (8). Notamment, les métastases hépatiques (LM) sont non seulement un site métastatique commun, mais également associées à un risque de décès significativement accru, similaire aux métastases cérébrales, une mortalité disproportionnellement plus élevée par rapport aux métastases pulmonaires ou osseuses (5, 8). Comme l’évaluation pronostique graduée (GPA) est largement acceptée chez les patients atteints de BCBM, les modèles pronostiques susmentionnés nous incitent à proposer un modèle pratique pour la BCLM (3-7). Notre objectif était de construire un modèle pronostique fiable et convivial pour BCLM et d’évaluer sa concordance et sa précision en le validant à la fois en interne et en externe. Le modèle pronostique pourrait aider les cliniciens à estimer le risque de décès des patients atteints de MCBB et à choisir un traitement optimal.
Patients et méthodes
Sélection des patients
La présente étude a été approuvée par les comités d’éthique indépendants du FUSCC. Des patients MBC consécutifs diagnostiqués au FUSCC de janvier 2007 à décembre 2018 ont été identifiés (n = 9 062). Les critères d’admissibilité étaient les suivants: (1) cancer du sein confirmé histologiquement, (2) patientes, (3) le foie comme premier site de maladie métastatique dans un cancer du sein métastatique ou récurrent de novo, et (4) dossiers complets et détaillés. Les patientes atteintes d’un cancer du sein bilatéral, d’autres néoplasmes invasifs ou ayant un suivi inconnu ont été exclues. Enfin, 1 022 patients admissibles ont été sélectionnés pour une analyse plus approfondie. Les étapes complètes de sélection sont représentées sur la figure S1.
Étude des variables et Sélection des valeurs de coupure
Des informations ont été recueillies sur les variables clinicopathologiques suivantes: âge, sous-types moléculaires, informations sur le traitement antérieur (chirurgie et chimiothérapie systémique), IMF, sites de métastases extrahépatiques (cerveau, poumon, os et ganglions lymphatiques), caractéristiques des métastases hépatiques (distribution, nombre, diamètre maximal), hémoglobine (HB), tests de la fonction hépatique et temps de survie. Les sous-types moléculaires comprenaient le statut de récepteur hormonal (HR) et de récepteur du facteur de croissance épidermique humain 2 (HER2). Nous avons défini l’IMF comme l’intervalle entre la date du diagnostic du cancer du sein primaire et la date de la première métastase à distance. Les seuils d’IMF utilisés dans cette étude étaient de 3 et 24 mois selon la référence (9). Par conséquent, les patients pourraient être divisés en trois groupes: les patients atteints de MBC de novo (MFI < 3 mois), les patients avec une MFI courte (≤ 24 mois) et les patients avec une MFI longue > 24 mois. La métastase des ganglions lymphatiques distants a été définie comme une métastase des ganglions lymphatiques axillaires ipsilatéraux, supraclaviculaires, infraclaviculaires ou mammaires internes. Le diagnostic de LM était basé sur l’imagerie radiographique ou des preuves pathologiques. Les caractéristiques des métastases hépatiques ont été évaluées à l’aide de tomodensitométrie abdominale (TDM), d’imagerie par résonance magnétique (IRM) ou d’échantillons de résection chirurgicale. Des tests de la fonction hépatique ont également été analysés dans la présente étude, notamment la bilirubine totale, l’alanine aminotransférase (ALT), l’aspartate aminotransférase (AST), la phosphatase alcaline (ALP), la lactate déshydrogénase (LDH) et le rapport γ-glutamyl transférase sur albumine (GAR). Des échantillons de sang ont été prélevés pour des tests de laboratoire dans la semaine suivant le diagnostic de LM. Les classifications de la distribution, du nombre ou du diamètre maximal des métastases hépatiques et de la LDH étaient basées sur d’autres études (10-13). Les valeurs limites pour l’HB, la bilirubine totale, l’ALAT, l’ASAT et l’ALP ont été déterminées selon les Critères de terminologie commune pour les événements indésirables (CTCAE), car des anomalies modérées ou de grade II des taux d’hémoglobine ou de la fonction hépatique pourraient influencer les choix thérapeutiques (14). La valeur de GAR a été définie comme un rapport simple entre le taux de sérumy-glutamyl transférase (GGT, U/L) et le taux d’albumine sérique (ALB g/L). L’OS du moment de la métastase a été mesuré à partir de la date du diagnostic de LM jusqu’à la mort pour n’importe quelle cause. La dernière période de suivi remonte à novembre 2019, avec une période médiane de suivi de 18,63 mois. Si les patients étaient perdus pour le suivi, il était censuré le dernier jour de suivi.
Analyse statistique
Les patients ont été divisés en formation (2007-2016, n = 715) et validation (2016-2018, n = 307) dans un rapport de 7:3. La valeur de coupure optimale pour le GAR a été choisie par le calcul de l’indice de Youden et de l’analyse de la courbe caractéristique de fonctionnement du récepteur (ROC) (Figure S2). Le test du chi carré de Pearson ou le test exact de Fisher a été utilisé pour faire une comparaison entre les variables catégorielles. Des modèles de régression des risques proportionnels de Cox avec la méthode de sélection arrière ont été utilisés pour l’analyse multivariée et pour calculer les rapports de risque. Les coefficients de régression ont été calculés par analyse de régression multivariée, puis multipliés par 10 et arrondis pour représenter les scores pronostiques finaux. L’amorçage a été utilisé pour la validation interne. Ensuite, des courbes ROC et des graphiques d’étalonnage en fonction du temps ont été utilisés pour évaluer la discrimination et l’étalonnage de ce modèle pronostique dans l’ensemble de validation. Les valeurs limites des groupes à risque ont été déterminées par des diagrammes en X (15). L’analyse de la survie a été réalisée à l’aide de courbes de survie de Kaplan-Meier, et des tests de rang log ont été utilisés pour comparer les courbes de survie. Toutes les valeurs de P étaient recto-verso et les valeurs de P< 0,05 étaient considérées comme statistiquement significatives. L’analyse statistique a été réalisée à l’aide du logiciel SPSS (SPSS 20, Chicago, IL, USA) et du logiciel R version 4.0.1.
Résultats
Caractéristiques et relation avec la stratification du risque
Un total de 1 022 patients sélectionnés dans cette étude ont été divisés en ensembles d’entraînement (n = 715) et de validation (n = 307). Une description des caractéristiques clinicopathologiques est donnée dans le tableau 1 et le tableau S1. Dans le groupe de formation, il y avait 126 patients (17,6%) diagnostiqués avec une MBC de novo et 589 patients (82,4%) avec une MBC récurrente, dont 297 patients (50,4%) avaient une MFI courte et 292 patients (49,6%) avaient une MFI longue. L’âge médian au diagnostic de LM était de 50 (plage de 21 à 87) ans avec 617 patients (86.3%) de moins de 60 ans. Parmi ces patients, la proportion de patients HR positifs et HER2 positifs était respectivement de 62,2 et 38,0%. Parmi les patients atteints de MBC récurrents, presque tous les patients ont subi une intervention chirurgicale sur la tumeur primitive (584, 99,2%) et ont reçu une chimiothérapie adjuvante (néo) (569, 96,6%). Les schémas de métastases à distance ont montré que le site le plus fréquent de métastases extrahépatiques était l’os (42,7%) suivi des ganglions lymphatiques distants (36,1%), des poumons (25,6%) et du cerveau (2,9%). Les métastases hépatiques étaient caractérisées par une distribution diffuse et de petits nodules, dont la majorité étaient multiples (≥3 métastases, 77,3%) mais de petits nodules (≤3 cm, 59,4%) et impliquaient des lobes droit et gauche (74,4%). Au stade précoce de la LM, la fonction hépatique était altérée à des degrés divers, mais généralement légère. L’augmentation de la LDH (36,1%) et de la GAR (35,9%) semblait être des indicateurs sensibles de dysfonctionnement hépatique, et des anomalies modérées ou supérieures aux taux d’HB (2,9%), de bilirubine totale (2,7%), d’ALT (3,6%), d’AST (9,5%) et d’ALP (3,9%) étaient rares selon le CTCAE. Par rapport au groupe à faible risque, le groupe à risque intermédiaire et élevé présentait un taux plus élevé de négativité HR et HER2, une IMF courte, des métastases extrahépatiques, une charge tumorale de métastase hépatique et des anomalies du taux d’hémoglobine ou de la fonction hépatique (tous Ps ≤ 0,001), suggérant que ces facteurs pourraient affecter le pronostic de la BCLM.
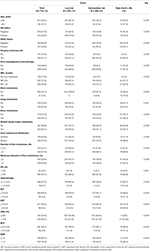
Tableau 1. Caractéristiques de base et sa relation avec la stratification des risques de l’ensemble de formation.
Modèle pronostique et validation
Dans le modèle de régression multivariée de Cox, les sous-types moléculaires (statut HR et HER2), l’IMF, les sites de métastases extrahépatiques (métastases cérébrales, pulmonaires et osseuses) et les tests de la fonction hépatique (bilirubine totale, LDH et GAR) ont été associés à l’OS (tableau 2). Plus précisément, le risque de décès des patients HR négatifs (HR 1,740, IC à 95% 1,424–2,127, P < 0,001) et HER2 négatifs (HR 1,615, IC à 95% 1,316–1,983, P < 0,001) a augmenté par rapport à HR ou HER2 homologues positifs. La durée de l’IMF a également eu un impact significatif sur la survie des patients BCLM, et par conséquent, la survie des patients avec une IMF longue (HR 1.612, IC à 95% 1.195–2.174, P < 0.001) a été raccourcie par rapport aux patients atteints de MBC de novo et aux patients avec une IMF courte (HR 2.563, IC à 95% 1.904– 3.449, P < 0.001) avait plus de deux fois le risque de décès par rapport à eux. De plus, la présence de métastases extrahépatiques (métastases cérébrales, pulmonaires et osseuses) et une fonction hépatique anormale (bilirubine totale, LDH et GAR) étaient toutes corrélées à un impact pronostique défavorable sur l’OS. Ce modèle pronostique avait l’aire sous la courbe (ASC) du ROC dépendant du temps à 1 an d’OS avec 0,78 dans l’ensemble d’entraînement et 0,80 dans l’ensemble de validation, indiquant que ce modèle avait une bonne discrimination (Figure 1). La méthode d’amorçage a été utilisée pour confirmer la stabilité de notre modèle pronostique dans l’ensemble d’entraînement, et les résultats finaux ont été plutôt robustes (tableau S2). Les courbes d’étalonnage du modèle pronostique pour 1 an et 3 ans d’OS dans l’ensemble d’entraînement ainsi que 1 an d’OS dans l’ensemble de validation ont montré sa bonne concordance (Figure 2).

Tableau 2. Modèle de régression de Cox multivarié (ensemble d’entraînement).
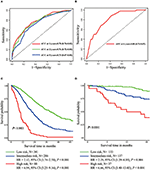
Figure 1. Courbes ROC dépendantes du temps du modèle pronostique dans l’ensemble d’entraînement (A) et l’ensemble de validation (B). Survie globale des métastases des trois groupes pronostiques de l’entraînement (C) et de l’ensemble de validation (D).
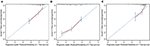
Figure 2. La courbe d’étalonnage pour prédire la survie du patient à 1 an (A) et 3 ans (B) dans l’ensemble d’entraînement et à 1 an (C) dans l’ensemble de validation.
Stratification des risques et survie

Tableau 3. Calcul du score et des points de coupure des groupes pronostiques.
Discussion
Dans la présente analyse de 1 022 patients traités dans notre établissement de 2007 à 2018, nous avons montré que les sous-types moléculaires (statut HR et HER2), les IMF, les sites de métastases extrahépatiques (métastases cérébrales, pulmonaires et osseuses), les tests de la fonction hépatique (bilirubine totale, LDH et GAR) étaient pronostiques indépendants facteurs de patients BCLM. Par conséquent, un modèle pronostique pour les patients BCLM a été construit en utilisant des facteurs pronostiques.
En ce qui concerne les sous-types moléculaires, HR positive peut indiquer que la croissance et la prolifération du cancer du sein sont toujours régulées par des hormones, appelées tumeurs hormono-dépendantes. Dans le même temps, la thérapie endocrinienne présente des avantages, notamment peu d’effets indésirables et d’effets à long terme, ce qui peut souvent apporter des avantages de survie à long terme aux patients HR-positifs. Par conséquent, HR positif a été considéré comme un facteur significatif suggérant un pronostic favorable dans le cancer du sein précoce et métastatique (1, 3-5, 8-10, 16). Bien que l’amplification et la surexpression de HER2 soient considérées comme un prédicteur d’un risque de métastases à distance et de décès liés au cancer du sein, les agents anti–HER2 développés par la suite ont considérablement amélioré la survie des patientes atteintes d’un cancer du sein positif à HER2 (2, 9, 17). À l’ère de la thérapie ciblée, une étude menée dans le sud-est des Pays–Bas a révélé que le risque de mortalité des patients HER2-négatifs était augmenté de 44% (IC à 95% de 1,13 à 1,83, P = 0,003) par rapport aux patients HER2 positifs (9). Dans notre étude, le risque de décès des patients HR-négatifs et HER2-négatifs a augmenté par rapport à leurs homologues HR ou HER2-positifs, conformément à ces observations. Les patients présentant une IMF courte, généralement définie comme ≤24 mois, avaient un pronostic plus mauvais (3, 5, 9). De plus, les patients atteints de MBC de novo semblaient avoir un pronostic nettement meilleur par rapport aux patients atteints de MBC récurrents, bien que cette différence ait été progressivement réduite avec l’extension de l’intervalle sans maladie (DFI) ou MFI (9, 18, 19). Lobbezoo et coll. a constaté que les patients présentant une IMF ≤24 mois avaient un temps de survie significativement plus court (9,1 vs 29.4 mois, P < 0,001) que ceux atteints de maladies de stade IV de novo, mais les patients ayant une IMF plus longue (> 24 mois) avaient un pronostic similaire (27,9 contre 29,4 mois, P = 0,73) (9). La raison possible de ce phénomène est que les patients présentant une CBM en rechute subissant auparavant un traitement systématique peuvent être plus résistants à la chimiothérapie que les patients naïfs de traitement avec une CBM de novo, mais une enquête plus approfondie est justifiée (9, 18, 19). Cette étude a confirmé que le temps de survie des patients avec une IMF longue était raccourci par rapport à la MBC de novo, les patients avec une IMF courte conférant un résultat significativement pire.
La survie en MBC différait significativement selon les sites métastatiques et les patients atteints de métastases viscérales étaient associés à un risque accru de mortalité par rapport à ceux atteints de métastases non viscérales (3-5, 9, 18). De plus, la présence de métastases cérébrales a eu un impact plus important sur la survie que tout autre site métastatique (3, 5, 9, 18). Il n’était pas surprenant que les métastases multiples aient eu une influence plus défavorable sur le pronostic (3, 5, 9, 17, 18). Dans cette analyse, les métastases extrahépatiques, à l’exception des métastases de ganglions lymphatiques distants, pourraient entraîner une survie raccourcie, probablement parce que les métastases hépatiques étaient le facteur mettant le pronostic vital en danger par rapport aux métastases ganglionnaires.
Il convient de noter que les patients présentant des taux de bilirubine plus élevés présentaient un risque beaucoup plus faible de plusieurs maladies, en partie grâce à ses propriétés antioxydantes et anti-inflammatoires (20). Une étude récente a également rapporté qu’une réduction de près de 40% du risque de décès a été observée chez les patientes atteintes d’un cancer du sein précoce présentant un taux de bilirubine totale plus élevé (21). Cependant, l’hyperbilirubinémie était associée à un mauvais pronostic chez les patients atteints de BCLM (22). Il est possible que, contrairement à la bilirubine totale relativement élevée chez les patientes atteintes d’un cancer du sein non métastatique, une augmentation de la bilirubine 1,5 fois supérieure à la limite supérieure de la normale (LSN) chez les patientes atteintes d’un cancer du sein non métastatique puisse prédire une lésion hépatique grave et, par conséquent, contribuer à l’arrêt du médicament ou à l’encéphalopathie hépatique.
L’effet Warburg pousse les cellules cancéreuses à dépendre de la glycolyse aérobie même lorsque l’apport en oxygène est suffisant, ce qui est la caractéristique du métabolisme du cancer contrairement aux tissus normaux (23). La LDH joue un rôle indispensable dans la glycolyse en raison de sa capacité à convertir le pyruvate en lactate en conditions anaérobies (24). Les niveaux dérégulés de LDH pourraient refléter une charge tumorale plus élevée, une réponse au traitement plus faible et un pronostic plus faible, qui avaient déjà été rapportés dans plusieurs tumeurs (21, 24-26). Une méta-analyse sur l’effet pronostique de la LDH chez les patientes atteintes d’un cancer du sein a montré que des taux de LDH plus élevés entraînaient une OS insatisfaisante et une survie sans progression, qui comprenait 11 études portant sur 6 102 patientes (27).
Le GGT, principal antioxydant endogène, assimile les acides aminés précurseurs et participe à la synthèse du glutathion (28). La GGT dans les tumeurs permet aux cellules de reconstituer rapidement le glutathion après avoir reçu un traitement anticancéreux pro-oxydant et est donc corrélée à une résistance aux médicaments et à une faible survie (29). Fait intéressant, Fentiman et coll. ont signalé qu’une relation significativement positive a été identifiée entre une GGT élevée et un risque de cancer du sein (30). L’ALB synthétisé par le foie fonctionne comme un antioxydant, un transporteur de nutriments et participe aux voies de signalisation en raison de ses propriétés structurelles uniques (31). L’hypoalbuminémie survient généralement chez les patients atteints d’un cancer avancé et est attribuée à divers mécanismes, notamment une altération de la synthèse hépatique, un catabolisme accru et une cachexie (21, 31). L’hypoalbuminémie est un indicateur indépendant du mauvais pronostic de diverses tumeurs (21, 22, 32, 33). Contrairement à la diminution des taux sériques d’albumine, les taux sériques de GGT ont tendance à être élevés lorsque la fonction hépatique est altérée. Par conséquent, le GAR basé sur les deux paramètres ci-dessus peut avoir l’avantage de refléter la capacité de réserve hépatique et de prédire le pronostic (32, 33). Dans la présente étude, une fonction hépatique anormale (bilirubine totale, LDH et GAR) était toutes corrélée à un impact pronostique défavorable sur l’OS.
Après avoir analysé le pronostic de 123 patients atteints de BCLM, Duan et al. a constaté que les patients présentant trois métastases hépatiques ou plus portaient 2.risque de décès 26 fois plus élevé par rapport aux patients présentant <3 métastases hépatiques en analyse multivariée (10). Cependant, les caractéristiques des métastases hépatiques dans cette étude ne semblaient pas faire de différence. Deux raisons pourraient contribuer à cet écart. Tout d’abord, la distribution, le nombre et le diamètre maximal des métastases hépatiques étaient significativement différents dans les trois groupes à risque, indiquant que le risque de mortalité augmentait avec l’expansion des métastases hépatiques dans l’analyse univariée. Par la suite, une fonction hépatique anormale était étroitement liée à la charge tumorale des métastases hépatiques, ajustant le rôle de ces facteurs dans l’analyse multivariée.
Il y a eu de nombreuses études sur les facteurs pronostiques dans le cadre de la BCLM. Une analyse de 145 patients atteints de BCLM a montré que l’hypoalbuminémie, l’âge avancé et la négativité de l’ER étaient des prédicteurs indépendants d’une mauvaise survie (22). Une analyse du registre grec a obtenu des résultats similaires, dans lesquels la positivité HR, le faible grade histologique, l’absence de métastases extrahépatiques et un bon état de performance étaient des facteurs pronostiques significatifs pour un pronostic favorable dans une analyse univariée (34). Une étude récente basée sur la population comprenant plus de 4 000 patients atteints de MCB de novo a identifié des facteurs démographiques et socio-économiques, un grade pathologique, le nombre total de métastases extrahépatiques, le traitement et le sous-type moléculaire comme paramètres influençant de manière significative la survie globale (17). Regierer et coll. développement d’un score pronostique pour le MBC basé sur le statut HR, l’IMF et les sites de métastases pour prédire leur pronostic et individualiser un traitement optimal, qui a été validé en interne et en externe (5). Malheureusement, le statut HER2 n’était pas inclus dans le score pronostique et limitait donc son applicabilité. La GPA mammaire modifiée pour les patientes atteintes de BCBM intégrant quatre paramètres cliniques simples a eu un rôle immédiat dans la prédiction de leur survie, mais n’était pas applicable pour les patientes atteintes de BCLM (7). À notre connaissance, il n’y a pas de modèle pronostique qui intègre ces facteurs pronostiques pour les patients atteints de MCBB, donc notre modèle a un sens pragmatique.
Cette recherche présentait également certaines limites. Premièrement, une étude monocentrique et rétrospective a inévitablement entraîné un biais de sélection bien que notre modèle pronostique ait été validé en interne et en externe. Deuxièmement, les patients qui ont développé des métastases hépatiques plus tard dans l’évolution de la maladie ont été exclus, de sorte que nous n’avons pas pu évaluer ces patients. Troisièmement, des informations détaillées sur l’état de performance et le traitement n’étaient pas disponibles dans cette étude.
Conclusions
Malgré ces limites, cette recherche peut fournir un modèle pronostique simple et fiable. L’avantage majeur de notre étude est l’incorporation de paramètres facilement accessibles en pratique clinique sur la base du large échantillon de patients BCLM. En plus d’une classification exquise des tumeurs selon des méthodes de séquençage de nouvelle génération, notre modèle peut aider à identifier des sous-groupes avec un pronostic différent et guider le traitement ultérieur.
Déclaration de disponibilité des données
Les contributions originales présentées dans l’étude sont incluses dans l’article / le matériel supplémentaire, des demandes de renseignements supplémentaires peuvent être adressées au / aux auteur(s) correspondant(s).
Déclaration d’éthique
La présente étude a été approuvée par les comités d’éthique indépendants du FUSCC. Les patients / participants ont fourni leur consentement éclairé écrit pour participer à cette étude.
Contributions des auteurs
LJ a proposé l’étude. XZ et YG ont collecté les données. LJ et LF ont analysé les données et rédigé la première ébauche. ZW a examiné le manuscrit de manière critique. Tous les auteurs ont contribué à l’article et ont approuvé la version soumise.
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions Lei Cheng d’avoir effectué une analyse de données.
Matériel supplémentaire
Abréviations
BCLM, cancer du sein avec métastases hépatiques; FUSCC, Centre du cancer de l’Université Fudan de Shanghai; ROC, courbe caractéristique de fonctionnement du récepteur; IMF, intervalle sans métastase; HR, rapport de risque; IC, intervalle de confiance; OS, survie globale; MBC, cancer du sein métastatique; BCBM, cancer du sein avec métastase cérébrale; LM, métastase hépatique; GPA, évaluation pronostique graduée; HB, hémoglobine; HR, récepteur hormonal; HER2, récepteur du facteur de croissance épidermique humain 2; CT, tomographie informatisée; IRM, imagerie par résonance magnétique; ALT, alanine aminotransférase; AST, aspartate aminotransférase; ALP, phosphatase alcaline; LDH, lactate déshydrogénase; GAR, rapport γ-glutamyl transférase sur albumine; GGT, γ-glutamyl transférase; ALB, albumine; CTCAE, Critères terminologiques communs pour les événements indésirables; LSN, limite supérieure de la normale.
4. Puente J, Lopez-Tarruella S, Ruiz A, Lluch A, Pastor M, Alba E, et al. Index pronostique pratique pour les patientes atteintes d’un cancer du sein récurrent métastatique: analyse rétrospective de 2 322 patientes du registre espagnol El Alamo de GEICAM. Le cancer du sein Res Traiter. (2010) 122:591–600. doi: 10.1007/s10549–009-0687–4
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Regierer AC, Wolters R, Ufen MP, Weigel A, Novopashenny I, Kohne CH, et al. An internally and externally validated prognostic score for metastatic breast cancer: analysis of 2269 patients. Ann Oncol. (2014) 25:633–8. doi: 10.1093/annonc/mdt539
PubMed Abstract | CrossRef Full Text
6. Marko NF, Xu Z, Gao T, Kattan MW, Weil RJ. Prédire la survie chez les femmes atteintes d’un cancer du sein et de métastases cérébrales: un nomogramme surpasse les modèles actuels de prédiction de la survie. Cancer. (2012) 118:3749–57. doi: 10.1002/ cncr.26716
Résumé publié/Texte intégral croisé/Google Scholar
7. Subbiah IM, Lei X, Weinberg JS, Sulman EP, Chavez-MacGregor M, Tripathy D, et al. Validation et développement d’une évaluation pronostique graduée mammaire modifiée comme outil de survie chez les patientes atteintes d’un cancer du sein et de métastases cérébrales. J Clin Oncol. (2015) 33:2239–45. doi: 10.1200/JCO.2014.58.8517
Résumé publié|Texte intégral croisé/Google Scholar
9. Il s’agit d’un groupe de travail sur les technologies de l’information et de la communication. Pronostic du cancer du sein métastatique: existe-t-il des différences entre les patientes atteintes d’un cancer du sein métastatique de novo et récurrent? Br J Cancer. (2015) 112:1445–51. doi: 10.1038/bjc.2015.127
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Duan XF, Dong NN, Zhang T, Li Q. The prognostic analysis of clinical breast cancer subtypes among patients with liver metastases from breast cancer. Int J Clin Oncol. (2013) 18:26–32. doi: 10.1007/s10147–011-0336-x
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dueck AC, Mendoza TR, Mitchell SA, Reeve BB, Castro KM, Rogak LJ, et al. Validité et fiabilité de la Version des Résultats déclarés par les patients de l’Institut National du Cancer des États-Unis des Critères Terminologiques Communs pour les événements indésirables (PRO-CTCAE). JAMA Oncol. (2015) 1:1051–9. doi: 10.1001 / jamaoncol.2015.2639
Résumé publié|Texte intégral croisé/Google Scholar
17. Xie J, Xu Z. A Population-Based Study on Liver Metastases in Women with Newly Diagnosed Breast Cancer. Biomarqueurs Épidémiologiques du cancer Précédent. (2019) 28:283–92. doi: 10.1158/1055–9965.EPI-18–0591
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dawood S, Broglio K, Ensor J, Hortobagyi GN, Giordano SH. Survival differences among women with de novo stage IV and relapsed breast cancer. Ann Oncol. (2010) 21:2169–74. doi: 10.1093/annonc/mdq220
PubMed Abstract | CrossRef Full Text
19. den Brok WD, Speers CH, Gondara L, Baxter E, Tyldesley SK, Lohrisch CA. Survie avec cancer du sein métastatique basée sur la présentation initiale, de novo versus rechute. Le cancer du sein Res Traiter. (2017) 161:549–56. doi: 10.1007/s10549–016-4080–9
Résumé publié|Texte intégral croisé|Google Scholar
20. Fujiwara R, Haag M, Schaeffeler E, Nies AT, Zanger UM, Schwab M. Régulation systémique de l’homéostasie de la bilirubine: avantages potentiels de l’hyperbilirubinémie. Hépatologie. (2018) 67:1609–19. doi: 10.1002/hep.29599
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Liu X, Meng QH, Ye Y, Hildebrandt MAT, Gu J, Wu X. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer. Carcinogenesis. (2015) 36:243–8. doi: 10.1093/carcin/bgu247
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Vander Heiden MG, Cantley LC, Thompson CB. Comprendre l’effet Warburg: les exigences métaboliques de la prolifération cellulaire. Sciences. (2009) 324:1029–33. doi: 10.1126 / science.1160809
Résumé publié/Texte intégral croisé/Google Scholar
24. Mishra D, Banerjee D. Lactate déshydrogénases en tant que liens métaboliques entre la tumeur et le stroma dans le microenvironnement tumoral. Cancer. (2019) 11:750. doi: 10.3390/cancers11060750
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Pelizzari G, Basile D, Zago S, Lisanti C, Bartoletti M, Bortot L, et al. Lactate dehydrogenase (ldh) response to first-line treatment predicts survival in metastatic breast cancer: first clues for a cost-effective and dynamic biomarker. Cancers. (2019) 11:1243. doi: 10.3390/cancers11091243
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Hopkins AM, Rowland A, McKinnon RA, Sorich MJ. Predictors of long-term disease control and survival for HER2-positive advanced breast cancer patients treated with pertuzumab, trastuzumab, and docetaxel. Front Oncol. (2019) 9:789. doi: 10.3389/fonc.2019.00789
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Pentheroudakis G, Fountzilas G, Bafaloukos D, Koutsoukou V, Pectasides D, Skarlos D, et al. Cancer du sein métastatique avec métastases hépatiques: analyse du registre des caractéristiques clinicopathologiques, de gestion et de résultats de 500 femmes. Le cancer du sein Res Traiter. (2006) 97:237–44. doi: 10.1007/s10549–005-9117–4
Résumé publié|Texte intégral croisé |Google Scholar
Leave a Reply