Latence virale: En baisse mais pas en panne
Lorsque vous imaginez des virus se cachant de votre système immunitaire, vous pouvez penser au virus de l’herpès simplex, responsable des boutons de fièvre et de l’herpès génital, ou au virus de la varicelle-zona, qui cause le zona. Ces virus peuvent persister pendant des décennies dans un état d’hibernation appelé latence et éviter la détection par notre système immunitaire (Kennedy et al., 2015). Les virus latents peuvent parfois se réveiller et recommencer à se répliquer, provoquant des symptômes et propageant l’infection (Lieberman, 2016).
Le virus de l’immunodéficience humaine (VIH) est également un artiste de l’évasion. Il forme un réservoir latent au début de l’infection, permettant au virus d’échapper au système immunitaire et de survivre à long terme. Les personnes vivant avec le VIH prennent quotidiennement des médicaments appelés thérapie antirétrovirale combinée (ou TAR) pour empêcher le virus de se répliquer. Cependant, la TAR n’est pas un remède, car elle ne cible pas les virus déjà latents. Ces médicaments sont donc administrés pour la vie d’un individu: l’arrêt du traitement, même pendant quelques semaines, permettra aux virus latents de se réactiver et de raviver une infection active. Les personnes séropositives peuvent s’attendre à avoir une vie longue et saine grâce à la TAR, mais des virus latents seront toujours présents dans leur corps.
Trouver un remède contre le VIH nécessite de pouvoir éliminer ou contrôler le réservoir viral latent. Cependant, certaines questions clés doivent encore être abordées pour atteindre cet objectif. Comment, quand et où le VIH établit-il une latence? Quelle est la taille du réservoir latent et la meilleure façon de le mesurer? Qu’est-ce qui déclenche la réactivation des virus latents? Maintenant, dans eLife, Miles Davenport, Brandon Keele et des collègues de l’Université de Nouvelle-Galles du Sud et du Laboratoire national de recherche sur le cancer de Frederick – dont Mykola Pinkevych en tant que premier auteur – signalent quand le réservoir latent est établi dans un modèle de primate non humain du VIH et quelle partie du réservoir peut être réactivée (Pinkevych et al., 2019).
Dans cette étude, l’équipe a infecté des macaques rhésus avec le virus de l’immunodéficience simienne (SIV), un virus précurseur endémique chez les singes africains et génétiquement similaire au VIH (Williams et Burdo, 2009). À un moment donné au cours du 20e siècle, le VIS est passé de primates non humains à des humains; cet événement de transmission inter-espèces, associé à une évolution rapide, a permis au virus de se propager efficacement chez les humains et de créer la pandémie de VIH en cours (Keele et al., 2006).
Pinkevych et coll. a commencé par infecter les macaques rhésus avec un SIV conçu contenant plus de 10 000 séquences d’ADN randomisées uniques; une fois séquencés, ces « codes-barres » permettent d’identifier des virus individuels (Fennessey et al., 2017). Les singes ont ensuite été traités par un traitement antirétroviral 4, 10 ou 27 jours après l’infection. Ces intervalles simulent une intervention aiguë (4 jours), précoce (10 jours) ou tardive (27 jours) avec TAR chez l’homme. Les médicaments ont été administrés pendant environ un an et le virus a été complètement supprimé chez tous les animaux. Le traitement a ensuite été arrêté et le virus latent a pu se réactiver. En utilisant le séquençage génétique et la modélisation mathématique, l’équipe a déterminé la taille du réservoir latent de SIV et comment il se réactiverait.
Chez les singes, le début du traitement quatre jours après l’infection n’a pas bloqué la formation du réservoir latent, mais a réduit sa taille d’environ 100 fois par rapport à l’initiation ultérieure du TAR. De même, les personnes qui commencent le traitement antirétroviral dans les jours suivant l’acquisition du VIH ont un réservoir extrêmement petit par rapport à celles qui commencent le traitement plus tard (Luzuriaga et al., 2015; Henrich et coll., 2017). Malgré ces grandes différences dans la taille globale du réservoir, une fois la TAR arrêtée, les virus latents se sont réactivés à des taux similaires chez les animaux traités de façon aiguë, précoce et tardive (figure 1). Pinkevych et coll. par conséquent, concluez que la majorité des virus qui ont le potentiel de se réactiver établissent une latence tôt après l’infection.
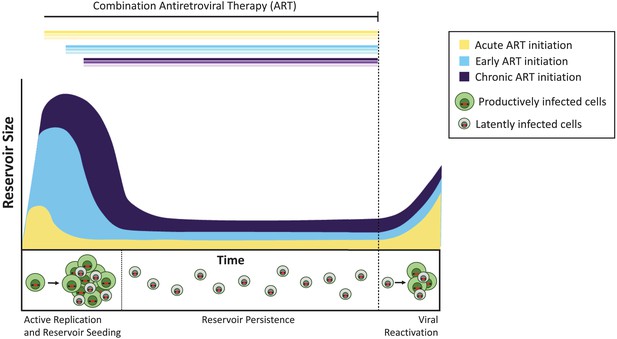
Le moment du traitement antirétroviral influence la taille du réservoir latent.
Sans traitement, les cellules infectées par un virus à réplication active (cellules infectées de manière productive; représentées en vert) créent des virus infectieux. Une minorité de cellules infectées contiennent des virus qui peuvent persister indéfiniment en tant que réservoir latent (cellules infectées latemment; montré en gris), et ces virus peuvent potentiellement être réactivés à une date ultérieure. Le traitement administré pendant la phase aiguë de l’infection (c’est-à-dire dans les jours ou les semaines suivant la primo-infection; courbe jaune) se traduit par un réservoir latent plus petit que lorsque le traitement est initié tôt (dans les six mois suivant l’infection, bleu clair) ou pendant l’infection chronique (plus de 6 mois après l’infection, violet). Si le traitement est arrêté (ligne pointillée), le virus se réactive à partir de ces réservoirs à des niveaux similaires pour raviver l’infection active et semer à nouveau le réservoir latent.
Pour explorer pourquoi le moment du traitement ne semblait pas influencer le taux de réactivation, l’équipe a mesuré le niveau de mutations génétiques dans les virus latents. Si les virus accumulent plus de mutations dommageables à mesure qu’ils se répliquent activement dans le corps, cela suggère que les animaux recevant une TAR retardée pourraient être porteurs d’une plus grande proportion de virus latents qui sont défectueux et ne peuvent pas se réveiller. Cependant, l’équipe a constaté que la majorité des virus (plus de 80%) étaient génétiquement intacts chez tous les animaux, quel que soit le moment où le traitement a commencé. Ceci est très différent de ce qui se passe avec l’infection par le VIH chez l’homme, où la plupart des virus latents contiennent des mutations et des délétions génétiques majeures, ne laissant qu’une petite fraction (entre 2% et 11%) qui sont capables de réactivation (Ho et al., 2013; Bruner et coll., 2019).
Une étude récente, qui a évalué la dynamique du réservoir du VIH chez les personnes sous TAR stable, a identifié une autre divergence entre ce modèle de VIS et la latence du VIH chez l’homme. Malgré la TAR en cours, le VIH latent peut parfois se réactiver spontanément et les virus deviennent détectables dans le sang pendant un court moment. Chez l’homme, ces « blips » viraux sont liés phylogénétiquement à un réservoir viral établi non seulement lors de l’infection initiale, mais au fil des années d’infection non traitée (Jones et al., 2018). Les raisons qui sous-tendent ces différences ne sont pas bien comprises et représentent des domaines importants pour la recherche en cours.
Malgré les différences entre les modèles de primates non humains et l’infection humaine par le VIH, les travaux de Pinkevych et al. confirme que la latence virale est établie extrêmement tôt après l’infection. Ces résultats indiquent que le traitement antirétroviral doit être commencé dès que possible pour contrôler l’infection par le VIH et réduire la taille du réservoir latent. On ignore encore beaucoup de choses sur la façon dont la latence du VIH est établie et maintenue, en particulier sous traitement; cependant, les modèles SIV resteront un outil important pour comprendre comment éradiquer le réservoir latent.
Leave a Reply