Les Lignes directrices GINA 2019 pour le traitement de l’asthme chez les adultes
US Pharm. 2020;45(7/8):18-24.
RÉSUMÉ: Établir un contrôle des symptômes de l’asthme à l’aide d’interventions pharmacologiques et non pharmacologiques améliore la qualité de vie et prévient les exacerbations chez les patients asthmatiques. Les lignes directrices de l’Initiative mondiale pour l’asthme 2019 fournissent des recommandations pour le traitement de l’asthme organisées en cinq étapes en corrélation avec la gravité de la maladie. Les options de médicaments comprennent les corticostéroïdes inhalés (SCI), les agonistes béta2 à action prolongée, les agonistes béta2 à action courte (SABAs), les antagonistes des récepteurs des leucotriènes et les corticostéroïdes oraux. Des données récentes montrent des résultats défavorables pour les SABAs utilisés seuls pour le traitement au besoin des symptômes de l’asthme léger. Les modifications apportées aux lignes directrices incluent l’utilisation d’un SCI à faible dose avec du formotérol pour le traitement au besoin chez les adultes souffrant d’asthme léger, ou pour une utilisation chaque fois qu’un SABA serait utilisé. Des schémas thérapeutiques appropriés et efficaces combinés à des conseils sur la technique appropriée de l’inhalateur aideront les patients à atteindre leurs objectifs de gestion de l’asthme.
L’asthme, une maladie inflammatoire chronique des voies respiratoires caractérisée par une hyperréactivité des voies respiratoires, peut présenter des symptômes tels qu’une respiration sifflante, un essoufflement, une oppression thoracique et une toux.1 Ces symptômes peuvent varier dans le temps et en intensité, ce qui rend la prise en charge efficace de l’asthme importante. Les déclencheurs de symptômes peuvent inclure l’exercice, les infections respiratoires virales et des facteurs environnementaux, tels que le tabagisme. Les symptômes qui ne sont pas traités peuvent entraîner des exacerbations. Une exacerbation est un épisode aigu dans lequel les symptômes s’aggravent considérablement et la fonction pulmonaire diminue progressivement. Toute apparition d’une exacerbation mérite une discussion sur le schéma de traitement actuel de l’asthme du patient en raison des risques d’hospitalisation, de visites aux soins d’urgence et de décès liés à l’asthme.
Les lignes directrices de l’Initiative mondiale pour l’asthme (GINA) de 2019 ne recommandent pas l’utilisation d’un inhalateur à agoniste du béta2 à courte durée d’action (SABA) seul pour le traitement de l’asthme léger; au lieu de cela, ils recommandent l’utilisation de corticostéroïdes inhalés à faible dose (ICS) -formotérol au besoin et pour un traitement d’entretien.2 Chez les patients souffrant d’asthme sévère ou difficile à traiter, d’autres options peuvent être envisagées en complément du traitement par inhalateur, telles que les antagonistes des récepteurs des leucotriènes (LRTA), le tiotropium, les produits biologiques, l’azithromycine et les corticostéroïdes oraux (OCS).
Le contrôle de l’asthme indique dans quelle mesure les caractéristiques de l’asthme peuvent être observées chez le patient ou ont été réduites ou éliminées par le traitement.2 Le contrôle de l’asthme doit être revu au cours des 4 semaines précédentes. Les questions suivantes doivent être posées au patient: « Au cours des 4 semaines précédentes, avez-vous eu: 1) des symptômes d’asthme diurnes plus de deux fois par semaine? 2) des réveils nocturnes dus à l’asthme? 3) utiliser un soulagement de l’asthme pour les symptômes plus de deux fois par semaine? 4) des limitations d’activité dues à l’asthme? »Si le patient répond « non” aux quatre questions, son asthme est bien contrôlé. Si le patient répond « Oui » à une ou deux des questions, l’asthme est partiellement contrôlé, mais si la réponse est ”Oui » à trois ou quatre des questions, l’asthme n’est pas bien contrôlé.2 Les facteurs de risque pouvant provoquer une exacerbation comprennent l’asthme incontrôlé, le tabagisme, l’exposition aux allergènes, la pollution de l’air, des comorbidités telles que l’obésité et une consommation élevée de SABA.
L’évaluation de l’adhésion au médicament inhalé du patient est une autre étape importante. Il existe une multitude de raisons pour lesquelles un patient peut ne pas adhérer aux médicaments contre l’asthme, y compris la difficulté à utiliser des inhalateurs, le coût des médicaments, l’oubli, l’incapacité à comprendre les instructions prescrites et la perception que le médicament n’est pas nécessaire.2
PRISE EN CHARGE ET TRAITEMENT
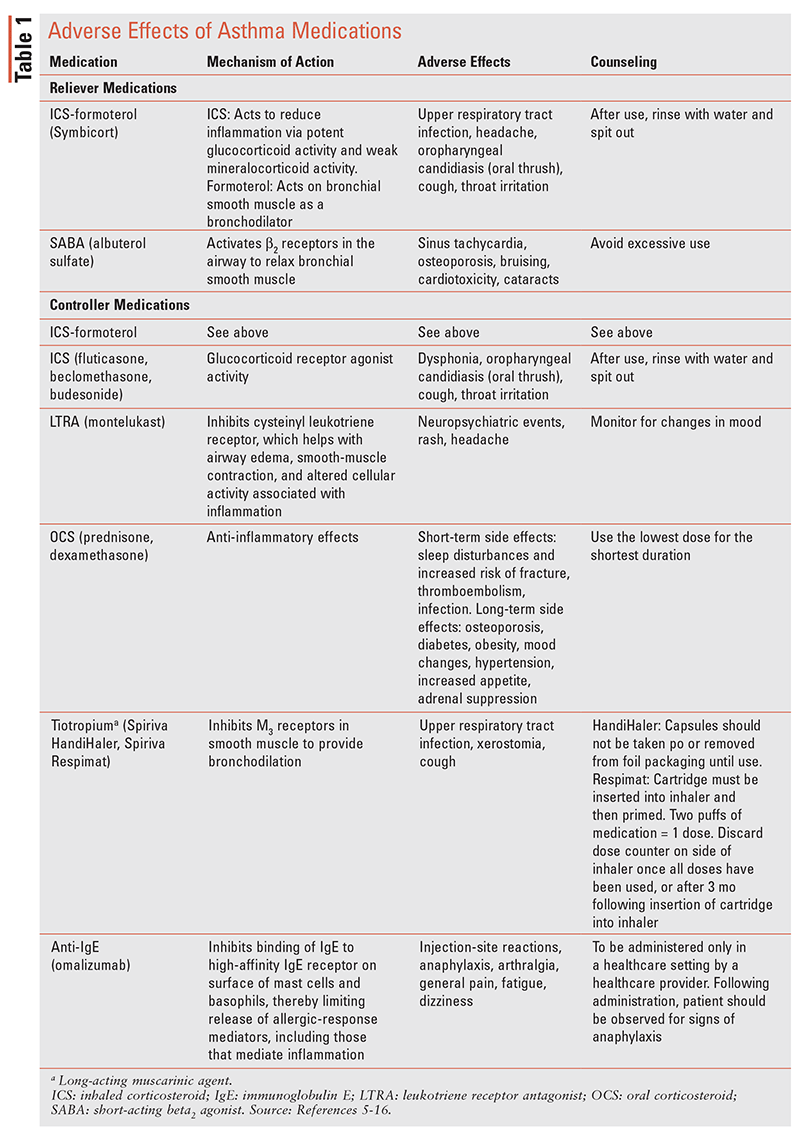
Les objectifs du traitement de l’asthme comprennent le contrôle des symptômes pour maintenir un niveau d’activité normal, la prévention de la limitation persistante du débit d’air et la réduction des effets indésirables des médicaments discutés dans le TABLEAU 1. Les interventions pharmacologiques et non pharmacologiques réduisent le risque d’exacerbations futures menant à une hospitalisation ou à un décès lié à l’asthme.2
Prise en charge non pharmacologique
Les interventions non pharmacologiques pour tous les patients asthmatiques comprennent des exercices de respiration, une activité physique accrue, l’incorporation d’une alimentation saine et l’évitement de l’exposition à la fumée et à d’autres substances.2 La pratique du yoga et des méthodes de respiration telles que les techniques Buteyko et Papworth modifie les habitudes respiratoires pour réduire l’hyperventilation, favorisant ainsi une réduction volontaire de l’utilisation des soulageurs et améliorant les symptômes de l’asthme.3 Chez les patients obèses, la perte de poids combinée à des exercices aérobiques et de musculation deux fois par semaine est plus efficace que l’activité physique seule pour contrôler les symptômes.2 Des conseils sur une technique d’inhalateur appropriée aideront les patients à atteindre leurs objectifs de gestion de l’asthme.
Prise en charge pharmacologique
Des ajustements sont apportés aux schémas thérapeutiques pour l’asthme par le biais du cycle de prise en charge de l’asthme basé sur le contrôle illustré à la FIGURE 1.2
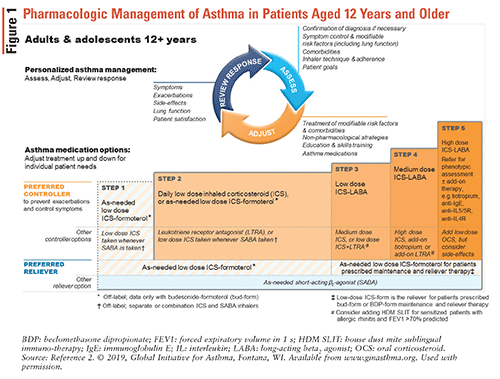
Une fois qu’un diagnostic d’asthme a été posé, un traitement de contrôleur contenant du SCI doit être initié en raison de l’amélioration plus importante de la fonction pulmonaire que lorsque le traitement de contrôleur du SCI n’est pas utilisé. Il s’agit d’un changement important dans les directives GINA 2019, car il était précédemment recommandé de donner un SABA seul aux patients nouvellement diagnostiqués. L’inhalateur combiné ICS-formotérol est le traitement de soulagement préféré selon les besoins, quelle que soit la gravité de l’asthme. La thérapie alternative de soulagement est un SABA; cependant, il doit être associé à un deuxième inhalateur contenant des CI. Les inhalateurs ICS-formotérol sont sûrs et efficaces, et leur capacité à être utilisés à la fois au besoin et pour le traitement d’entretien les rend faciles à utiliser pour les patients.2
GINA recommande les étapes de traitement de l’asthme suivantes2:
• Étape 1: Cette étape est conseillée pour les patients souffrant d’asthme léger qui présentent des symptômes moins de deux fois par mois et ne présentent aucun risque d’exacerbation. Comme mentionné précédemment, sur la base de nouvelles preuves, les directives GINA 2019 ne recommandent plus l’utilisation de SABA seul pour traiter l’asthme.
• Étape 2: Le schéma thérapeutique préféré du contrôleur est le SCI à faible dose au besoin – formotérol ou le SCI à faible dose quotidien plus SABA au besoin. Le régime ICS-formotérol évite le besoin de CI quotidiens tout en offrant des avantages similaires pour la bronchoconstriction induite par l’exercice que les CI quotidiens avec SABA au besoin.
• Étape 3: Les traitements de contrôle préférés comprennent un agoniste du béta2 à action prolongée (LABA) à faible dose ICS – agoniste du béta2 à action prolongée (LABA) plus SABA au besoin ou un formotérol ICS à faible dose pour le traitement d’entretien et de soulagement.
• Étape 4: Le traitement de contrôleur préféré est ICS-formotérol à faible dose comme traitement d’entretien et de soulagement ou ICS-LABA à dose moyenne comme traitement d’entretien plus SABA au besoin. Notez que l’ICS-formotérol ne doit pas être associé à un ICS-LABA contenant un LABA différent.
• Étape 5: Des exacerbations persistantes ou une aggravation des symptômes se produisent malgré l’observance et la technique d’inhalateur correcte. Ces patients sont considérés comme souffrant d’asthme sévère ou difficile à traiter et doivent être référés à un pneumologue.
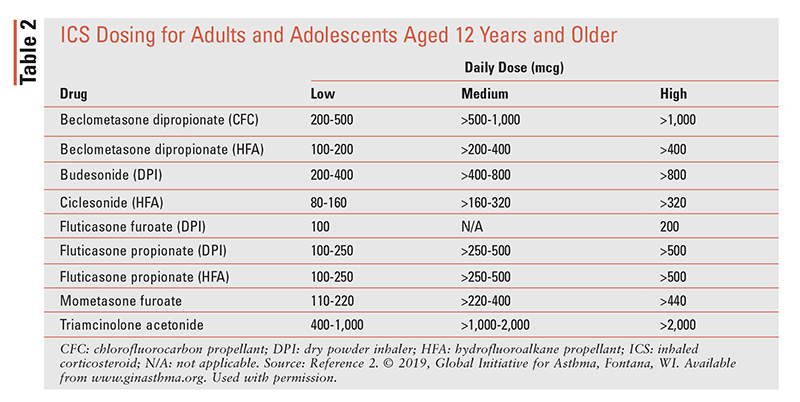
Il est approprié de franchir les étapes décrites ci-dessus lorsque les patients présentent un mauvais contrôle des symptômes ou des exacerbations persistantes malgré un traitement par SCI à faible dose pendant 2 à 3 mois. Le retrait est approprié lorsque le patient a un bon contrôle des symptômes et une fonction pulmonaire stable pendant au moins 3 mois. Les options de retrait dépendent du médicament que le patient prend et de l’étape sur laquelle il se trouve, mais pour la plupart des patients, le résultat est pire si l’ICS ou le LABA est complètement arrêté.2 Le dosage de l’ICS est décrit dans le TABLEAU 2.
Les symptômes peuvent être évalués à l’aide d’outils tels que le Questionnaire de Contrôle de l’asthme, le Test de contrôle de l’asthme et les Trois questions du Collège Royal des médecins.2 Ces questionnaires permettent d’associer un score aux symptômes et interrogent les patients sur la fréquence et les types de symptômes tels que les réveils nocturnes et les limitations des activités quotidiennes.
Exacerbations
Le terme exacerbation de l’asthme désigne l’aggravation aiguë de la fonction pulmonaire et des symptômes au-delà de ce que le patient éprouve habituellement. Le traitement de soulagement préféré lors d’une exacerbation est l’ICS-formotérol à faible dose qui peut être augmenté au besoin lorsque les symptômes s’aggravent. L’utilisation d’un ICS-LABA (béclométhasone ou budésonide et formotérol) en tant que médicament de soulagement et de contrôleur améliore le contrôle des symptômes et réduit les hospitalisations et l’utilisation d’OCS par rapport à la même dose ou à une dose plus élevée d’un contrôleur plus SABA au besoin.4
Un traitement OCS court est une option de traitement lors d’une exacerbation lorsque le patient ne répond pas à une dose accrue de soulagement et de contrôleur après 2 à 3 jours, a des antécédents d’exacerbations sévères soudaines ou a une détérioration rapide de la fonction pulmonaire (débit expiratoire maximal ou volume expiratoire forcé en 1 seconde < 60% de son meilleur niveau personnel ou de sa valeur prédite).4
Effets indésirables des médicaments contre l’asthme
Voir le TABLEAU 1 pour un résumé des effets indésirables de divers médicaments contre l’asthme.5-16
ASTHME SÉVÈRE OU DIFFICILE À TRAITER
L’asthme sévère ou difficile à traiter se réfère à l’asthme incontrôlé aux étapes de traitement 4 et 5 malgré une observance adéquate du traitement et du traitement des facteurs contributifs. Après évaluation initiale, les patients âgés de 12 ans et plus souffrant d’asthme insuffisamment contrôlé qui prennent un SCI à dose moyenne plus un LABA et / ou un troisième contrôleur, tel que le LTRA ou la théophylline à libération prolongée, passent à un essai d’un SCI à dose élevée pendant 3 à 6 mois. En plus d’augmenter le SCI, un essai d’un non biologique additionnel tel que le tiotropium, un modificateur de leucotriène ou un SCO peut être envisagé. Pour les patients adultes qui présentent des symptômes d’asthme persistants malgré des IC et des LABA à dose modérée ou élevée, les directives GINA 2019 recommandent l’azithromycine en complément.17
Si des produits non biologiques tels que les modificateurs LABA, tiotropium et leucotriène ne parviennent pas à gérer les symptômes d’asthme d’un patient, des produits biologiques peuvent être envisagés en fonction du prix et des ressources du patient. Un traitement anti-immunoglobuline E, tel que l’omalizumab, peut être envisagé chez les personnes souffrant d’asthme allergique. Dans le cas où les produits biologiques ne sont pas une option pour un patient, un OCS à une dose de 7,5 mg ou moins par équivalent de prednisone par jour peut être envisagé. Cependant, les OCS sont associés à des effets secondaires importants, tels que l’ostéoporose, l’obésité, le diabète, la cataracte, l’hypertension et la suppression des surrénales, et doivent donc être considérés en dernière ligne.17
ÉTUDES
Un essai en double aveugle mené par O’Byrne et ses collègues a examiné les avantages de l’utilisation d’un SCI plus un SABA par rapport au traitement conventionnel.18 Un total de 3 849 patients âgés de 12 ans ou plus souffrant d’asthme léger ont été assignés au hasard à la terbutaline (placebo deux fois par jour plus terbutaline 0,5 mg prn), au budésonide-formotérol (placebo deux fois par jour plus budésonide-formotérol 200 mcg / 6 mcg prn) ou à l’entretien du budésonide (budésonide 200 mcg plus terbutaline prn deux fois par jour). L’objectif principal était de déterminer si le budésonide-formotérol au besoin était supérieur à la terbutaline au besoin pour le contrôle des symptômes. Ce résultat a été mesuré à l’aide de données obtenues à partir d’un journal électronique des symptômes.
Le budésonide-formotérol au besoin était supérieur en termes de contrôle des symptômes de l’asthme par rapport à la terbutaline au besoin chez les patients souffrant d’asthme léger. Les patients atteints de budésonide-formotérol ont montré un asthme bien contrôlé pendant 34,4 % des semaines contre 31,1 % des semaines dans le groupe terbutaline (P =.046). La terbutaline était associée au taux annuel le plus élevé d’exacerbations sévères (0.20) par rapport au budésonide-formotérol (0,07) et à l’entretien du budésonide (0,09). Un avantage de l’utilisation de budésonide-formotérol était que l’exposition aux corticostéroïdes était réduite en raison de la dose de budésonide inférieure de 17% dans ce groupe par rapport au groupe budésonide-entretien (57 mcg contre 340 mcg, respectivement).18
Bateman et ses collègues ont étudié l’efficacité d’un composant glucocorticoïde inhalé avec un soulagement à action rapide pour l’asthme léger.5 Cet essai multicentrique de 52 semaines en double aveugle a inclus 4 215 patients souffrant d’asthme léger âgés de 12 ans et plus qui étaient admissibles à un traitement par glucocorticoïdes inhalés régulièrement. Les participants ont été divisés en deux groupes pour évaluer si le budésonide-formotérol ou le traitement d’entretien par budésonide deux fois par jour, au besoin, avait une meilleure efficacité en ce qui concerne les taux annuels d’exacerbations sévères. Le groupe budésonide-formotérol n’était pas inférieur au groupe budésonide-entretien pour les exacerbations sévères. De plus, la dose journalière médiane mesurée de glucocorticoïde inhalé était plus faible dans le groupe budésonide-formotérol (66 mcg) que dans le groupe budésonide-entretien (267 mcg). Le temps avant la première exacerbation était similaire entre les groupes; cependant, il y avait une différence de 0,11 U en faveur du groupe budésonide-entretien, qui avait des scores plus faibles sur le Questionnaire de contrôle de l’asthme-5 (ACQ-5) par rapport au groupe budésonide-formotérol. La différence minimale cliniquement importante dans les scores ACQ-5 est de 0,5 U. De plus, il n’y avait aucune différence dans les événements indésirables, les interruptions liées à l’asthme ou le taux de mortalité entre les deux groupes. Cette étude et l’étude O’Byrne soutiennent la recommandation actuelle de 2019 de GINA contre l’utilisation d’un SABA seul et pour l’utilisation d’ICS-formotérol à la place.
Une étude menée par Gibson et ses collègues a examiné l’efficacité et l’innocuité de l’azithromycine par voie orale en tant que traitement d’appoint chez des patients souffrant d’asthme persistant non contrôlé prenant également un SCI à dose moyenne ou élevée plus un LABA.17 Dans cet essai randomisé, en double aveugle, contrôlé par placebo et en groupe parallèle, 420 patients ont été affectés au hasard à l’un des deux groupes de traitement (azithromycine 500 mg ou placebo trois fois par semaine pendant 48 semaines). Les principaux paramètres d’efficacité comprenaient le taux d’exacerbations totales (sévères et modérées) de l’asthme et la qualité de vie globale liée à l’asthme au cours de la période d’étude.
Dans l’étude Gibson, l’azithromycine a réduit les exacerbations de l’asthme; 44% des patients atteints d’azithromycine ont présenté au moins une exacerbation, contre 61% des patients sous placebo (P<.0001). De plus, l’utilisation de l’azithromycine a grandement profité à la qualité de vie liée à l’asthme, ce qui s’est traduit par une amélioration dans toutes les catégories de l’échelle d’évaluation (c.-à-d. les domaines de l’activité, des symptômes, des émotions et de l’environnement) pour la qualité de vie liée à l’asthme. La seule autre différence notable entre les groupes à l’étude était la survenue de diarrhées, qui était significativement plus élevée chez les patients atteints d’azithromycine (34% contre 19% chez les patients sous placebo). Pour la surveillance de l’innocuité, des ECG ont été réalisées lors du dépistage, après 6 semaines de traitement et à la fin du traitement. Un allongement de l’intervalle QTc supérieur à 480 ms a entraîné un retrait de l’essai chez deux patients (un de chaque groupe).17
CHANGEMENTS DANS LES LIGNES DIRECTRICES DE 2019
Les lignes directrices de 2019 comprennent cinq changements notables en ce qui concerne le traitement de l’asthme chez les adultes. Le premier changement est le passage d’un traitement uniquement SABA à un traitement contenant des SCI pour le traitement au besoin des symptômes de l’asthme léger.4 Le deuxième changement est l’utilisation de l’azithromycine à faible dose en complément trois fois par semaine pour le traitement à long terme des patients souffrant d’asthme symptomatique malgré le traitement ICS-LABA à dose modérée ou élevée; cependant, les événements indésirables potentiels doivent être pris en compte.17
Le troisième changement est la recommandation pour le dupilumab, un anticorps monoclonal alpha du récepteur de l’interleukine–4, comme option de traitement supplémentaire pour les patients âgés de 12 ans et plus souffrant d’asthme sévère de type 2 ou d’asthme dépendant de l’OCS.19 Un essai mené par Wenzel et ses collègues a démontré que le dupilumab augmentait la fonction pulmonaire et réduisait les exacerbations sévères chez les patients souffrant d’asthme persistant non contrôlé.20
Le quatrième changement consiste à inclure le traitement ICS-LABA à dose élevée uniquement à l’étape 5, alors qu’auparavant il avait été inclus à l’étape 4 avec le traitement ICS-LABA à dose modérée; cela est dû à la recommandation selon laquelle le traitement ICS à dose élevée ne devrait être prescrit que pendant quelques mois en fonction de la prise en compte des événements indésirables associés.17 Le cinquième changement est le passage des OCS de maintenance d’une option de traitement « préférée » à ”une autre option de contrôleur » à l’étape 5, en fonction du risque élevé de résultats indésirables.19
CONCLUSION
Sur la base de nouvelles données, les directives GINA 2019 mises à jour ne recommandent pas l’utilisation d’un inhalateur SABA seul pour le traitement de l’asthme léger; au lieu de cela, l’ICS-formotérol à faible dose est recommandé pour le traitement au besoin et le traitement d’entretien. Pour les patients qui présentent un asthme sévère ou difficile à traiter, d’autres options peuvent être envisagées comme traitement complémentaire au traitement par inhalateur, y compris le LTRA, le tiotropium, les produits biologiques, l’azithromycine et l’OCS. Pour assurer une meilleure observance des médicaments, les schémas thérapeutiques pour l’asthme doivent être spécifiques au patient, avec une approche par étapes pour trouver un schéma thérapeutique qui contrôle les symptômes de l’asthme du patient tout en maintenant le patient à la dose la plus faible possible, et devrait également être rentable.
1. Fondation américaine pour l’asthme et les allergies. Asthme. www.aafa.org/asthma-symptoms . Consulté le 8 avril 2020.
2. Initiative mondiale contre l’asthme. Stratégie mondiale pour la gestion et la prévention de l’asthme, 2019. www.ginasthma.org . Consulté le 8 avril 2020.
3. Santino TA, Chaves GS, Freitas DA, et al. Exercices de respiration pour adultes asthmatiques. Système de base de données Cochrane Rév. 2020; 3(3): CD001277.
4. Le premier ministre O’Byrne, le juge en chef FitzGerald, l’ED Bateman et coll. Inhalé combiné budésonide-formotérol au besoin dans l’asthme léger. En anglais J Med. 2018;378(20):1865-1876.
5. Il s’agit de l’un des plus grands groupes de la planète. Budésonide au besoin – formotérol contre budésonide d’entretien dans l’asthme léger. En anglais J Med. 2018;378(20):1877-1887.
6. Notice de Symbicort (budésonide-formotérol). Wilmington, DE: AstraZeneca Pharmaceuticals LP; janvier 2017.
7. Reed CE. Asthme chez les personnes âgées: diagnostic et prise en charge. J Allergie Clin Immunol. 2010;126(4):681-687.
8. Notice d’emballage de ProAir HFA (albuterol). Frazer, PA: Teva Respiratory, LLC; février 2019.
9. Feuillet d’emballage Flovent HFA (fluticasone). Parc du Triangle de recherche, Caroline du Nord : GlaxoSmithKline; janvier 2019.
10. Notice d’emballage Singulair (montelukast). La station Whitehouse, New Jersey : Merck &Co, Inc; Avril 2020.
11. Waljee AK, Rogers MA, Lin P, et coll. Utilisation à court terme de corticostéroïdes oraux et méfaits connexes chez les adultes aux États-Unis: étude de cohorte basée sur la population. BMJ. 2017; 357: j1415.
12. Nous sommes en mesure de vous aider. « J’ai perdu dans toutes les facettes de ma vie”: le fardeau caché de l’asthme sévère. Eur Respir J. 2017; 50(3): 1700765.
13. Notice de Rayos (prednisone). Deerfield, IL : Horizon Pharma, Inc; 2012.
14. Notice d’emballage de Spiriva HandiHaler (tiotropium). Ridgefield, CT: Boehringer Ingelheim Pharmaceuticals, Inc; Février 2018.
15. Notice de Spiriva Respimat (tiotropium). Ridgefield, CT: Boehringer Ingelheim Pharmaceuticals, Inc; Mars 2019.
16. Notice de Xolair (omalizumab). La ville de San Francisco, Californie : Genentech, Inc; Mai 2019.
17. Gibson PG, Yang IA, Upham JW, et al. Effet de l’azithromycine sur les exacerbations de l’asthme et la qualité de vie chez les adultes souffrant d’asthme incontrôlé persistant (AMAZES): essai randomisé, en double aveugle, contrôlé par placebo. Lancet. 2017;390(10095):659-668.
18. O’Byrne PM, Barnes PJ, Rodriguez-Roisin R, et coll. Budésonide et formotérol inhalés à faible dose dans l’asthme persistant léger: l’essai randomisé OPTIMA. Am J Respir Crit Soins Med. 2001;164(8):1392-1397.
19. Castro M, Corren J, Pavord ID, et al. Efficacité et innocuité du Dupilumab dans l’asthme incontrôlé modéré à sévère. En anglais J Med. 2018;378(26):2486-2496.
20. Wenzel S, Castro M, Corren J, et coll. Efficacité et innocuité du Dupilumab chez les adultes souffrant d’asthme persistant non contrôlé malgré l’utilisation de corticostéroïdes inhalés à dose moyenne à élevée et d’un agoniste du béta2 à action prolongée : essai pivot de phase 2b contrôlé randomisé en double aveugle et contrôlé par placebo. Lancet. 2016;388(10039):31-44.
Le contenu de cet article est uniquement à titre informatif. Le contenu n’est pas destiné à se substituer à des conseils professionnels. Le recours à toute information fournie dans cet article est à vos propres risques.
Leave a Reply