Morula Développement
Google Translate – sélectionnez votre langue dans la liste ci-dessous (cela va ouvrir une nouvelle page externe)
arabes | catalan | 中文 | 中國傳統的 | français | Deutsche | עִברִית | हिंदी | bahasa Indonesia | italiano | 日本語 | 한국어 | မြန်မာ | Pilipino | Polskie | português | ਪੰਜਾਬੀ ਦੇ | Română | русский | Español | Swahili | Svensk | T| Türkçe | اردو/ יידדיש / TiNgng ViTt Ces traductions externes sont automatisées et peuvent ne pas être exactes. (Plus? À propos des traductions)
Introduction
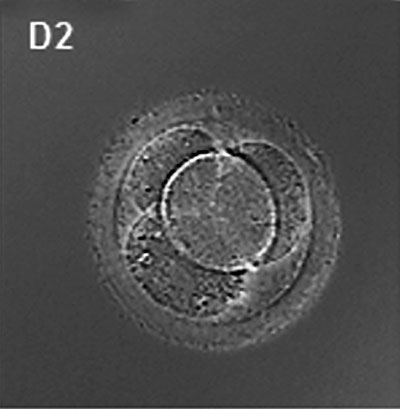
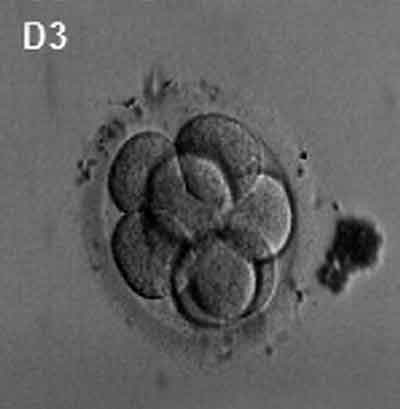
(latin, morula = mûrier) Un stade précoce du développement post-fécondation lorsque les cellules se sont rapidement divisées mitotiquement pour produire une masse solide de cellules (12-15 cellules) d’aspect « mûrier ». Cette étape est suivie de la formation d’une cavité dans cette étape de blastocyste de masse cellulaire.
Un événement clé avant la formation de morula est le « compactage », où l’embryon à 8 cellules subit des changements dans la morphologie cellulaire et l’adhérence cellule-cellule qui initie la formation de cette boule solide de cellules.
Chez l’homme, le stade de développement de morula survient pendant les premiers jours de la première semaine suivant la fécondation (semaine 3 de l’AG) et est décrit comme le stade Carnegie 2. Cette étape est suivie de la formation d’une cavité, le blastocoel, qui définit la formation du blastocyste.

Préimplantation d’ART biopsie du blastomère
|
Dans la technologie de procréation assistée, le stade de morula est celui où l’un des premiers tests de diagnostic prénatal peut être effectué, en retirant une seule cellule (blastomère) et en effectuant un diagnostic génétique sur son ADN. |
Moléculaire – Chez la souris, lors de la transition du stade morula au stade blastocyste, la différenciation de la masse cellulaire interne (ICM) et du trophectoderme (TE) s’est avérée être régulée par la voie de l’hippopotame.
Liens Morula: morula / Carnegie stade 2 / mitose/ blastocyste | fécondation / Semaine 1 / Conférence – Semaine 1 / Catégorie: Carnegie Stade 2 / Catégorie:Morula
Quelques résultats récents
- Effet de la Régulation négative des Transcriptions des Membres de la Voie Hippo YAP1 et LATS2 sur le Développement précoce et l’expression des gènes Impliqués dans la différenciation chez les embryons porcins »Dans le développement de souris, la différenciation de la masse cellulaire interne (ICM) et du trophectoderme (TE) pendant la transition du stade morula au stade blastocyste est régulée par la voie Hippo; cependant, les fonctions de la voie Hippo dans l’embryogenèse porcine n’ont pas été enquête. Dans la présente étude, nous avons examiné les modèles d’expression génique des membres de la voie Hippo yes-associated protein 1 (YAP1) et du grand suppresseur de tumeur 2 (LATS2) et les fonctions de ces gènes pendant le développement préimplantatoire porcin en utilisant l’interférence de l’ARN. Les taux d’ARNm de YAP1 et de LATS2 ont été élevés dans les ovocytes matures in vitro et les embryons de stade 1 cellule et ont diminué progressivement avec le développement. La localisation nucléaire de YAP1 a été détectée aux stades morula et blastocyste. La régulation négative de YAP1 ou de LATS2 a inhibé le développement préimplantatoire du porc et a affecté les niveaux d’expression de l’homéobox 1 de classe 5 de POU (OCT-4) et du gène HMG-box 2 lié à SRY (SOX2), facteurs de transcription nécessaires à la différenciation ICM/TE. Pris ensemble, YAP1 et LATS2 sont essentiels au développement préimplantatoire porcin, et il est possible que la voie de l’hippopotame joue un rôle important dans la ségrégation ICM / TE porcine. »
- Diversité de l’expression des gènes homéobox humains et murins dans le développement et les tissus adultes »8 cellules à morula, 12 gènes homéobox spécifiques aux euthériens non détectables en dehors des tissus reproducteurs ou de l’embryon (RHOXF2, RHOXF2B, CPHX1, CPHX2, DPRX, LEUTX, TPRX1, TPRX2, ARGFX, NANOGNB, DUXA, DUXB). Hox

Ce tableau permet une recherche informatique automatisée de la base de données PubMed externe à l’aide du lien texte « Terme de recherche » répertorié.
- Cette recherche nécessite maintenant un lien manuel car l’extension PubMed d’origine a été désactivée.
- La liste de références affichée ne reflète aucune sélection éditoriale de matériel basée sur le contenu ou la pertinence.Les références
- apparaissent également sur cette liste en fonction de la date de consultation de la page.
Les références figurant sur le reste de la page de contenu et sur la page de discussion associée (répertoriées sous les sous-titres de l’année de publication) incluent une sélection éditoriale basée à la fois sur la pertinence et la disponibilité.
Plus? Références / Page de discussion / Recherches de revues / Références 2019 / Références 2020
Terme de recherche: Développement de Morula / Compactage de Morula / Division des blastomères de Morula / Hippopotame de Morula /
Ces articles apparaissaient à l’origine dans le tableau Des résultats récents, mais au fur et à mesure que cette liste s’allongeait, ils ont maintenant été mélangés à ce tableau pliable.
Voir également la page de discussion pour les autres références répertoriées par année et les références sur cette page actuelle.
- Des mécanismes dépendants et indépendants du Par-aPKC contrôlent en coopération la polarité cellulaire, la signalisation de l’hippopotame et le positionnement des cellules chez les embryons de souris au stade de 16 cellules « Dans les embryons de souris préimplantatoires, la voie de signalisation de l’hippopotame joue un rôle central dans la régulation du destin du trophectoderme (TE) et de la masse cellulaire interne (ICM). Dans les premiers blastocystes avec plus de 32 cellules, le système Par-aPKC contrôle la polarisation des cellules externes le long de l’axe apicobasal, et la polarité cellulaire supprime la signalisation des hippopotames. »L’imagerie non invasive d’embryons humains avant l’activation du génome embryonnaire prédit le développement au stade du blastocyste » Nous rapportons des études sur le développement embryonnaire humain préimplantatoire qui corrélent l’analyse d’images en accéléré et le profilage de l’expression génique. En examinant un grand nombre de zygotes issus de la fécondation in vitro (FIV), nous constatons que le succès de la progression au stade blastocyste peut être prédit avec une sensibilité et une spécificité de > de 93% en mesurant trois paramètres d’imagerie dynamiques et non invasifs au jour 2 après la fécondation, avant l’activation du génome embryonnaire (EGA). »
- Génomique fonctionnelle d’embryons humains au stade de 5 à 8 cellules par analyse d’ADNc unicellulaire de blastomères » Quarante-neuf blastomères d’embryons humains de 5 à 8 cellules ont été étudiés à la suite d’un protocole efficace d’amplification d’ADNc unicellulaire pour fournir un modèle pour l’analyse de microréseaux à haute densité. Les marqueurs décrits précédemment, caractéristiques de la Masse cellulaire interne (ICM) (n = 120), de la stemness (n = 190) et du Trophectoderme (TE) (n = 45), ont été analysés et un modèle de ménage de 46 gènes a été établi. …En résumé, l’analyse globale de microréseaux d’amplification d’ADNc unicellulaire des embryons humains au stade de 5 à 8 cellules révèle que le destin des blastomères n’est pas lié à l’ICM ou à l’TE. »
Films
|
Modèle Morula Page/Jeu
|
Zygote Mitosis Page | Play
|
Early Division Page | Play
|
Parental Genomes Page | Play
|
Mouse Blastocyst Page | Play
|
Movies
Compaction
- E-cadherin mediated adhesion initiates at compaction at the 8-cell stage
- regulated post-translationally via protein kinase C and other signalling molecules
Blastomere Division

Une étude in vitro du développement de blastocystes humains a montré que les blastomères qui se divisent initialement rapidement sont plus susceptibles de se développer au stade de blastocystes.
Une étude récente chez la souris a montré qu’il n’y avait pas d’orientation spécifique du fuseau mitotique lors de la division cellulaire au stade de transition de 8 à 16 cellules. Cela suggère qu’aucun motif de clivage prédéterminé (pré-modelé) au stade de 8 cellules et seulement modulé par l’étendue de l’arrondi cellulaire pendant la mitose. Chez d’autres espèces, comme le ver C.les éléganes et les ascidies ont des modèles spécifiques d’orientation du fuseau à partir du stade zygote.
Développement de la Morula humaine modèle
La figure suivante provient d’une étude récente utilisant une analyse vidéo et génétique du développement humain in vitro au cours de la semaine 1 suivant la fécondation.
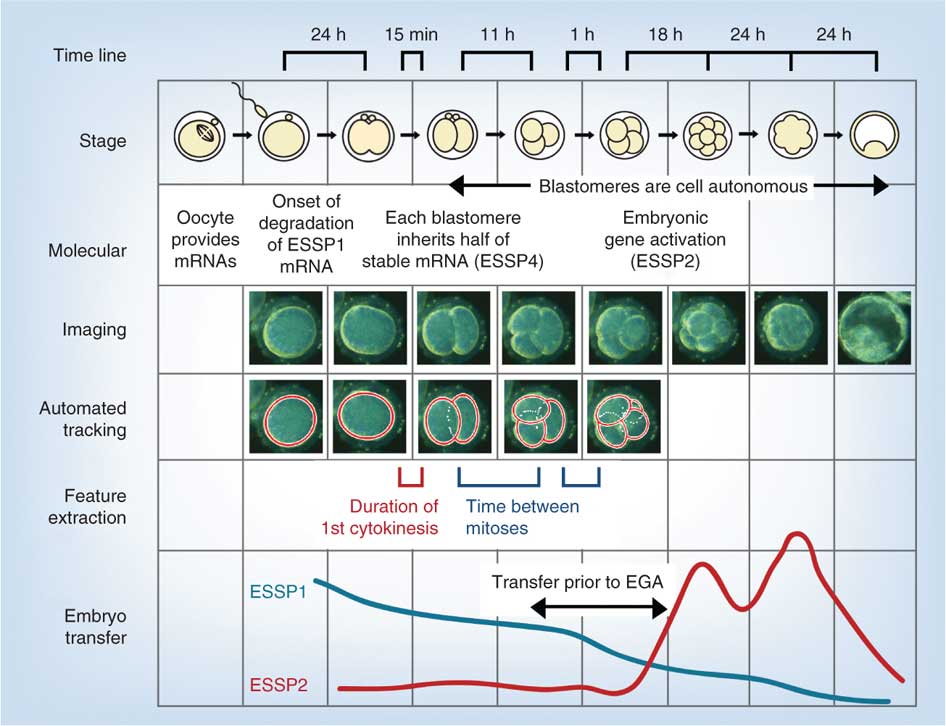
- EGA – activation du génome embryonnaire
- ESSP – modèle spécifique au stade embryonnaire, quatre modèles uniques spécifiques au stade embryonnaire (1-4)
Liens: Figure avec légende
Morulas chez d’autres Espèces
Morula de souris
Chez la souris, lors du passage du stade morula au stade blastocyste, la différenciation de la masse cellulaire interne (ICM) et du trophectoderme (TE) s’est avérée être régulée par la voie de l’hippopotame.
-

4 cell morula stage development
-

Sox2 expression
-

Early gene expression
-

Early gene expression
-

Early gene expression
-

Early expression génique
Liens: Développement de souris
Morula d’Oursin

Modèle de clivage embryonnaire précoce de l’oursin (Images de la galerie SDB)
Liens: Développement de l’oursin
Morula bovine
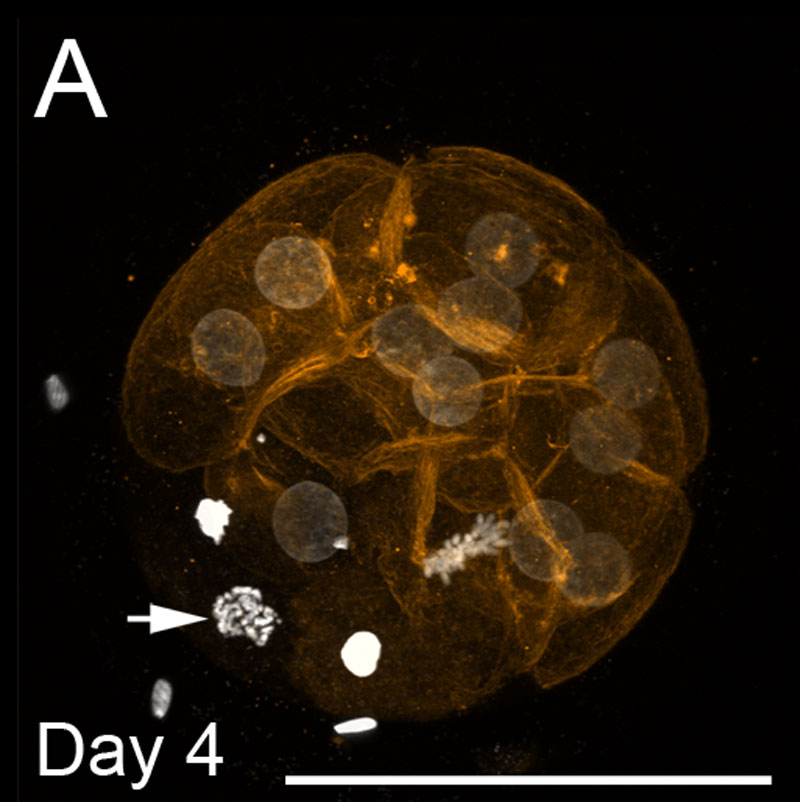
Morula bovine
- L’image montre une coloration de l’ADN (blanc) et des filaments de f-actine (orange) au jour 4. Les barres d’échelle représentent 100 µm.
- Les noyaux ronds à coloration pâle sont à l’interphase.
- La flèche montre un noyau unique à la prophase.
- Un seul noyau est vu à la métaphase.
- Les noyaux brillants condensés sont apoptotiques.
Liens: Développement bovin /mitose
Biopsie de Morula

Biopsie d’embryons compacts au stade morula
- (A)Un embryon compact au stade morula avant la biopsie.
- (B–G) Étapes de la biopsie.
- (H) Un embryon à 2 h après la biopsie.
Liens: Diagnostic prénatal / Technologie de Procréation assistée
- 1,0 1.1 Zhang P, Zucchelli M, Bruce S, Hambiliki F, Stavreus-Evers A, Levkov L, Skottman H, Kerkelä E, Kere J & Hovatta O. (2009). Profilage du transcriptome du développement préimplantatoire humain. PLoS UN, 4, e7844. PMID: 19924284 DOI.
- Milachich T. (2014). Nouvelles avancées du dépistage génétique préimplantatoire et prénatal et des tests non invasifs comme prédicteur potentiel de l’état de santé des bébés. Biomed Res Int, 2014, 306505. PMID: 24783200 DOI.
- 3.0 3.1 Hirate Y, Hirahara S, Inoue K, Kiyonari H, Niwa H &Sasaki H. (2015). Des mécanismes dépendants et indépendants du Par-aPKC contrôlent en coopération la polarité cellulaire, la signalisation de l’hippopotame et le positionnement cellulaire dans des embryons de souris au stade de 16 cellules. Dev. La Croissance Diffère. , 57, 544-56. PMID: 26450797 DOI.
- 4.0 4.1 4.2 Emura N, Saito Y, Miura R &Sawai K. (2020). Effet de la Régulation à la baisse des Transcriptions des Membres de la Voie Hippo YAP1 et LATS2 sur le Développement Précoce et l’Expression des Gènes Impliqués dans la Différenciation chez les Embryons Porcins. Reprogrammation cellulaire, ,. PMID: 32150685 DOI.
- Dunwell TL &Holland PW. (2016). Diversité de l’expression des gènes homéobox humains et murins dans le développement et les tissus adultes. BMC Dev. Biol. , 16, 40. PMID: 27809766 DOI.
- 6.0 6.1 Wong CC, Loewke KE, Bossert NL, Behr B, De Jonge CJ, Baer TM &Reijo Pera RA. (2010). L’imagerie non invasive d’embryons humains avant l’activation du génome embryonnaire prédit le développement au stade du blastocyste. NAT. Biotechnol. , 28, 1115-21. PMID: 20890283 DOI.
- Galán A, Montaner D, Póo ME, Valbuena D, Ruiz V, Aguilar C, Dopazo J &Simón C. (2010). Génomique fonctionnelle d’embryons humains au stade de 5 à 8 cellules par analyse d’ADNc unicellulaire de blastomères. PLoS UN, 5, e13615. PMID: 21049019 DOI.
- 8.0 8.1 Dard N, Louvet-Vallée S&Maro B. (2009). Orientation des fuseaux mitotiques au cours de la transition de stade de 8 à 16 cellules chez les embryons de souris. PLoS UN, 4, e8171. PMID: 19997595 DOI.
- Fenwick J, Platteau P, Murdoch AP& Herbert M. (2002). Le temps écoulé entre l’insémination et le premier clivage prédit la compétence développementale des embryons humains préimplantatoires in vitro. Hum. Reprod. , 17, 407-12. PMID: 11821286
- Leidenfrost S, Boelhauve M, Reichenbach M, Güngör T, Reichenbach HD, Sinowatz F, Wolf E &Habermann FA. (2011). Arrêt cellulaire et mort cellulaire dans le développement préimplantatoire des mammifères: leçons du modèle bovin. PLoS UN, 6, e22121. PMID: 21811561 DOI.
- Zakharova EE, Zaletova VV&Krivokharchenko AS. (2014). Biopsie d’embryons humains au stade morula: résultat de 215 cycles de FIV / ICSI avec PGS. PLoS UN, 9, e106433. PMID: 25191937 DOI.
Avis
Coticchio G, Lagalla C, Sturmey R, Pennetta F &Borini A. (2019). L’énigmatique morula: mécanismes de développement, détermination du destin cellulaire, autocorrection et implications pour l’art. Hum. Reprod. Mise à jour, 25, 422-438. PMID: 30855681 DOI.
Articles
Bessonnard S, Mesnard D&Constam DB. (2015). PC7 et les protéases apparentées Furine et Pace4 régulent la fonction de l’E-cadhérine pendant la formation des blastocystes. J. Biol Cellulaire. , 210, 1185-97. PMID: 26416966 DOI.
Dzamba BJ, Jakab KR, Marsden M, Schwartz MA&DeSimone DW. (2009). L’adhésion à la cadhérine, la tension tissulaire et la signalisation Wnt non canonique régulent l’organisation de la matrice de fibronectine. Dev. Cellule, 16, 421-32. PMID: 19289087 DOI.
Santos J, Pereira CF, Di-Gregorio A, Épicéa T, Aulne O, Rodriguez T, Azuara V, Merkenschlager M&Fisher AG. (2010). Les différences dans les propriétés épigénétiques et de reprogrammation des cellules souches pluripotentes et extra-embryonnaires impliquent le remodelage de la chromatine comme un événement précoce important chez l’embryon de souris en développement. Chromatine épigénétique, 3, 1. PMID: 20157423 DOI.
Recherche PubMed
Recherche Pubmed: développement de morula | développement de blastomères/
Liens du GlossaireGlossaire: A|B|C|D|E|F|G|H|I|J|K|L|M|N|O|P|Q|R|S|T|U|V|W|X|Y|Z| Nombres|Symboles/ Lien de terme
Citer cette page: Hill, M.A. (24 mars 2021) Développement embryologique de Morula. Extrait de https://embryology.med.unsw.edu.au/embryology/index.php/Morula_Development
Leave a Reply