Phosphofructokinase (PFK)
Contenu
- 1 Introduction
- 2 Rôle dans la glycolyse
- 3 Mécanisme et Régulation de la Phosphofructokinase
- 4 Régulation
- 5 Changements Conformationnels dans une Unité dimérique de PFK
- 6 Les Changements conformationnels majeurs dans une Sous-unité de PFK.
- 7 Mutagenèse dirigée par site
- 8 Maladie
- 9 Structures 3D de PFK
Introduction
La phosphofructokinase-1 (PFK-1) est une enzyme glycolytique qui catalyse le transfert d’un groupe phosphoryle de à à et. Voir Enzymes de glycolyse. Mg2+ est également important dans cette réaction (). La phosphofructokinase-2 (PFK-2) agit sur les mêmes substrats pour produire de l’ADP et. . La réaction de PFK est fortement exergonique (irréversible) dans des conditions physiologiques et est donc l’une des étapes déterminantes du taux de la voie glycolytique. Dans la plupart des organismes / tissus, la PFK est la principale enzyme régulatrice du flux de la voie glycolytique; son activité est contrôlée par les concentrations d’un nombre inhabituellement élevé de métabolites, y compris l’ATP, l’ADP, l’AMP, le PEP et le fructose-2,6-bisphosphate.
est un tétramère de sous-unités identiques à 320 résidus. C’est une enzyme allostérique qui est décrite en utilisant le modèle de symétrie de l’allostérisme selon lequel il y a une transition concertée de son état R à haute activité à son état T à faible activité. Les structures radiologiques des états R et T de l’enzyme ont été rapportées. La liaison d’une molécule de son substrat F6P, qui se lie à l’enzyme d’état R avec une affinité élevée mais à l’enzyme d’état T avec une faible affinité, amène PFK à reprendre l’état R, ce qui augmente l’affinité de liaison de l’enzyme pour F6P supplémentaire (un effet homotrope). Les activateurs, tels que l’ADP et l’AMP se lient à des sites dits allostériques, sites de liaison distincts du site actif, où ils facilitent également la formation de l’état R et activent donc l’enzyme (un effet hétérotrope; l’ADP, étant un produit de la réaction PFK, se lie également au site actif de l’enzyme). De même, les inhibiteurs tels que la PEP se lient aux sites allostériques (qui dans le cas de la PFK chevauchent le site allostérique activateur) où ils favorisent la formation de l’état T, inhibant ainsi l’enzyme.
Deux des sites actifs de l’enzyme sont situés à l’interface des interfaces des sites actifs en magenta avec les substrats en cyan. Deux autres sites actifs se trouvent à l’interface des sous-unités B (vert) et C (rose). Un gros plan de la sous-unité D (Jaune) montre que les acides aminés des deux sous-unités A (bleu clair) et D (Jaune) contribuent à la liaison de F6P. Deux des sites allostériques sont situés à l’interface de et deux à l’interface des sous-unités C et D. Encore une fois, les interfaces sont magenta avec le ligand allostérique du cyan. Un gros plan de la sous-unité A montre les contributions des deux sous-unités à la liaison d’ADP. Les changements conformationnels de passage entre les états R et T de PFK sont illustrés ci-dessous.
Les coordonnées atomiques pour l’état R PFK ont été obtenues à partir de 4pfk; celles pour l’état T PFK ont été obtenues auprès de Philip Evans, Laboratoire de biologie moléculaire du MRC, Cambridge, Royaume-Uni, mais sont maintenant disponibles en tant que 6pfk.
Rôle dans la glycolyse
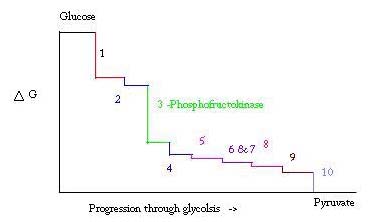
La glycolyse est le processus de préparation et de décomposition du glucose pour produire de l’acide pyruvique, qui est utilisé dans la respiration anaérobie ou comme l’un des réactifs de départ du cycle de l’acide citrique. Trois points du processus de glycolyse se produisent avec une énergie libre négative importante et sont donc irréversibles. Ces trois points sont l’hexokinase, la phosphofructokinase et la pyruvate kinase; de ces trois PFK est considéré comme le principal point régulateur de la glycolyse dans le muscle avec un ΔG = -25,9 kJ / mol.
Mécanisme et régulation de la Phosphofructokinase
La Phosphofructokinase se lie à la fois au Mg2+-ATP et au fructose-6-phosphate (F6P) pour produire du fructose-1,6-bisphosphate et du Mg2 +-ADP. Bien que l’image avec ces deux produits n’ait pas été déterminée, liée à l’enzyme l’a été. Il y a trois sites de liaison des ligands par sous-unité. Deux constituent le site actif, qui lie le F6P et l’ATP, tandis que le troisième est un site de liaison allostérique. Certains résidus proposés impliqués sur le site actif comprennent. Les PFK existent dans deux états conformationnels, les deux et qui sont en équilibre. L’ATP lie les sites actifs et allostériques dans les deux conformations. Alors que l’ATP se lie également bien au site actif, il se lie préférentiellement au site allostérique de l’état T, Cette liaison préférentielle provoque un déplacement de l’équilibre des deux états vers une plus grande quantité d’état T, ce qui diminue l’affinité pour le F6P. se lie également au site allostérique pour augmenter le rapport de la phosphofructokinase de l’état R. Avec l’ADP, l’AMP et le F2, le 6P inhibe le rôle régulateur de l’ATP. Le km du PFK pour l’ATP est.020 mm et.032mM.
Régulation
La glycolyse est un processus métabolique essentiel à la survie. Par conséquent, dans son activation et sa suppression, il doit être hautement réglementé. Trois points du processus de glycolyse se produisent avec une énergie libre négative importante et sont donc irréversibles. Ces trois points sont l’hexokinase, la phosphofructokinase et la pyruvate kinase. Ces trois réactions sont candidates pour être les principaux points de régulation en raison de leurs énergies libres négatives élevées. Parmi les trois, la PFK est considérée comme le point régulateur majeur de la glycolyse (#3 dans l’image ci-dessous) dans le muscle, avec un ΔG = -25,9 kJ / mol, car il s’agit d’une étape engagée. Une fois que PFK convertit F6P en F1,6P, la réaction ne sera pas facilement inversée en raison de la grande quantité d’énergie qui doit être surmontée pour revenir en arrière. . Cette barrière énergétique est logique car la pyruvate kinase catalyse la réaction finale (#10) et l’hexokinase (#1) n’est pas du tout impliquée dans la glycolyse lorsque le processus est commencé à partir du glycogène.
PFK est régulé par ATP, AMP et ADP. Alors que l’ATP se lie également bien au site actif dans les états R et T, il se lie préférentiellement au site allostérique de l’état T. Cette liaison préférentielle provoque un déplacement de l’équilibre des deux états vers une plus grande quantité d’état T, ce qui diminue l’affinité pour le F6P. L’activateur allostérique ADP se lie également au site allostérique pour augmenter le rapport de la phosphofructokinase de l’état R. Comme le montre le graphique ci-dessous, les graphiques de l’activité de PFK sont sigmoïdaux. Cela démontre en outre la nature coopérative de l’enzyme. La liaison initiale du substrat à l’enzyme est difficile, mais une fois qu’il est lié et force le changement d’état de T->R, les autres substrats se lient beaucoup plus facilement. Le graphique montre également que l’ajout d’ATP déplace le tracé vers la droite (c’est-à-dire diminue l’affinité pour F6P), tandis que l’ajout d’AMP le déplace vers la gauche.
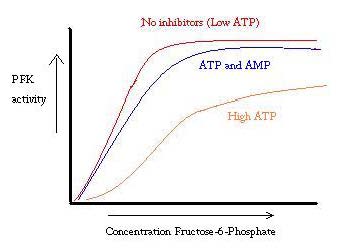
Le système de régulation correspond bien à la fonction de PFK. Lorsque PFK est actif, l’ATP est produit en aval de celui-ci, car d’autres produits sont décomposés plus complètement. Ainsi, lorsque les niveaux d’ATP sont faibles et qu’il faut en faire plus, l’activité du PFK sera augmentée, car l’ADP sera en forte concentration. Le contraire est également vrai, car une concentration élevée d’ATP inhibe l’activité des protéines. Et pourtant, cette explication ne peut pas complètement expliquer la régulation de la PFK, car les niveaux d’ATP ne varient pas suffisamment entre les muscles actifs et au repos. Un autre moyen de régulation allostérique doit être trouvé.
Le Km de PFK pour l’ATP est.020 mm et.032 mm.
Cet exercice de kinémage consiste en deux scènes de kinémage qui illustrent certains des changements conformationnels induits par l’allostérite qui se produisent dans la PFK de Bacillus stéarothermophilus.
Changements conformationnels dans une unité dimérique de PFK
Ce kinémage montre les deux sous-unités du tétramère dont l’interface contient deux sites actifs. (Le KinéMage n’est actuellement pas pris en charge) La première vue, le dimère 1: PFK, montre les deux sous-unités dans leur conformation d’état R telle que représentée par leurs dorsales Ca avec la Sous-Unité 1 en teinte rose et la Sous-Unité 2 en rose. Deux chaînes latérales dans chaque sous-unité sont représentées, celles de Glu 161 (rouge) et Arg 162 (cyan), qui font partie du site de liaison F6P dans les états T et R, srespectivement (voir ci-dessous). Un F6P (hotpink) et un ADP (vert; « ADP-active ») sont liés dans le site actif de chaque sous-unité. Un ADP supplémentaire (jaune; « ADP-allo ») est lié dans un site dit allostérique séparé de chaque sous-unité. Les ADP ont chacun un Mg2+ associé, qui est représenté ici par une boule de la même couleur que l’ADP auquel il se lie.
Cliquez sur le bouton « ANIMER » pour basculer le dimère entre ses états R et T. Dans son état T, la sous-unité 1 est bluetint et la Sous-unité 2 est skyblue. Les chaînes latérales de Glu 161 et Arg 162 dans les deux sous-unités sont rouges et cyan comme précédemment (seuls les atomes Ca et Cb de la chaîne latérale Arg 162 dans la Sous-Unité 1 sont observés dans la structure des rayons X de l’état T; ceux de la Sous-Unité 2 sont tous observés). L’enzyme d’état T lie l’inhibiteur du 2-phosphoglycolate (gold; « PGC »), un analogue non physiologique du phosphoénolpyruvate intermédiaire glycolytique (PEP). Notez que le site de liaison de PGC dans l’état T chevauche le site de liaison allostérique d’ADP dans l’état R (« ADP-allo ») et que leur liaison est donc mutuellement exclusive. Les sites actifs de l’état T, qui ne contiennent pas de F6P, sont marqués par des F6P « fantômes » (gris; « site F6P »), qui ont les mêmes positions que les F6P dans l’enzyme de l’état R.
La deuxième vue, 2:Sites Allo/Act, est un gros plan de la partie supérieure de la première vue montrant à la fois le site actif et le site allostérique dans cette région. Notez que le site actif est situé à l’interface entre deux sous-unités et que le site allostérique interagit directement avec le site actif sur la sous-unité adjacente. Comparez les conformations d’état R et d’état T en affichant les deux à la fois ou en cliquant sur « ANIMER ». Pouvez-vous identifier l’ion Mg2+ associé à chacun des ADP liés à l’enzyme à l’état R? Quels atomes d’ADP coordonnent ces ions Mg2+ ?
Le groupe phosphate de PGC se lie au site allostérique à l’état T dans la même position que le groupe phosphate bêta de « ADP-allo » se lie au site allostérique à l’état R ; les deux groupes phosphate se lient aux chaînes latérales des trois mêmes résidus (2 arg et 1 Lys ; non représentés).
Dans l’état R à haute activité, la chaîne latérale chargée positivement d’Arg 162 forme un pont de sel lié à l’hydrogène avec le groupe 6-phosphate chargé négativement de F6P (lignes pointillées blanches), une interaction qui stabilise vraisemblablement l’état R par rapport à l’état T et est donc en partie responsable de l’effet homotrope du F6P.
Les changements conformationnels majeurs dans une sous-unité de PFK.
Ce KINÉMAGE montre ces segments proches du site allostérique (les résidus 53-60 ne sont pas représentés ici). Comme dans le KINÉMAGE 1, le polypeptide est représenté par sa chaîne Ca avec les Sous-unités d’état R 1 et 2 en rouge et rose, et les Sous-Unités d’état T 1 et 2 en bleu bleu et bleu ciel. (KinéMage actuellement non pris en charge) Le KINÉMAGE 2 apparaît dans la vue 1: Le Site allostérique, à l’état R montrant le groupe phosphate de F6P (hotpink) lié au site actif de l’enzyme dans un pont de sel lié à l’hydrogène (lignes blanches en pointillés) avec la chaîne latérale d’Arg 162 (cyan). Un ADP (jaune ; « ADP-allo ») occupe le site allostérique adjacent. Cliquez une fois sur « ANIMER » pour passer à l’état T. Cela remplace l’ADP dans le site allostérique de l’état R par l’inhibiteur et l’analogue PEP PGC (gold). F6P n’occupe plus le site actif mais sa position dans l’état R est indiquée par le « fantôme » F6P (gris ; visualisé en cliquant sur « site F6P »).
Qu’advient-il du segment hélicoïdal du polypeptide central (résidus 149-164) dans la transition R à T ? Qu’est-ce que cela fait des positions relatives de la Glu 161 chargée négativement et de l’Arg 162 chargée positivement ? Cliquez sur « Site F6P ». Quelle influence l’absence de charge positive d’Arg 162 aurait-elle sur la liaison de F6P ? Cela explique-t-il, au moins en partie, pourquoi l’état T PFK a une faible affinité pour F6P? Allez à la vue 2: Gros plan, pour un gros plan des interactions F6P-sidechain. Centrez les molécules en choisissant « pickcenter » dans le menu « outils » et en cliquant sur l’atome que vous souhaitez être au centre. Faites glisser le curseur « zoom » pour agrandir la vue.
Mutagenèse dirigée sur le site
À un moment donné, on pensait que la charge négative de la Glu 161 avait un effet négatif sur la liaison du F6P à l’état T. Cette idée n’a pas été soutenue par des expériences de mutagenèse dirigées sur site. Plusieurs PFK mutants ont été fabriqués, dont R162A, E161A et R162A/E161A. La mutation R162A a provoqué une diminution de 30 fois de la liaison au F6P. La mutation E161A, cependant, a eu peu d’effet sur la capacité de la PPE à inhiber la liaison au F6P.
Maladie
Le déficit en PFK des érythrocytes héréditaires est associé à une myopathie et à une hémolyse (maladie de Tarui).
Structures 3D de la PFK
Structures 3D de la phosphofructokinase
Leave a Reply