Pommade au propionate d’Halobétasol
Forme posologique: pommade
Revue médicale par Drugs.com . Dernière mise à jour le 1er mars 2020.
- Aperçu
- Effets secondaires
- Posologie
- Professionnel
- Interactions
- Plus
Pommade au propionate d’halobétasol Description
Pommade au propionate d’halobétasol, 0,05% contient du propionate d’halobétasol, un corticostéroïde synthétique à usage dermatologique topique. Les corticostéroïdes constituent une classe de stéroïdes principalement synthétiques utilisés par voie topique comme agent anti-inflammatoire et antiprurigineux.
Chimiquement, le propionate d’halobétasol est le 21-chloro-6α, 9-difluoro-11β, 17-dihydroxy-16β-méthylprégna-1, 4-diène-3-20- dione, 17-propionate, C25H31ClF2O5. Il a la formule structurelle suivante:
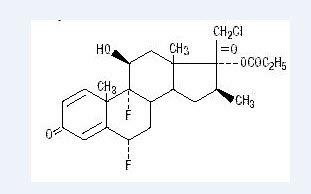
Le propionate d’halobétasol a un poids moléculaire de 485. C’est une poudre cristalline blanche insoluble dans l’eau.
Chaque gramme de pommade au propionate d’halobétasol contient 0.5 mg / g de propionate d’halobétasol dans une base de stéarate d’aluminium, de cire d’abeille, de cocoate de pentaérythritol, de vaseline, de propylène glycol, de sesquioléate de sorbitane et de citrate de stéaryle.
Pommade au propionate d’halobétasol – Pharmacologie clinique
Comme d’autres corticostéroïdes topiques, le propionate d’halobétasol a des actions anti-inflammatoires, antiprurigineuses et vasoconstrictrices. Le mécanisme de l’activité anti-inflammatoire des corticostéroïdes topiques, en général, n’est pas clair. Cependant, on pense que les corticostéroïdes agissent par l’induction de protéines inhibitrices de la phospholipase A2, appelées collectivement lipocortines. Il est postulé que ces protéines contrôlent la biosynthèse de médiateurs puissants de l’inflammation tels que les prostaglandines et les leucotriènes en inhibant la libération de leur précurseur commun l’acide arachidonique. L’acide arachidonique est libéré des phospholipides membranaires par la phospholipase A2.
Pharmacocinétique
L’ampleur de l’absorption percutanée des corticostéroïdes topiques est déterminée par de nombreux facteurs, notamment le véhicule et l’intégrité de la barrière épidermique. Il n’a pas été démontré que les pansements occlusifs contenant de l’hydrocortisone pendant jusqu’à 24 heures augmentent la pénétration; cependant, l’occlusion de l’hydrocortisone pendant 96 heures améliore nettement la pénétration. Les corticostéroïdes topiques peuvent être absorbés par une peau normale intacte. L’inflammation et / ou d’autres processus pathologiques de la peau peuvent augmenter l’absorption percutanée.
Des études sur l’homme et l’animal indiquent que moins de 6% de la dose appliquée de propionate d’halobétasol pénètre dans la circulation dans les 96 heures suivant l’administration topique de la pommade au propionate d’Halobétasol.
Des études réalisées avec une pommade au propionate d’halobétasol indiquent qu’elle se situe dans la gamme de puissance super élevée par rapport à d’autres corticostéroïdes topiques.
Indications et utilisation de la pommade au propionate d’Halobétasol
La pommade au propionate d’halobétasol est un corticostéroïde à très haute puissance indiqué pour le soulagement des manifestations inflammatoires et prurigineuses des dermatoses sensibles aux corticostéroïdes. Le traitement au-delà de deux semaines consécutives n’est pas recommandé et la dose totale ne doit pas dépasser 50 g / semaine en raison du potentiel du médicament pour supprimer l’axe hypothalamo-hypophyso-surrénalien (HPA). L’utilisation chez les enfants de moins de 12 ans n’est pas recommandée.
Comme avec d’autres corticostéroïdes très actifs, le traitement doit être interrompu lorsque le contrôle a été réalisé. Si aucune amélioration n’est constatée dans les 2 semaines, une réévaluation du diagnostic peut être nécessaire.
Contre-indications
La pommade au propionate d’halobétasol est contre-indiquée chez les patients ayant des antécédents d’hypersensibilité à l’un des composants de la préparation.
Précautions
Généralités
L’absorption systémique des corticostéroïdes topiques peut entraîner une suppression réversible de l’axe hypothalamo-hypophyso-surrénalien (HPA) avec un risque d’insuffisance glucocorticostéroïde après l’arrêt du traitement. Des manifestations du syndrome de Cushing, de l’hyperglycémie et de la glucosurie peuvent également être produites chez certains patients par absorption systémique de corticostéroïdes topiques pendant le traitement.
Les patients appliquant un stéroïde topique sur une grande surface ou sur des zones en occlusion doivent être évalués périodiquement pour détecter la présence d’une suppression de l’axe HPA. Cela peut être fait en utilisant la stimulation ACTH, le cortisol plasmatique du matin et les tests urinaires de cortisol libre. Les patients recevant des corticostéroïdes super puissants ne doivent pas être traités pendant plus de 2 semaines à la fois et seules de petites zones doivent être traitées en même temps en raison du risque accru de suppression de l’HPA.
La pommade au propionate d’halobétasol a produit une suppression de l’axe de l’HPA lorsqu’elle est utilisée en doses fractionnées à raison de 7 grammes par jour pendant une semaine chez les patients atteints de psoriasis. Ces effets étaient réversibles à l’arrêt du traitement.
Si la suppression de l’axe HPA est notée, une tentative doit être faite pour retirer le médicament, pour réduire la fréquence d’application ou pour remplacer un corticostéroïde moins puissant. La récupération de la fonction de l’axe HPA est généralement rapide à l’arrêt du traitement par corticostéroïdes topiques. Rarement, des signes et des symptômes d’insuffisance glucocorticostéroïde peuvent survenir nécessitant des corticostéroïdes systémiques supplémentaires. Pour obtenir des renseignements sur la supplémentation systémique, voir Renseignements sur la prescription de ces produits.
Les patients pédiatriques peuvent être plus sensibles à la toxicité systémique à partir de doses équivalentes en raison de leur plus grand rapport surface cutanée / masse corporelle (voir PRÉCAUTIONS: Utilisation pédiatrique).
En cas d’irritation, la pommade au propionate d’halobétasol doit être interrompue et un traitement approprié doit être instauré. La dermatite de contact allergique avec les corticostéroïdes est généralement diagnostiquée en observant un échec de guérison plutôt qu’en constatant une exacerbation clinique comme avec la plupart des produits topiques ne contenant pas de corticostéroïdes. Une telle observation doit être corroborée par des tests diagnostiques appropriés.
Si des infections cutanées concomitantes sont présentes ou se développent, un agent antifongique ou antibactérien approprié doit être utilisé. Si une réponse favorable ne se produit pas rapidement, l’utilisation de la pommade au propionate d’Halobétasol doit être interrompue jusqu’à ce que l’infection ait été correctement contrôlée.
La pommade au propionate d’halobétasol ne doit pas être utilisée dans le traitement de la rosacée ou de la dermatite périorale, ni sur le visage, l’aine ou les aisselles.
Information pour les patients
Les patients utilisant des corticostéroïdes topiques doivent recevoir les informations et instructions suivantes:
- Le médicament doit être utilisé selon les directives du médecin. Il est destiné à un usage externe uniquement. Évitez le contact avec les yeux.
- Le médicament ne doit pas être utilisé pour un trouble autre que celui pour lequel il a été prescrit.
- La zone cutanée traitée ne doit pas être bandée, ni recouverte ou enveloppée de manière à être occlusive, sauf indication contraire du médecin.
- Les patients doivent signaler à leur médecin tout signe d’effets indésirables locaux.\
Tests de laboratoire
Les tests suivants peuvent être utiles pour évaluer la suppression de l’axe HPA chez les patients: Test de stimulation de l’ACTH; Test de cortisol plasmatique du matin; Test de cortisol libre urinaire.
Carcinogenèse, Mutagénèse, Altération de la fertilité
Aucune étude à long terme sur l’animal n’a été réalisée pour évaluer le potentiel cancérogène du propionate d’halobétasol. Des effets de mutagénicité positifs ont été observés dans deux essais de génotoxicité. Le propionate d’halobétasol a été positif dans un test de micronoyau de hamster chinois et dans un test de mutation du gène du lymphome de souris in vitro.
Les études menées chez le rat après administration orale à des doses allant jusqu’à 50 mcg/kg/jour n’ont révélé aucune altération de la fertilité ou des performances générales de reproduction.
Dans d’autres tests de génotoxicité, le propionate d’halobétasol ne s’est pas révélé génotoxique dans le test Ames/Salmonella, dans le test d’échange de chromatides sœurs dans des cellules somatiques du hamster chinois, dans des études d’aberration chromosomique de cellules germinales et somatiques de rongeurs et dans un test ponctuel de mammifères pour déterminer des mutations ponctuelles.
Grossesse
Effets tératogènes: Catégorie de grossesse C
Les corticostéroïdes se sont révélés tératogènes chez les animaux de laboratoire lorsqu’ils sont administrés par voie systémique à des doses relativement faibles. Certains corticostéroïdes se sont révélés tératogènes après application cutanée chez des animaux de laboratoire.
Le propionate d’halobétasol s’est révélé tératogène chez les rats FPS et les lapins de type chinchilla lorsqu’il est administré par voie systémique pendant la gestation à des doses de 0,04 à 0,1 mg / kg chez le rat et de 0,01 mg/ kg chez le lapin. Ces doses sont respectivement d’environ 13, 33 et 3 fois la dose topique humaine de pommade au propionate d’Halobétasol. Le propionate d’halobétasol s’est révélé embryotoxique chez le lapin, mais pas chez le rat.
Une fente palatine a été observée chez le rat et le lapin. L’omphalocèle a été observée chez le rat, mais pas chez le lapin.
Il n’existe pas d’études adéquates et bien contrôlées du potentiel tératogène du propionate d’halobétasol chez la femme enceinte. La pommade au propionate d’halobétasol ne doit être utilisée pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Les mères allaitantes
Des corticostéroïdes administrés par voie systémique apparaissent dans le lait maternel et peuvent inhiber la croissance, interférer avec la production de corticostéroïdes endogènes ou provoquer d’autres effets indésirables. On ne sait pas si l’administration topique de corticostéroïdes pourrait entraîner une absorption systémique suffisante pour produire des quantités détectables dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, il convient de faire preuve de prudence lorsque la pommade au propionate d’halobétasol est administrée à une femme qui allaite.
Utilisation pédiatrique
L’innocuité et l’efficacité de la pommade au propionate d’halobétasol chez les patients pédiatriques n’ont pas été établies et l’utilisation chez les patients pédiatriques de moins de 12 ans n’est pas recommandée. En raison d’un rapport plus élevé entre la surface de la peau et la masse corporelle, les patients pédiatriques sont plus à risque que les adultes de suppression de l’axe HPA et du syndrome de Cushing lorsqu’ils sont traités par des corticostéroïdes topiques. Ils sont donc également plus à risque d’insuffisance surrénale pendant ou après l’arrêt du traitement. Des effets indésirables, y compris des stries, ont été rapportés avec une utilisation inappropriée de corticostéroïdes topiques chez les nourrissons et les enfants.
Une suppression de l’axe HPA, un syndrome de Cushing, un retard de croissance linéaire, une prise de poids retardée et une hypertension intracrânienne ont été rapportés chez des enfants recevant des corticostéroïdes topiques. Les manifestations de la suppression surrénale chez les enfants comprennent de faibles niveaux de cortisol plasmatique et une absence de réponse à la stimulation par l’ACTH. Les manifestations de l’hypertension intracrânienne comprennent des fontanelles bombées, des maux de tête et un œdème papillaire bilatéral.
Utilisation gériatrique
Sur 850 patients traités par une pommade au propionate d’halobétasol dans les études cliniques, 21% avaient 61 ans et plus et 6 % avaient 71 ans et plus. Aucune différence globale d’innocuité ou d’efficacité n’a été observée entre ces patients et les patients plus jeunes; et d’autres expériences cliniques rapportées n’ont pas mis en évidence de différences de réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certaines personnes âgées ne peut être exclue.
Effets indésirables
Dans les essais cliniques contrôlés, les effets indésirables les plus fréquents rapportés pour la pommade au propionate d’halobétasol comprenaient des picotements ou des brûlures chez 1,6 % des patients. Les effets indésirables les moins fréquemment rapportés étaient la pustulation, l’érythème, l’atrophie cutanée, la leucodermie, l’acné, les démangeaisons, l’infection secondaire, la télangiectasie, l’urticaire, la peau sèche, la miliaire, la paresthésie et les éruptions cutanées.
Les effets indésirables locaux supplémentaires suivants sont rarement rapportés avec des corticostéroïdes topiques, et ils peuvent survenir plus fréquemment avec des corticostéroïdes à haute puissance, tels que la pommade au propionate d’Halobétasol. Ces réactions sont répertoriées dans un ordre décroissant approximatif d’occurrence: folliculite, hypertrichose, éruptions acnéiformes, hypopigmentation, dermatite périorale, dermatite de contact allergique, infection secondaire, stries et miliaires.
Pour signaler LES EFFETS INDÉSIRABLES SUSPECTÉS, contactez Teligent Pharma, Inc. au 1-856-697-1441, ou FDA au 1-800-FDA-1088 ou www.FDA.gov / medwatch.
Surdosage
Appliqué par voie topique, la pommade au propionate d’Halobétasol peut être absorbée en quantités suffisantes pour produire des effets systémiques (voir PRÉCAUTIONS) h
Posologie et administration de la pommade au propionate d’Halobétasol
Appliquez une fine couche de pommade au propionate d’Halobétasol sur la peau affectée une ou deux fois par jour, selon les directives de votre médecin, et frottez doucement et complètement.
La pommade au propionate d’halobétasol est un corticostéroïde topique à très haute puissance; par conséquent, le traitement doit être limité à deux semaines et les quantités supérieures à 50 g / sem ne doivent pas être utilisées. Comme avec les autres corticostéroïdes, le traitement doit être interrompu lorsque le contrôle est atteint. Si aucune amélioration n’est constatée dans les 2 semaines, une réévaluation du diagnostic peut être nécessaire.
La pommade au propionate d’halobétasol ne doit pas être utilisée avec des pansements occlusifs.
Comment la pommade au propionate d’Halobétasol est-elle fournie
La pommade au propionate d’Halobétasol, 0,05%, est fournie dans les tailles de tubes suivantes:
50 g (NDC 63739-998-67)
STOCKAGE
Conserver la pommade au propionate d’halobétasol entre 15 °C et 30 °C (59 °F et 86 °F).
Fabriqué par:
Teligent Pharma, Inc.
Buena, NJ 08310
Distribué par:
McKesson Corporation
dba Sky Packaging
4971 Southridge Blvd., Suite 101
Memphis, TN 38141
PI-073-00
C101430 Rév 02/2020
ÉTIQUETTE DE L’EMBALLAGE.PANNEAU D’AFFICHAGE PRINCIPAL Carton DE 50 grammes
NDC 63739-998-67
Pommade au propionate d’halobétasol
, 0,05%
À usage topique uniquement.
Ne pas utiliser dans les yeux.
Poids net. 50 grams
Rx Only

| HALOBETASOL PROPIONATE Halobetasol Propionate Ointment |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – McKesson Corporation (140529962)
Registrant – Teligent Pharma, Inc. (011036910)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Teligent Pharma, Inc. | 011036910 | manufacture(63739-998) | |
Frequently asked questions
- Halobetasol vs. clobetasol – how do they compare?
- Cela peut-il être utilisé pour l’herbe à puce?
- Peut-il être utilisé sur le cuir chevelu?
En savoir plus sur l’halobétasol topique
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Informations posologiques
- Interactions médicamenteuses
- Comparez les alternatives
- Prix & Coupons
- 25 Avis
- Classe de médicament: topical steroids
Consumer resources
- Patient Information
- Halobetasol Topical application (Advanced Reading)
Professional resources
- Prescribing Information
- Halobetasol (FDA)
- Halobetasol Cream (FDA)
- Halobetasol Foam (FDA)
Other brands Ultravate, Lexette, Bryhali, Halonate
Related treatment guides
- Plaque Psoriasis
- Eczema
- Psoriasis
- Atopic Dermatitis
- Granuloma Annulare
- Dermatitis
Medical Disclaimer
Leave a Reply