Qu’est-Ce qui influence la Taille des Groupes dans Lesquels les Primates Choisissent de Vivre?

L’une des principales contributions théoriques apportées par l’étude des primates est de comprendre ce qui influence la nature de la variation complexe de la structure et des organisations sociales. Cela sous-tend un ensemble de développements théoriques examinant pourquoi les animaux vivent en groupes en premier lieu et pourquoi les groupes sont d’une taille particulière. Ici, nous nous concentrons sur la question de « qu’est-ce qui influence la taille des groupes dans lesquels les primates choisissent de vivre? »
Les primates sont des taxons particulièrement utiles pour répondre à cette question car la taille de leurs groupes est très variable, non seulement à l’intérieur, mais aussi entre les espèces. La taille du groupe intraspécifique du colobe roux (Procolobus rufomitratus), par exemple, varie entre 12 et 150 membres (Chapman &Chapman 2000a). La variation interspécifique s’étend d’un seul individu, comme on le voit chez les orangs-outans (Pongo sp.) (van Schaik, 1999), à plus de 800 membres de mandrills (Mandrillus sphinx) (Abernethy et al. 2002). De plus, au sein de certaines espèces, les groupes sociaux se divisent et se ré-unissent à plusieurs reprises en sous-groupes de tailles et de combinaisons différentes au fil du temps (par exemple, l’organisation sociale de fission-fusion des singes araignées (Ateles sp.) et les chimpanzés (Pan troglodytes), ou l’organisation à plusieurs niveaux de gelada (Theropithecus gelada) et de babouins Hamadryas (Papio hamadryas, Aureli et al. 2008). Cette variation permet aux chercheurs de développer des modèles pour étudier à la fois les facteurs écologiques et sociaux de la taille du groupe.
Le regroupement est bénéfique de plusieurs façons. On pense que les individus appartenant à des groupes plus importants présentent un risque moindre de prédation (Hamilton, 1971), peuvent être mieux en mesure de trouver et de défendre des ressources alimentaires (Cody, 1971; Wrangham, 1980) et peuvent être protégés contre les menaces conspécifiques, comme l’infanticide par des mâles hors groupe (Wrangham, 1979). Divers chercheurs ont suggéré que le regroupement confère des avantages si prévisibles (Alexander 1974, van Schaik 1983) que les différences de taille de groupe peuvent s’expliquer par les inconvénients (Wrangham et al. 1993). Le coût potentiel le plus largement accepté du regroupement serait une réduction de l’efficacité de la recherche de nourriture. Être avec d’autres individus ayant les mêmes besoins alimentaires signifie que les animaux se battent pour la nourriture (concours de compétition), ou qu’un animal d’un groupe bat un autre pour la nourriture, donc lorsque le deuxième animal arrive dans une zone, il ne reste tout simplement plus de nourriture (scramble competition, Janson & van Schaik 1988). Dans ces deux situations, on pense que la concurrence sur la nourriture conduit les animaux à voyager plus loin. La logique derrière cet argument est relativement simple. Les animaux doivent se nourrir sur une zone pouvant répondre à leurs besoins énergétiques et nutritionnels. Il s’ensuit qu’une augmentation de la taille du groupe augmentera la superficie qui doit être couverte pour trouver des réserves alimentaires adéquates. Ainsi, les individus doivent voyager plus loin et dépenser plus d’énergie s’ils sont dans un grand groupe, que s’ils se nourrissent dans un groupe plus petit. Avec une augmentation du temps passé à voyager, on approche d’un point où l’énergie dépensée en voyage est trop coûteuse et où les petits groupes deviennent avantageux. De cette façon, les facteurs écologiques peuvent influencer les modes de déplacement et l’efficacité de la recherche de nourriture, limitant ainsi la taille des groupes capables d’exploiter efficacement les ressources alimentaires disponibles. Ces idées ont été formalisées dans ce qui est devenu connu sous le nom de Modèle de contraintes écologiques (Chapman &Chapman 2000b, Ganas &Robbins 2005, Snaith &Chapman 2007, Teichroeb Sicotte 2009).
L’élément essentiel du modèle de contraintes écologiques est qu’une augmentation de la taille du groupe doit entraîner une augmentation de la compétition alimentaire au sein du groupe. Il est concevable que cela fonctionne de manière légèrement différente selon la nature des ressources utilisées par des espèces particulières. Avec des primates frugivores, et peut—être de nombreux primates folivores, qui se nourrissent dans des parcelles discrètes — généralement des arbres portant des aliments ou des touffes d’arbres – d’autres membres du groupe peuvent épuiser les parcelles plus rapidement et entraîner une augmentation des plages diurnes (Chapman 1988, Snaith& Chapman 2005). Pour les espèces plus insectivores, dont les ressources peuvent ne pas se trouver dans des parcelles discrètes, un voyage continu dans la canopée à la recherche d’insectes avec des membres de groupe supplémentaires peut entraîner une augmentation du chevauchement des champs de recherche individuels, réduisant les taux de rencontre par habitant avec de la nourriture et augmentant ainsi la zone à rechercher (van Schaik et al. 1983).
Le modèle des contraintes écologiques suggère donc que les facteurs qui influent sur la distance parcourue par les animaux devraient également influer sur la taille du groupe. Pour les animaux qui se nourrissent généralement de fruits ou de feuilles qui peuvent être épuisés, la taille de la parcelle déterminerait combien de temps un groupe d’une taille donnée pourrait rester et se nourrir. Un grand groupe passerait moins de temps dans un patch d’une taille donnée qu’un groupe plus petit, car il épuise le patch plus rapidement — un grand groupe a simplement plus de bouches à nourrir. Si les animaux voyagent entre les parcelles une fois qu’ils les ont épuisées, la densité et la répartition des parcelles détermineront les frais de déplacement encourus. Lorsque les parcelles de ressources sont à haute densité ou dans une distribution groupée, la distance jusqu’à la parcelle suivante est faible, les frais de déplacement sont faibles et les animaux peuvent donc former de grands groupes. Dans ces moments-là, tout coût supplémentaire associé au fait d’être membre d’un grand groupe, tel que la nécessité de visiter de nombreux patchs, peut être facilement récupéré. En revanche, lorsque les parcelles de ressources se trouvent à de faibles densités, la distance jusqu’à la parcelle suivante est généralement grande, les frais de déplacement sont élevés et les animaux ne peuvent pas se permettre d’épuiser rapidement les parcelles, et les animaux forment donc de petits groupes.
L’organisation sociale de fission-fusion des singes araignées, des chimpanzés et de quelques autres primates (Figure 1) offre des tests utiles du modèle des contraintes écologiques car on peut tenter de prédire les changements temporels de la taille des sous-groupes à partir de mesures directes de la taille, de la densité et de la distribution des ressources alimentaires (Chapman 1990, Chapman et al. 1995). Pour les singes araignées et les chimpanzés, un modèle de régression multiple a été développé pour montrer que la taille, la densité et la distribution des parcelles de nourriture mesurées chaque mois constituaient un bon prédicteur de la taille des sous-groupes. Il est difficile de représenter visuellement une régression multiple, mais les méthodes utilisées pour les singes araignées sont représentées à la figure 2. Les singes araignées ont un type d’organisation sociale de fission-fusion très flexible, et dans le parc national de Santa Rosa, au Costa Rica, la taille du sous-groupe peut varier de 1 à 35 individus, mais en moyenne environ 5 individus voyagent ensemble. Pour cette population, 50 % de la variance de la taille mensuelle moyenne du sous-groupe peut être prédite à partir de mesures relativement grossières de la taille, de la densité et de la distribution des parcelles de nourriture (Chapman, 1990).

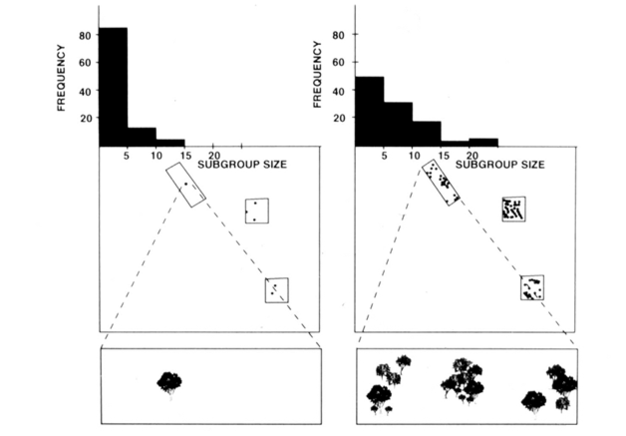
En plus des espèces mentionnées ci-dessus, l’applicabilité du modèle de contraintes écologiques a généralement été étayée par des recherches provenant d’une variété d’espèces (Snaith&Chapman 2005) et de situations (par exemple, modèles généraux, Wrangham et al. 1993, et associations mixtes d’espèces, Chapman &Chapman 2000c). Nous estimons que, compte tenu du large soutien que ce modèle a reçu, il est temps qu’il soit raisonnable de suggérer que les espèces devraient généralement se conformer aux attentes du modèle des contraintes écologiques. Cela ne signifie pas que toutes les espèces se conformeront, et cela devient donc un moment passionnant pour la recherche dans ce domaine, car les chercheurs peuvent rechercher des exceptions au modèle. Nous soupçonnons que les espèces qui ne se conforment pas le feront parce qu’elles ont adopté des stratégies sociales qui vont à l’encontre des attentes écologiques. Cela fournit un « critère » pour évaluer l’importance potentielle de diverses stratégies sociales (c’est-à-dire que plus on s’écarte des attentes du modèle écologique, plus les pressions sélectives sociales sont importantes).
Donnons brièvement deux exemples tirés de nos recherches précédentes. Les chimpanzés femelles étaient plus solitaires que les singes araignées femelles, mais ils ont tous deux des organisations sociales de fission-fusion similaires. De plus, alors que nous pouvions prédire avec précision le nombre de chimpanzés mâles et subadultes dans un sous-groupe en fonction des conditions écologiques, nous n’avons pas pu prédire le nombre de chimpanzés femelles dans ces sous-groupes (Chapman et al. 1995). Même lorsque les ressources étaient extrêmement abondantes et que presque tous les mâles faisaient partie d’un grand sous-groupe, les femelles entraient rarement dans des groupes, ce qui suggère que le coût d’être dans un sous-groupe plus important l’emportait sur les avantages, tels que l’évitement des prédateurs. C’est inattendu du point de vue que les nourrissons de ces femelles seraient la classe d’âge / sexe la plus menacée par la prédation. Une hypothèse testable pour expliquer ces observations est que la nature des coalitions chez ces deux espèces peut influencer les avantages de l’appartenance à un groupe. Les preuves suggèrent que, contrairement aux chimpanzés, les femelles singes araignées forment des coalitions qui fonctionnent souvent pour permettre aux membres de la coalition un accès exclusif à la nourriture. Ainsi, les singes araignées, lorsqu’ils rejoignent des individus particuliers, peuvent augmenter leur accès à la nourriture en excluant les autres, mais ce n’est pas le cas pour les femelles chimpanzées (Chapman et al. 1995).
Nous avons identifié une autre déviation intéressante, potentiellement causée par des facteurs sociaux affectant les coûts et les avantages d’être en groupe, et cela concerne les colobes rouges et les singes colobes noirs et blancs (aka. guerezas, Colobe guereza) dans le parc national de Kibale, en Ouganda. Les colobes rouges forment de grands groupes comptant en moyenne 65 individus (25 à 127 individus, Snaith et al. 2008), tandis que les guerezas vivent en petits groupes avec une moyenne de 6,5 individus (4 à 11 individus, Harris & Chapman 2007). Malgré cette différence, il existe une grande similitude entre les plantes consommées par les deux espèces. Si les conditions écologiques étaient responsables de la différence de taille du groupe entre les deux espèces de colobines, on pourrait s’attendre à ce que leur régime alimentaire diffère et que la densité des arbres vivriers soit plus faible dans les domaines vitaux des guerezas, car ils ont la taille du groupe la plus petite. Cependant, leur régime alimentaire est très similaire; le chevauchement alimentaire entre un colobe rouge et un groupe guereza qui avait son domaine vital entièrement dans le domaine vital du groupe des colobes rouges était de 43.2%, alors que pour les deux groupes voisins de colobes rouges, le régime alimentaire ne se chevauchait que de 37,3% (Chapman et al. 2002). Il semble que le succès reproducteur des guereza femelles soit maximisé dans les groupes de petite et de moyenne taille, soit parce que les groupes plus importants connaissent des taux plus élevés de prise en charge et d’infanticide, soit une compétition alimentaire plus importante (voir les preuves de compétition de brouillage chez les folivores Trachypithecus phayrei et Semnopithecus sp. , mais un manque de preuves de guérezas appauvrissant les patchs alimentaires). Nous avons assisté à un certain nombre d’enlèvements d’hommes et de meurtres de nourrissons dans les guerezas (Onderdonk 2000) – voir Teichroeb &Sicotte (2008) pour une évaluation de la théorie concernant l’infanticide chez les colobins. Ce qui n’est pas clair, c’est comment le risque d’infanticide limiterait la taille des groupes guereza, alors qu’ils ont apparemment accès à une forte densité de nourriture qui devrait permettre la formation de groupes multi-mâles. Chez plusieurs espèces, les grands groupes de femelles sont davantage une cible pour les mâles immigrants, et cette situation peut augmenter les taux d’infanticide – par exemple, Semnopithecus sp. (Borries 1997), Theropithecus gelada (Dunbar 1984), Alouatta seniculus (Crockett&Janson 2000), Presbytis thomasi (Steenbeek& van Schaik 2001). Cependant, on s’attend à ce que l’infanticide soit moins fréquent si un groupe contient plusieurs mâles actifs sur le plan de la reproduction, car l’immigration masculine et la prise de pouvoir violente subséquente et l’infanticide sont moins susceptibles de se produire lorsque le nouveau venu est confronté à plusieurs parents possibles de futurs nourrissons (Janson& van Schaik 2000). Les Guerezas semblent disposer de ressources alimentaires suffisantes pour former des groupes plus importants (Tombak et al. 2012), ce qui diminuerait le risque d’infanticide, mais ils ne forment pas de grands groupes. Il est possible que la nature des interactions homme-homme chez guerezas rende de grands groupes instables. Cela semble être le cas chez le colobe d’ursine (Colobus vellerosus), où les groupes multi-mâles attirent des immigrants masculins et ont des taux d’infanticide plus élevés que les groupes avec un mâle adulte fort dans la fleur de l’âge (Teichroeb, Wikberg, Badescu, &Sicotte, données inédites; Figure 3). Thus, even when ecological conditions would permit large groups to form, social conditions preclude their formation (Chapman & Pavelka 2005).

Si le modèle de contraintes écologiques décrit les pressions qui influencent généralement la taille du groupe de primates et si les écarts par rapport à cette taille de groupe attendue résultent de pressions sociales, ce sera une période passionnante dans ce domaine de recherche car elle soulève un certain nombre de questions intéressantes. Exemple: Quelle est la nature des pressions sociales sur la taille du groupe? Pourquoi ces contraintes sociales sont-elles présentes chez ces espèces et ne sont-elles pas étroitement apparentées ? Et quelles sont les forces évolutionnaires qui sélectionnent ces pressions sociales ? La taille du groupe est un élément essentiel influençant le type d’organisation sociale que les espèces adoptent, de sorte que l’examen de ces questions conduira à des raffinements passionnants des modèles socio-écologiques.
Leave a Reply