ホスホフルクトキナーゼ(PFK)
内容
- 1はじめに
- 解糖における2役割
- 3メカニズムとホスホフルクトキナーゼの調節
- 4規制
- 5Pfkの二量体単位pfkの。
- 7部位特異的変異誘発
- 8疾患
- 9PFKの3D構造
導入
ホスホフルクトキナーゼ-1(PFK-1)は、ホスホリル基の移動を触媒する解糖酵素である。 解糖酵素を参照してください。 Mg2+もこの反応において重要である()。 ホスホフルクトキナーゼ-2(PFK-2)は、ADPとを得るために同じ基質に作用する。 . PFK反応は生理学的条件下で強くexergonic(不可逆的)であり、したがって解糖経路の律速段階の一つである。 ほとんどの有機体/ティッシュでは、pfkは解糖経路の主要な変化調整の酵素です;その活動はATP、ADP、AMP、PEPおよびフルクトース2,6bisphosphateを含む代謝物質の異常に大
は同一の320残基サブユニットの四量体である。 これはアロステリックの対称性モデルを用いて記述されたアロステリック酵素であり、その高活性R状態から低活性T状態への協調遷移がある。 酵素のR状態とT状態の両方のX線構造が報告されている。 その基質F6Pの一つの分子の結合は、高親和性でR状態の酵素に結合するが、低親和性でT状態の酵素に結合すると、PFKはR状態を占有し、これは ADPやAMPなどの活性化剤は、いわゆるアロステリックサイトに結合し、活性部位とは異なる結合部位に結合し、同様にR状態の形成を促進し、したがって酵素を活性化する(ヘテロトロピック効果;ADPはpfk反応の産物であり、酵素の活性部位にも結合する)。 同様に、PEPのような阻害剤は、アロステリック部位(PFKの場合には活性化アロステリック部位と重なる)に結合し、そこでT状態の形成を促進し、それによ
酵素の活性部位の二つは、シアンの基質とマゼンタの活性部位界面との界面に位置しています。 さらに2つの活性部位は、サブユニットB(緑)とC(ピンク)の界面にある。 サブユニットD(黄色)のクローズアップは、サブユニットA(水色)とD(黄色)の両方からのアミノ酸がF6Pの結合に寄与することを示しています。 サブユニットAのクローズアップは、両方のサブユニットからADPの結合への寄与を示しています。 PFKのR状態とT状態の間の立体配座の変化を以下に示す。R状態PFKの原子座標は4pfkから得られ、T状態PFKの原子座標はPhilip Evans,Mrc Laboratory of Molecular Biology,Cambridge,U.K.から得られたが、現在では6pfkとして入手可能である。
r状態pfkの原子座標は4pfkから得られた。解糖における役割
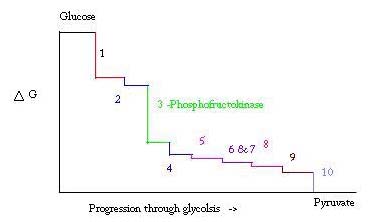
解糖は、嫌気性呼吸に使用されるピルビン酸を作るためにグルコースを調製し、分解するプロセスであり、クエン酸サイクルの開始反応物の一つとして使用される。 解糖の過程における三つの点は、大きな負の自由エネルギーで起こり、したがって不可逆的である。 これらの三つのポイントは、ヘキソキナーゼ、ホスホフルクトキナーゼ、およびピルビン酸キナーゼであり、これら三つのPFKのΔ G=-25.9kJ/molの筋肉における解糖の主要な調節ポイントと考えられている。
ホスホフルクトキナーゼのメカニズムと調節
ホスホフルクトキナーゼは、Mg2+-ATPとフルクトース-6-リン酸(F6P)の両方を結合し、フルクトース-1,6-ビスリン酸とMg2+-ADPを作る。 これらの生成物の両方との画像は決定されていないが、酵素との結合はされている。 サブユニットごとに3つのリガンド結合部位がある。 二つはF6PとATPに結合する活性部位を構成し、三つ目はアロステリック結合部位である。 活性部位に関与するいくつかの提案された残基が含まれる。 PFKは二つの立体配座状態に存在し、両方とも平衡状態にある。 ATPは両方の立体配座で活性部位とアロステリック部位の両方に結合する。 ATPは活性部位を同様によく結合するが、T状態のアロステリック部位を優先的に結合するこの優先的結合は、二つの状態の平衡からF6Pに対する親和性を低下させるT状態のより多くの量へのシフトを引き起こす。 ADP、AMPおよびF2と共に、6PはATPの規定する役割を禁じます。 ATPのPfkのKmはです。020mmと.032mm.
規制
解糖は、生存のために不可欠な代謝プロセスです。 したがって、その活性化および抑制において、それは高度に調節されなければならない。 解糖の過程における三つの点は、大きな負の自由エネルギーで起こり、したがって不可逆的である。 これらの3点はヘキソキナーゼ,ホスホフルクトキナーゼ,ピルビン酸キナーゼである。 これらの三つの反応は高い負の自由エネルギーのために調節の主要な点となる候補である。 3つのうち、PFKは筋肉の解糖(下の写真の#3)の主要な調節点と考えられており、Δ G=-25.9kJ/molであるため、コミットされたステップです。 PFKがF6PをF1、6Pに変換すると、逆になるために克服しなければならないエネルギー量が多いため、反応は容易に逆転することはありません。 . このエネルギー障壁はピルビン酸塩のキナーゼが最終的な反作用(#10)に触媒作用を及ぼし、プロセスがグリコーゲンから始まるときヘキソキナーゼ(#1)が解糖に p>
PFKはATP、AMP、およびADPによって調節されています。 ATPはRとTの両方の状態で同じようによく活性部位に結合するが、それは優先的にT状態のアロステリックサイトに結合しますこの優先結合は、F6P 下のグラフからわかるように、PFKの活性のプロットはシグモイドである。 これは、酵素の協調的性質をさらに実証する。 酵素への基質の最初の結合は困難であるが、それが結合し、T->Rからの状態の変化を強制すると、他の基質ははるかに容易に結合する。 グラフには、ATPを追加するとプロットが右に移動し(つまり、F6Pの親和性が低下します)、AMPを追加すると左に移動することも示されています。p>
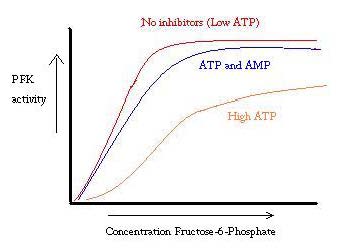
規制のシステムは、PFKの機能とよく一致しています。 PFKが活動的であるとき、ATPはそれ以上のプロダクトがより完全に破壊されると同時にそれからの流れの下で作り出されています。 したがって、ATPレベルが低く、より多くの必要がある場合、ADPが高濃度になるため、PFKの活性が増加する。 反対は高いATPの集中が蛋白質の活動を禁じるので、また本当保持する。 しかし、この説明は、ATPのレベルが活発な筋肉と休息している筋肉の間で十分に大きく変化しないため、PFKの調節を完全に説明することはできません。 アロステリック規制の別の手段を見つける必要があります。 ATPのためのPfkのKmはあります。
020mmと.032
このキネマージュ運動は、Bacillus stearothermophilusのpfkで起こるアロステリック誘発型立体配座変化のいくつかを示す二つのキネマージュシーンで構成されています。
PFKの二量体単位の立体配座変化
このキネマージュは、界面が二つの活性部位を含む四量体の二つのサブユニットを示しています。 (KineMageは現在サポートされていません)最初のビュー、1:PFKダイマーは、ピンクの色合いのサブユニット1とピンクのサブユニット2とのCaバックボーンで表されるように、それらのR状態の立体配座の二つのサブユニットを示しています。 各サブユニットにおける2つの側鎖、TおよびR状態におけるF6P結合部位の一部であるGlu1 6 1(赤色)およびArg1 6 2(シアン)の側鎖を、srespectivelyに示す(下記参照)。 F6P(hotpink)およびADP(green;「ADP−active」)は、各サブユニットの活性部位に結合される。 付加的なADP(黄色;「ADP−allo」)は、各サブユニットの別個のいわゆるアロステリック部位に結合される。 Adpはそれぞれ、関連するMg2+を有し、これは、ここでは、それが結合するADPと同じ色のボールによって表される。
“ANIMATE”ボタンをクリックして、二量体をR状態とT状態の間で切り替えます。 T状態では、サブユニット1はbluetint、サブユニット2はskyblueです。 両サブユニットのGlu161とArg162の側鎖は以前と同様に赤色とシアンである(サブユニット1のArg162側鎖のCaとCb原子のみがT状態のX線構造で観察され、サブユニット2のものはすべて観察される)。 T状態酵素は、解糖中間体ホスホエノールピルビン酸(PEP)の非生理学的類似体である阻害剤2-ホスホグリコール酸(gold;”PGC”)に結合する。 T状態のPGCの結合部位は、R状態のADPのアロステリック結合部位(「ADP−アロ」)と重複し、したがってそれらの結合は相互に排他的であることに留意されたい。 F6Pを含有しないT状態活性部位は、R状態酵素におけるF6Psと同じ位置を有する「ゴースト」F6Ps(gray;「F6P部位」)によってマークされる。
第二のビュー、2:アロ/Act部位は、この領域における活性部位およびアロステリック部位の両方を示す第一のビューの上部のクローズアップである。
第二のビュー、2:アロ/Act部位は、この領域における活性部位およびアロステリック部位の両方を示す第一のビューの上部のクローズアップである。 活性部位は二つのサブユニット間の界面に位置し、アロステリックサイトは隣接するサブユニット上の活性部位と直接相互作用することに注意してください。 両方を一度に表示するか、”ANIMATE”をクリックすることで、R状態とT状態のコンフォメーションを比較します。 R状態の酵素に結合した各Adpに関連するMg2+イオンを特定できますか? どのADP原子がこれらのMg2+イオンを調整していますか?
PGCのリン酸基は、”ADP-allo”のβリン酸基がR状態のアロステリック部位に結合するのと非常にほぼ同じ位置でT状態のアロステリック部位に結合し、両方のリン酸基は同じ三つの残基(2argおよび1Lys;図示せず)の側鎖に結合する。
高活性R状態では、Arg162の正に帯電した側鎖は、f6Pの負に帯電した6-リン酸基(白い破線)と水素結合塩橋を形成し、これはおそらくT状態に対してR状態を安定化させる相互作用であり、したがってF6Pのホモトロピック効果の一部に関与している。
PFKのサブユニットにおける主要な立体配座の変化。
このKINEMAGEは、アロステリック部位の近くにそれらのセグメントを示しています(残基53-60はここでは示されていません)。 KINEMAGE1と同様に、ポリペプチドは、そのCa鎖によって表され、redtintおよびpinkではR状態サブユニット1および2、bluetintおよびskyblueではT状態サブユニット1および2で表される。 (KineMage現在サポートされていない)KINEMAGE2は、ビュー1に登場:アロステリック部位、Arg162(シアン)の側鎖と水素結合塩橋(破線の白線)で酵素の活性部位に結合したF6P(hotpink)のリン酸基を示すR状態である。 ADP(黄色;「ADP−allo」)は、隣接するアロステリック部位を占有する。 「ANIMATE」を1回クリックすると、T状態に切り替わります。 これは、r状態のアロステリック部位のADPを阻害剤およびPEPアナログPGC(gold)で置換する。 F6Pはもはやアクティブなサイトを占有しませんが、R状態でのその位置は”ゴースト”F6P(灰色;”F6Pサイト”をクリックして表示)によって示されます。
RからTへの遷移における中心ポリペプチドヘリカルセグメント(残基149-164)はどうなりますか? これは、負に帯電したGlu1 6 1および正に帯電したArg1 6 2の相対位置に対して何をするのか? 「F6Pサイト」をクリックします。 Arg162の正電荷の欠如は、F6Pの結合にどのような影響を与えるでしょうか? これは、少なくとも部分的には、なぜt状態PFKがF6Pに対して親和性が低いのかを説明していますか? F6Pとサイドチェーンの相互作用のクローズアップについては、”View2:Closeup”に移動します。 “ツール”メニューから”pickcenter”を選択し、中央に配置したい原子をクリックして分子を中央に配置します。 ビューを拡大するには、”ズーム”スライダをスライドさせます。
部位特異的変異誘発
一度に、Glu161の負電荷は、T状態でのF6P結合に負の効果を有すると考えられていた。 このアイデアは、部位特異的変異誘発実験によって支持されていない。 R162A、E161AおよびR162A/E161Aを含むいくつかの変異Pfkが作られている。R162a変異は、F6P結合の30倍の減少を引き起こした。 しかし、E161A変異は、F6P結合を阻害するPEPの能力にほとんど影響を与えなかった。
疾患
遺伝性赤血球PFK欠乏症は、ミオパチーおよび溶血(樽井病)と関連している。PFKの3D構造
ホスホフルクトキナーゼ3D構造
Leave a Reply