有機化学II

実験的には、C2-C3結合の周りの回転に大きな障壁があり、分子全体が平面であることが観察されています。 さらに、C2−C3結合は、1 4 8pmの長さであり、典型的な炭素−炭素単結合(約1 5 4pm)よりも短いが、典型的な二重結合(約1 3 4pm)よりも長い。
分子軌道理論は、非局在化pi結合の概念でこれらの観測を説明しています。 この図では、4つの2p原子軌道が数学的に結合して、エネルギーが増加する4つのpi分子軌道を形成しています。 これらのうちの2つ-結合pi軌道–は、それらが形成されるp原子軌道よりもエネルギーが低く、一方、2つ–反結合pi*軌道-はエネルギーが高い。p>

最低エネルギー分子軌道pi1は、建設的な相互作用とゼロノードのみを持っています。 エネルギーは高いが、孤立したp軌道よりもまだ低いため、pi2軌道は1つのノードを持っているが、2つの建設的な相互作用を持っている–したがって、それはまだ全体的に結合軌道である。 二つの反結合軌道を見ると、pi3*は二つのノードと一つの建設的な相互作用を持ち、pi4*は三つのノードとゼロの建設的な相互作用を持っています。
aufbauの原理により、孤立した2pz原子軌道からの四つの電子は、結合pi1とpi2MOの中に配置されます。 Pi1にはC2とC3の間の建設的な相互作用が含まれているため、1,3-ブタジエン分子には、これら二つの炭素間のpi結合相互作用の程度があり、その長さが短く、回転に対する障壁がある。 1,3-ブタジエンの価電子結合像は、二つのpi結合が互いに単離されていることを示しており、pi電子の各ペアはそれ自身のpi結合に”スタック”している。 しかし、分子軌道理論は、4つのpi電子がpi系全体にわたってある程度非局在化されるか、または”広がっている”と(正確に)予測しています。p>

1,3-ブタジエンは共役π結合の系の最も単純な例である。 共役と考えるためには、二つ以上のpi結合は一つの単結合によって分離されなければならない–言い換えれば、介在するsp3ハイブリダイズ炭素は存在しない。 以下の化合物では、例えば、C1−C2およびC3−C4二重結合は共役であり、一方、C6−C7二重結合は、sp3−ハイブリダイズC5によって他の2つのpi結合 p>

心に留めておくべき非常に重要な概念は、共役に関連する固有の熱力学的安定性があるということです。 この安定性は、二つの異なるジエンの水素化熱を比較することによって実験的に測定することができる。 (水素化は、第15章でもっと学ぶ反応タイプです:本質的に、それは水素分子–2つの陽子と2つの電子–をp結合に加えるプロセスです)。 1,3-ペンタジエンの二つの共役二重結合が”水素化”されてペンタンを生成すると、形成されたペンタンのモル当たり約225kJが放出される。 1,4-ペンタジエン中の二つの単離された二重結合が水素化され、ペンタンを形成するときに放出される約250kJ/molと比較してください。
1,3-ブタジエンやイソプレンなどのジエンからの合成ポリマーの形成は、セクション18.5で議論されています。 合成ポリマーは、より小さな繰り返し単位で構成される大きな分子です。 あなたはおそらく、これらのポリマーの数にやや精通している;例えば、ポリエチレン、ポリプロピレン、ポリスチレン、ポリ(塩化ビニル)。

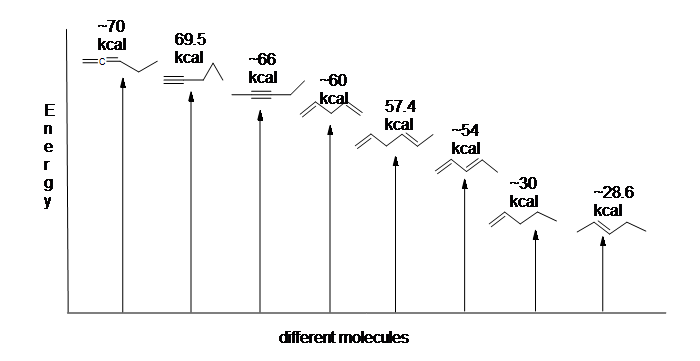
図13.6:1,3-ブタジエンの水素化のためのエネルギー図(スケールしない)。
1,3-ブタジエンの水素化は予測されたエネルギー量よりも少ないため、1,3-ブタジエンのエネルギー含有量は予想よりも低くなければならない。 言い換えれば、1,3-ブタジエンは、その式が示唆するよりも安定である。
共役ジエンはエネルギーが低く、言い換えれば、より安定である。 一般に、共役π結合は単離されたπ結合よりも安定である。ここでは、各分子(1kcal=4.18kJ)の相対的な安定性を示すために、異なるタイプの結合とそれらの水素化熱(モル当たり)を比較するエネルギー図である。
ここでは、各分子(1kcal=4.18kJ)の相対的な安定性を示している。 (水素化熱(π結合あたり)が低いほど、構造はより安定である。p>
共役によるジエンの安定化は、ベンゼンの芳香族安定化よりも劇的ではない。 それにもかかわらず、共役の同様の共鳴と分子軌道の記述が書かれている可能性があります。
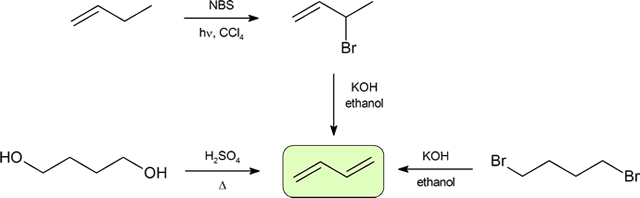
ジエンの合成
共役ジエンを合成する最も頻繁な二つの方法は、アルケンの調製(セクション9.9)で導入されたアルコールの脱水とオルガノハライドのデヒドロハロゲン化である。 以下のスキームは、共役ジエンを調製するための経路のいくつかを示している。
共役pi系は、酸素および窒素原子だけでなく、炭素を含むことができます。 脂肪分子の代謝において、重要な反応のいくつかは、カルボニル基に共役しているアルケンを含む。 p>

MO理論は、共役pi結合の拡張系を含む有機分子がしばしば独特の色を持つ理由を説明するのに非常に有用です。 ニンジンのオレンジ色を担う化合物であるベータカロチンは、11個の共役π結合の拡張系を有する。p>


演習2.10:リコピン、トマトの赤色化合物中のすべての単離された共役pi結合を識別します。 共役π系にはいくつのπ電子が含まれていますか?p>
Leave a Reply