腫瘍学におけるFrontiers
はじめに
早期乳癌患者の約25%がまだ局所再発を経験し、能動治療後に遠隔metastasesを発症する(1)、先進国では約10%が初期診断時にIV期疾患にあり、これはde novo metastasic breast cancer(mbc)と呼ばれる(2)。 治療の進歩にもかかわらず、MBCは不治のままであり、MBC患者の最大70〜80%が5年以内に癌で死亡します(2)。 MBCの異質性の結果として、予後因子またはスコアに基づく複数の予後モデルが開発され、臨床転帰を予測し、臨床医に適切な治療上の決定を下すように指示される(3-5)。 さらに、臨床医がこれらの患者の生存を正確に予測するための脳転移を伴う乳癌(BCBM)の様々な予後モデルも存在する(6、7)。乳がんは体内のどこにでも転移することができますが、主に肺、骨、肝臓、非腋窩リンパ節、および脳に転移することができます(8)。 特に、肝転移(LM)は、一般的な転移部位であるだけでなく、脳転移と同様に有意に増加した死亡リスク、肺または骨転移と比較して不釣り合いに高い死亡率(5、8)。 グレード予後評価(GPA)がBCBM患者で広く受け入れられているように、上記の予後モデルは、BCLMのための実用的なモデルを提案するために私たちを刺激する(3-7)。 私たちの目的は、BCLMの信頼性とユーザーフレンドリーな予後モデルを構築し、内部と外部の両方を検証することによって、その一致と精度を評価すること 予後モデルは、臨床医がBCLM患者の死亡リスクを推定し、最適な治療法を選択するのに役立つ可能性がある。
患者と方法
患者の選択
本研究は、FUSCCの独立した倫理委員会によって承認されました。 2007年から2018年にかけてFUSCCで診断された連続したMBC患者が同定された(n=9,062)。 資格基準は以下の通りであった。: (1)組織学的に確認された乳癌、(2)女性患者、(3)デノボ転移性または再発性乳癌のいずれかにおける転移性疾患の最初の部位としての肝臓、および(4)完全 両側性乳癌、他の浸潤性新生物、または未知のフォローアップを有する患者は除外された。 最後に、さらなる分析のために選択された1,022人の適格な患者があった。 選択の全ステップを図S1に示します。
変数の研究とカットオフ値の選択
情報は、以下の臨床病理学的変数について収集されました: 年齢、分子サブタイプ、事前治療情報(手術および全身化学療法)、MFI、肝外metastasisの部位(脳、肺、骨、リンパ節)、肝metastasisの特徴(分布、数、最大直径)、ヘモグロビン(HB)、肝機能検査、およ 分子サブタイプには、ホルモン受容体(HR)とヒト表皮成長因子受容体2(HER2)の状態が含まれていた。 原発性乳癌の診断日と最初の遠隔metastasisの日付との間の間隔としてMFIを定義した。 この研究で使用されたMFIのカットオフポイントは、参考に応じて3ヶ月と24ヶ月であった(9)。 したがって、患者は3つのグループに分けることができます:de novo MBC患者(MFI<3ヶ月)、短いMFI患者(≥24ヶ月)、および長いMFI患者>24ヶ月。 遠隔リンパ節metastasisは同側えきか,鎖骨上,鎖骨下,乳房内リンパ節からの転移と定義された。 LMの診断はx線像または病理学的証拠に基づいていた。 腹部c t,mri,外科的切除標本を用いて肝metastasisの特徴を評価した。 総ビリルビン,アラニンアミノトランスフェラーゼ(ALT),アスパラギン酸アミノトランスフェラーゼ(AST),アルカリホスファターゼ(ALP),乳酸デヒドロゲナーゼ(LDH),γ-グルタミルトランスフェラーゼ対アルブミン比(GAR)を含む肝機能試験も解析した。 血液サンプルはLMの診断の後の1週以内の実験室試験のために取られました。 肝metastasesおよびLDHの分布、数、または最大直径の分類は、他の研究に基づいていた(10-13)。 ヘモグロビンレベルまたは肝機能の中等度またはグレードIIの異常が治療の選択に影響を与える可能性があるため、HB、総ビリルビン、ALT、AST、およびALPの GARの値は血清-グルタミルトランスフェラーゼ(GGT,U/L)レベルと血清アルブミン(ALBG/L)レベルとの単純な比として定義した。 転移時からのOSは,LMの診断日から死亡までの任意の原因について測定した。 最後のフォローアップ期間は2019年11月で、フォローアップ期間の中央値は18.63ヶ月でした。 患者がフォローアップに失われた場合、それはフォローアップの最後の日に検閲されました。患者をトレーニング(2007-2016、n=715)と検証(2016-2018、n=307)に分け、7:3の比率で設定しました。
統計分析
患者をトレーニング(2007-2016、n=715)と検証(2016-2018、n=307)に分けました。 Garの最適カットオフ値は、Youdenインデックスとレシーバ動作特性曲線(ROC)解析の計算によって選択されました(図S2)。 Pearsonカイ二乗検定またはFisherの正確検定を利用して,カテゴリ変数間の比較を行った。 後方選択法を用いたcox比例ハザード回帰モデルを多変量解析とハザード比の計算に用いた。 回帰係数を多変量回帰分析によって計算し、次に10を乗算し、最終的な予後スコアを表すために四捨五入した。 ブートストラップは内部検証に使用されました。 次に、時間依存ROC曲線および較正プロットを使用して、検証セットにおけるこの予後モデルの識別および較正を評価した。 リスク群のカットオフ値は、Xタイルプロット(15)によって決定された。 生存分析は、Kaplan−Meier生存曲線を用いて実施し、生存曲線を比較するために対数ランク試験を使用した。 すべてのP値は両側であり、P<0.05の値は統計的に有意であると考えられた。 統計分析は、SPSSソフトウェア(Spss2 0,Chicago,IL,USA)およびRソフトウェアバージョン4.
結果
特性とリスク層別化との関係
この研究で選択された1,022人の患者の合計は、トレーニング(n=715)と検証(n=307)セットに分けられました。 臨床病理学的特徴の説明を表1および表S1に示す。 訓練群では、de novo MBCと診断された126人の患者(17.6%)と再発MBCと診断された589人の患者(82.4%)があり、そのうち297人の患者(50.4%)が短いMFIを有し、292人の患者(49.6%)が長いMFIを有していた。 LMの診断時の年齢の中央値は50(範囲21-87)年であり、617人の患者(86。3%)60歳未満。 これらの患者のうち、HR陽性およびHER2陽性患者の割合は、それぞれ62.2および38.0%であった。 再発性MBC患者のうち、ほぼすべての患者が原発腫瘍(584、99.2%)の手術を受け、(neo)補助化学療法(569、96.6%)を受けた。 遠隔metastasisのパターンは、肝外metastasisの最も一般的なサイトは、骨(42.7%)、遠隔リンパ節(36.1%)、肺(25.6%)、および脳(2.9%)に続いていたことを示した。 肝metastasisはびまん性分布と小結節によって特徴付けられ、その大部分は複数(≧3転移、77.3%)であったが、小結節(≧3cm、59.4%)であり、左右の葉(74.4%)を関与させた。 LMの初期段階では,肝機能は様々な程度に障害されたが,一般的に軽度であった。 LDH(36.1%)とGAR(35.9%)の上昇は、敏感な肝機能障害の指標であると思われ、HB(2.9%)、総ビリルビン(2.7%)、ALT(3.6%)、AST(9.5%)、およびALP(3.9%)レベルの中等度以上の異常は、CTCAEによると 低リスク群と比較して、中間および高リスク群は、HRおよびHER2陰性、短いMFI、肝外metastasis、肝metastasis腫瘍負荷、およびヘモグロビンレベルまたは肝機能の異常(すべてのPs≥0.001)の高い率を提示し、これらの要因がBCLMの予後に影響を与える可能性があることを示唆している。テーブル1
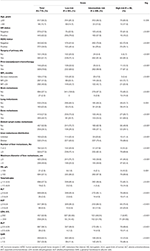
テーブル1。 ベースライン特性とトレーニングセットのリスク層別化との関係。
予後モデルと検証
多変量Cox回帰モデルでは、分子サブタイプ(HRおよびHER2状態)、MFI、肝外metastasisの部位(脳、肺、骨metastasis)、および肝機能検査(総ビリルビン、LDH、およびGAR)がOSと関連していた(表2)。 具体的には、HR陰性(HR1.740、95%CI1.424–2.127、P<0.001)およびHER2陰性(HR1.615、95%CI1.316–1.983、P<0.001)….. MFIの長さはBCLM患者の生存にも有意な影響を与えたため、mfiが長い患者(HR1.612、95%CI1.195–2.174、P<0.001)の生存は、de novo MBC患者と比較して短縮され、mfiが短い患者(HR2.563、95%CI1.904–3.449,p<0.001)は、それらに比べて死亡リスクが倍以上でした。 さらに、肝外metastasis(脳、肺、および骨metastasis)および異常な肝機能(総ビリルビン、LDH、およびGAR)の存在は、すべてOSに対する好ましくない予後への影響と相関していた。 この予後モデルは、1年OSでの時間依存ROCの曲線下面積(AUC)を有し、トレーニングセットでは0.78、検証セットでは0.80であり、このモデルが良好な差別を有 ブートストラップ法を使用して、トレーニングセットにおける予後モデルの安定性を確認し、最終結果はかなり堅牢であった(表S2)。 トレーニングセットにおける1年および3年OSおよび検証セットにおける1年OSの予後モデルの検量線は、良好な一致を示した(図2)。テーブル2

テーブル2。 多変量Cox回帰モデル(トレーニングセット)。図1
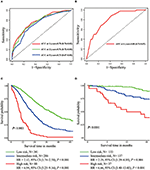
図1。 学習セット(A)および検証セット(B)における予後モデルの時間依存ROC曲線。 トレーニング(C)および検証セット(D)における三つの予後群の転移からの全生存。
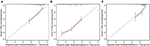
図2。 トレーニングセットでは1年(A)および3年(B)、検証セットでは1年(C)での患者の生存を予測するための検量線。
リスク層別化と生存

表3。 予後グループのスコアとカットオフポイントの計算。
Discussion
2007年から2018年にかけて当施設で治療された1,022人の患者の現在の分析では、分子サブタイプ(HRおよびHER2ステータス)、MFI、肝外metastasisの部位(脳、肺、骨metastasis)、肝機能検査(総ビリルビン、LDH、およびGAR)がBCLM患者の独立した予後因子であることが示されている。 したがって,予後因子を用いてBCLM患者の予後モデルを構築した。
分子サブタイプに関しては、HR陽性は、乳癌の増殖および増殖が依然としてホルモン依存性腫瘍と呼ばれるホルモンによって調節されているこ 同時に、内分泌療法に頻繁にHR陽性の患者に長期存続の利点を持って来ることができる長続きがする効果および少数の不利な反作用を含む利点が 従って、HRの陽性は早いおよび転移性乳癌の好ましい予想を提案する重要な要因とみなされました(1, 3-5, 8-10, 16). HER2増幅と過剰発現は、遠隔metastasisと乳癌関連死のリスクの予測因子であると考えられているが、その後に開発された抗HER2剤は、著しくher2陽性乳癌患者(2、9、17)の生存を改善している。 標的療法の時代に、オランダ南東部での研究では、HER2陰性患者の死亡リスクがher2陽性患者と比較して44%(95%CI1.13-1.83、P=0.003)増加したことがわか 我々の研究では、HR陰性およびHER2陰性患者の死亡リスクは、これらの観察と一致して、HRまたはHER2陽性の対応者と比較して増加した。 通常は24ヶ月以上と定義される短いMFIを有する患者は、予後が悪化していた(3、5、9)。 さらに、de novo MBC患者は、再発MBC患者と比較して有意に良好な予後を有するように見えたが、この差は無病間隔(DFI)またはMFI(9、18、19)の延長とともに徐々に減少した。 Lobbezooら。 MFI≥24ヶ月の患者は有意に短い生存時間を持っていたことがわかった(9.1対29。4ヶ月、p<0.001)はde novo IV期疾患の患者よりも、しかし、MFIが長い患者(>24ヶ月)は同様の予後を有していた(27.9対29.4ヶ月、P=0.73)(9)。 この現象の可能性のある理由は、以前に体系的な治療を受けている再発MBCの患者は、de novo MBCの治療未経験の患者よりも化学療法に抵抗性がある可能性があるが、さらなる調査が保証されていることである(9、18、19)。 この研究は、長いMFIを有する患者の生存時間が有意に悪い転帰を付与する短いMFIを有する患者とde novo MBCと比較して短縮されたことを確認した。
MBCの生存率は転移部位によって有意に異なり、内臓metastasisを有する患者は、非内臓metastasisを有する患者と比較して死亡リスクの増加と関連していた(3-5、9、18)。 さらに、脳転移の存在は、他の転移部位よりも生存に大きな影響を与えた(3, 5, 9, 18). 複数の転移が予後により好ましくない影響を与えたことは驚くべきことではなかった(3, 5, 9, 17, 18). 本解析では,遠隔リンパ節metastasisを除く肝外metastasisは,リンパ節metastasisと比較して肝metastasisが批判的に生命を脅かす因子であるため,生存期間の短縮につながる可能性がある。より高いビリルビン値を有する患者は、その抗酸化および抗炎症特性(を介して部分的にいくつかの疾患のリスクがはるかに低いことに留意すべき 最近の研究はまた、死亡リスクのほぼ40%の減少は、より高い総ビリルビンレベル(と早期乳癌患者の間で示されたことを報告した21)。 しかし、高ビリルビン血症はBCLM患者の予後不良と関連していた(22)。 非転移性乳癌患者の総ビリルビンが比較的高いのとは異なり、BCLM患者の正常(ULN)の上限よりも1.5倍高いビリルビンが重度の肝障害を予測し、薬物中止や肝脳症に寄与する可能性がある。ウォーバーグ効果は、酸素供給が十分であっても好気性解糖に依存するように癌細胞を駆動し、これは正常組織とは対照的に癌代謝の特徴である(23)。 LDHは、嫌気性条件下でピルビン酸塩を乳酸塩に変換する能力のために解糖に不可欠な役割を果たしている(24)。 LDHの規制緩和されたレベルは、以前に複数の腫瘍で報告されていた、より高い腫瘍負担、より悪い治療応答、および予後を反映する可能性がある(21、24-26)。 乳がん患者におけるLDHの予後効果に関するメタアナリシスは、LDHレベルが高いほどOSが不十分で無増悪生存率が得られ、6,102人の患者を対象とした11件の研究が含まれていることを示した(27)。主要な内因性抗酸化物質であるGGTは、前駆体アミノ酸を同化させ、グルタチオン合成に関与します(28)。
腫瘍におけるGGTは、酸化促進抗癌治療を受けた後に細胞がグルタチオンを迅速に補充することを可能にし、したがって、薬物耐性および生存不良(と相関している29)。 興味深いことに、Fentiman e t a l. GGTの上昇と乳がんリスクの間に有意に正の関係が同定されたことを報告した(30)。 肝臓で合成されたALBは、抗酸化物質、栄養素の輸送体として機能し、その独特の構造特性のためにシグナル経路に関与している(31)。 低アルブミン血症は、通常、進行癌患者で発生し、肝合成障害、異化の増加、および悪液質(を含む様々なメカニズムに起因する21、31)。 低アルブミン血症は、様々な腫瘍の予後不良の独立した指標である(21, 22, 32, 33). 血清アルブミンレベルの低下とは対照的に、肝機能が損なわれると血清GGTレベルが上昇する傾向がある。 したがって、上記の二つのパラメータに基づくGARは、肝臓の予備能力を反映し、予後を予測する利点を有することができる(32、33)。 現在の研究では、異常な肝機能(総ビリルビン、LDH、およびGAR)はすべてOS上の好ましくない予後への影響と相関していた。
123BCLM患者の予後を分析した後、Duan et al. 3つ以上の肝転移を有する患者が2つを運んだことがわかった。多変量解析における<3肝metastasesを有する患者と比較して死亡リスクが26倍増加した(10)。 しかし,本研究における肝metastasisの特徴は差がないと思われた。 この不一致に寄与する2つの潜在的な理由があります。 まず,肝metastasesの分布,数および最大直径は三つのリスク群で有意に異なり,一変量解析における肝metastasesの拡大とともに死亡リスクが増加することを示した。 その後,肝機能異常は肝metastasisの腫よう負荷と密接に関連しており,多変量解析におけるこれらの因子の役割を調整していた。BCLMの設定における予後因子に関する多くの研究が行われている。
BCLMの設定における予後因子に関する多くの研究が行われている。
145BCLM患者の分析は、低アルブミン血症、高齢、およびER陰性が貧しい生存(の独立した予測因子であったことを示した22)。 ギリシャのレジストリ分析は、HR陽性、低い組織学的グレード、肝外metastasisの欠如、および良好なパフォーマンス状態が単変量解析(34)における良好な予後のための有意な予後因子であった同様の結果を得た。 De novo BCLMを有する4,000人以上の患者を含む最近の人口ベースの研究では、人口統計学的および社会経済的要因、病理学的グレード、肝外metastasisの総数、治療、および分子サブタイプが全生存に有意に影響を与えるパラメータとして同定されている(17)。 Regierer et al. HR状態、MFI、および転移部位に基づいてMBCの予後スコアを開発し、予後を予測し、最適な治療を個別化し、内部および外部で検証した(5)。 残念なことに、HER2の状態は予後スコアに含まれていなかったため、その適用性が制限されました。 4つの単純な臨床パラメータを統合したBCBM患者の修正された乳房GPAは、生存を予測する上で直接的な役割を果たしたが、BCLM患者には適用できなかった(7)。 我々の知る限りでは、BCLM患者のためのこれらの予後因子を統合する予後モデルはないので、我々のモデルは実用的に理にかなっています。この研究にはいくつかの制限もありました。
私たちの予後モデルは、内部および外部で検証されたが、まず、単一のセンターとレトロスペクティブ研究は必然的に選択バイアスをもたらした。 第二に、疾患経過後に肝metastasisを発症した患者を除外し、これらの患者を評価することができなかった。 第三に、パフォーマンスの状態と治療に関する詳細な情報は、この研究では利用できませんでした。
結論
これらの制限にもかかわらず、この研究は、シンプルで信頼性の高い予後モデルを提供することができます。 我々の研究の主な利点は、BCLM患者の大規模なサンプルに基づいて臨床現場で容易にアクセスできるパラメータの組み込みです。 次世代配列決定法による腫瘍の絶妙な分類とは別に、我々のモデルは、異なる予後を有するサブグループを同定し、その後の治療を導くのに役立つ可能性
データ可用性声明
研究で提示された元の貢献は、記事/補足資料に含まれており、さらに問い合わせは、対応する著者/sに向けることができます。
倫理声明
本研究は、FUSCCの独立した倫理委員会によって承認されました。 患者/参加者は、この研究に参加するための書面によるインフォームドコンセントを提供した。
著者の貢献
LJは研究を提案しました。 XZとYGはデータを収集しました。 LJとLFはデータを分析し、最初の草案を書いた。 ZWはこの原稿を批判的にレビューした。 すべての著者は記事に貢献し、提出されたバージョンを承認しました。
利益相反
著者らは、この研究は、潜在的な利益相反と解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言し
謝辞
データ分析を実行するためのLei Chengを承認します。
補足資料
略語
BCLM、肝metastasisを伴う乳癌;Fuscc、復旦大学上海癌センター; RO受容体;her2、ヒト表皮成長因子受容体2;CT、コンピュータ断層撮影;MRI、磁気共鳴イメージング;ALT、アラニンアミノトランスフェラーゼ;AST、アスパラギン酸アミノトランスフェラーゼ;ALP、アルカリホスファターゼ;LDH,乳酸デヒドロゲナーゼ;gar,γ-グルタミルトランスフェラーゼ対アルブミン比; GGT,γ-グルタミルトランスフェラーゼ;ALB,アルブミン;CTCAE,有害事象のための一般的な用語基準;ULN,正常の上限.
4. Puente J,Lopez-Tarruella S,Ruiz A,Lluch A,Pastor M,Alba E,et al. 転移性再発乳癌患者のための実用的な予後指標:GEICAM Spanish El Alamo Registerからの2,322人の患者のレトロスペクティブ分析。 乳癌のResの御馳走。 (2010) 122:591–600. 土井:10.1007/s10549–009-0687–4
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Regierer AC, Wolters R, Ufen MP, Weigel A, Novopashenny I, Kohne CH, et al. An internally and externally validated prognostic score for metastatic breast cancer: analysis of 2269 patients. Ann Oncol. (2014) 25:633–8. doi: 10.1093/annonc/mdt539
PubMed Abstract | CrossRef Full Text
6. マルコNF、Xu Z、Gao T、Kattan MW、Weil RJ。 乳癌および脳metastasisを有する女性の生存を予測する:ノモグラムは、現在の生存予測モデルよりも優れている。 がんだ (2012) 118:3749–57. doi:10.1002/cncr.26716
PubMed Abstract|CrossRef Full Text|Google Scholar
7. Subbiah IM,Lei X,Weinberg JS,Sulman EP,Chavez-MacGregor M,Tripathy D,et al. 乳癌および脳転移を有する患者における生存のためのツールとしての修正乳房グレード予後評価の検証と開発。 Jクリン-オンコール (2015) 33:2239–45. 土井:10.1200/JCO.2014.58.8517
PubMed Abstract|CrossRef Full Text|Google Scholar
9. Lobbezoo DJ,van Kampen RJ,Voogd AC,Dercksen MW,van den Berkmortel F,Smilde TJ,et al. 転移性乳がんの予後:de novo患者と再発性転移性乳がん患者の間に違いはありますか? Br J Cancer. (2015) 112:1445–51. doi: 10.1038/bjc.2015.127
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Duan XF, Dong NN, Zhang T, Li Q. The prognostic analysis of clinical breast cancer subtypes among patients with liver metastases from breast cancer. Int J Clin Oncol. (2013) 18:26–32. doi: 10.1007/s10147–011-0336-x
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dueck AC,Mendoza TR,Mitchell SA,Reeve BB,Castro KM,Rogak LJ,et al. 米国国立がん研究所の患者報告アウトカムの妥当性と信頼性有害事象のための一般的な用語基準(PRO-CTCAE)のバージョン。 ジャマ-オンコル (2015) 1:1051–9. 土井:10.1001/2015.2639
PubMed Abstract|CrossRef Full Text|Google Scholar
17。 Xie J、Xu Z.新たに診断された乳癌を有する女性における肝Metastasesに関する集団ベースの研究。 がん疫学バイオマーカー Prev. (2019) 28:283–92. doi: 10.1158/1055–9965.EPI-18–0591
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dawood S, Broglio K, Ensor J, Hortobagyi GN, Giordano SH. Survival differences among women with de novo stage IV and relapsed breast cancer. Ann Oncol. (2010) 21:2169–74. doi: 10.1093/annonc/mdq220
PubMed Abstract | CrossRef Full Text
19. den Brok WD,Speers CH,Gondara L,Baxter E,Tyldesley SK,Lohrisch CA. 最初の提示に基づく転移性乳癌の生存、de novo対再発。 乳癌のResの御馳走。 (2017) 161:549–56. ドイ:10.1007/s10549–016-4080–9
PubMed Abstract|CrossRef Full Text/Google Scholar
20。 藤原R,Haag M,Schaeffeler E,Nies AT,Zanger UM,Schwab M.ビリルビン恒常性の全身調節:高ビリルビン血症の潜在的な利点. 肝臓学だ (2018) 67:1609–19. 土井:10.1002/hep.29599
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Liu X, Meng QH, Ye Y, Hildebrandt MAT, Gu J, Wu X. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer. Carcinogenesis. (2015) 36:243–8. doi: 10.1093/carcin/bgu247
PubMed Abstract | CrossRef Full Text | Google Scholar
23. ヴァンダーハイデンMG、カントリー LC、トンプソンCB。 ウォーバーグ効果の理解:細胞増殖の代謝要件。 科学だ (2009) 324:1029–33. 土井:10.1126/科学。1160809
PubMed Abstract|CrossRef Full Text/Google Scholar
24。 Mishra D、Banerjee D.腫瘍微小環境における腫瘍と間質との間の代謝リンクとしての乳酸デヒドロゲナーゼ。 がんだ (2019) 11:750. 土井:10.3390/cancers11060750
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Pelizzari G, Basile D, Zago S, Lisanti C, Bartoletti M, Bortot L, et al. Lactate dehydrogenase (ldh) response to first-line treatment predicts survival in metastatic breast cancer: first clues for a cost-effective and dynamic biomarker. Cancers. (2019) 11:1243. doi: 10.3390/cancers11091243
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Hopkins AM, Rowland A, McKinnon RA, Sorich MJ. Predictors of long-term disease control and survival for HER2-positive advanced breast cancer patients treated with pertuzumab, trastuzumab, and docetaxel. Front Oncol. (2019) 9:789. doi: 10.3389/fonc.2019.00789
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Pentheroudakis G,Fountzilas G,Bafaloukos D,Koutsoukou V,Pectasides D,Skarlos D,et al. 肝転移を伴う転移性乳癌:500人の女性の臨床病理学的、管理および転帰特性のレジストリ分析。 乳癌のResの御馳走。 (2006) 97:237–44. ドイ:10.1007/s10549–005-9117–4P>
PubMed Abstract|CrossRef Full Text|Google Scholar
Leave a Reply