薬理学におけるフロンティア
はじめに
リポソームは、薬物送達の目的で広く研究されているナノキャリアの一種である。 それらは、別個の水性空間を囲むリン脂質二重層から構成され、それによって親水性および疎水性化合物の両方の封入を可能にする(MetselaarおよびStorm、2005)。 リポソームは、治療用化合物を安定化させ、細胞および組織の取り込みに対する障壁を克服することができる(Ding et al., 2006; 華と呉、2013)。 これにより、それらは、疾患部位への化合物の標的化を改善し、その結果、非標的器官における蓄積を減少させることができる(Bakker−Woudenberg e t a l. 1994年Mastrobattista et al. ら、1 9 9 9;Hua,2 0 1 3;Hua e t a l. ら、2 0 1 5;Sercombe e t a l. ら、2 0 1 5;Zununi Vahed e t a l., 2017). その表面特性に基づいて、従来のリポソーム、ペグ化リポソーム、リガンド標的化リポソーム、およびtheranosticリポソームの四つの主要なタイプがあります(図1;Sercombe et al., 2015). り(Willis and Forssen,1 9 9 8;Bendas,2 0 0 1;Sawant and Torchilin,2 0 1 2)、一方、Peg化リポソームは、全身投与後の送達系の循環半減期を増強するために立体障害を与える(Torchilin,1 9 9 4;Wang e t a l.,1 9 9 8;Wang e t a l.,1 9 9 9;Wang e t a l.,1 9 9 9;Wang e t a l.,1 9 9 9;Wang e t a l.,1 9 9 9;Wang e t a l.,1 9 9 9;Wang e t a l.,1 9 9 9;Wang e t a l.,1 9 9 9;Wang e t a l.,, 2015). 様々な送達プラットフォームの組み合わせを組み込むリポソームは、投与経路および疾患の部位に応じて、カプセル化された化合物の送達をさらに改善す
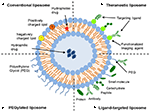
図1. 異なるタイプのリポソーム薬物送達系の概略図−(A)従来のリポソーム、(B)Peg化リポソーム、(C)リガンド標的化リポソーム、および(D)Theranosticリポソーム(Sercombe e t a l.,2 0 0 2)、(E t a l.,2 0 0 3)、(e t a l.,2 0 0 4)、(e t a l.,2 0 0 5)、(, 2015).
製造プロセスの後、リポソームは、薬物カプセル化、リガンド-共役、脂質組成、表面電荷、および形態学的特性(例えば、サイズ、形状、およびラメラの数)を含む, 2011). これらの特性は、in vitroおよびin vivoの両方でリポソームの挙動に大きな影響を及ぼし得るので重要である(Sawant and Torchilin,2 0 1 2;Sercombe e t a l., 2015). 細網内皮系(RES)を含む身体の防御によるリポソームの認識およびクリアランス、および単核食系によるその後の取り込みを伴うオプソニンの吸着は、リポ ら、1 9 9 8;Ishida e t a l., 2001). したがって、製造されたリポソームの物理化学的性質を決定することができることは、さらなる翻訳評価のための製剤を最適化するために重要である。
リポソームの物理化学的評価における主要な側面は、顕微鏡を用いてナノ粒子の形態を可視化することである。 リポソームおよび他のナノ粒子を撮像するために利用可能な多くの技術があり、光、電子、または原子間力顕微鏡に広く分類することができる(Bibi e t a l., 2011). 各技術には独自の利点と限界があり、ナノ粒子ベースの薬物送達システムに関する研究を評価する際に考慮すべきである(表1)。 このレビューは、リポソームの形態学的特性を評価するために使用される各イメージング技術を評価します。テーブル1

リポソーム形態を特徴付けるための現在のイメージング技術の概要。
光学顕微鏡
光学顕微鏡とは、可視光とレンズの配置を利用して視野を拡大する顕微鏡を指します(Murphy and Davidson、2012c)。 基本的な光学顕微鏡自体は、他の顕微鏡技術によって提供される詳細と比較して、脂質二重層に関する包括的な情報を提供することはできません。 しかし、基本的な実験装置を使用して小胞の画像を迅速に得るために使用することができる(Bibi et al., 2011). この技術は、リポソーム試料のサイズ、形状、均質性、および凝集の程度に関する一般的な情報を収集するときに特に有用であり得る(Nallamothu et al., 2006). 光学顕微鏡は、≧250nmの究極の分解能を有し(器具によって達成することができる最小の回折制限されたスポットサイズによって支配される)、そのよう, 2011). 一般に、光学顕微鏡は、直径が単一から数百マイクロメートルの範囲であり得る巨大な単層小胞(Guv)に関する重要な情報のみを提供することができる(Bagatolli、2009)。 蛍光プローブの組み込み、偏光技術、および高解像度共焦点顕微鏡の適用は、小胞の3D構造とラメラリティについてのより多くの情報を提供することができます(Bagatolli、2009)。
偏光顕微鏡
このタイプの光学顕微鏡は、偏光が秩序分子の分極可能な結合と相互作用する独特の能力を利用する(Murphy and Davidson、2012d)。 試料中の分子双極子が入射光波の偏光ベクトルと整列すると、光吸収が強化されます; その結果、サンプリング光線間の位相差が生じ、これは画像平面内の振幅に干渉依存的な変化を生じる(Murphy and Davidson、2012d)。 画像のコントラストは、干渉および回折の効果だけでなく、秩序化された分子配列の存在によるものでもある(Murphy and Davidson、2012d)。 これは、原形質膜の脂質二重層を含む多くの秩序化された細胞構造の形態および動態を研究するために使用することができる(Bibi e t a l. ら,2 0 1 1;MurphyおよびDavidson,2 0 1 2d)。 画像は、モノクロまたはカラーのいずれかで取得することができます。 この技術は、特に小胞の形成を確認するために、リポソームを可視化するための代替方法を提供する。 これは、小胞の二層特性または層状性に関する決定的な観察を提供しない(Bibi e t a l., 2011). さらに、分極の顕微鏡検査はまた最適の明快さを持っているマイクロメートルの範囲の大きい小胞が視覚化することができる小胞のサイズによって限 この技術は、ナノメートルの範囲内の粒子の鮮明な画像を提供しません。
蛍光顕微鏡
蛍光または”epifluorescence”顕微鏡は、特定の波長の光で励起された後に蛍光色素が光を放出する能力を利用する特殊な形態の光学顕微鏡である(Murphy and Davidson,2012b)。 この技術は、膜成分の構造および動態に関する本質的な情報を提供するために生物物理学において広く使用されている(Bouvrais e t a l., 2010). これらの研究では、蛍光プローブは、構造の可視化を可能にする、調査中の膜に特異的に組み込まれています。 様々な化学的およびフォトニック特性を有する広範囲の蛍光色素が市販されており、様々な研究課題に対応しています。 例えば、ある種の蛍光色素は、異なる配列および横方向の充填を示す特定の膜環境を好むことがある(Bouvrais e t a l., 2010). このように、蛍光顕微鏡は、膜構造自体についての情報を提供するために、サンプル内の複数のプローブを同時に適用する可能性を可能にする。 蛍光プローブは、リポソームの脂質二重層と同様に水性区画内に配置することができる(Bibi e t a l., 2011). この配置は、脂質小胞の形状、大きさおよび流動性に関する情報を得ることができるGuvを見るときに特に有用であり得る(Klymchenko e t a l. ら,2 0 0 9;Bouvraisら,2 0 0 9., 2010). ローダミン標識脂質などのプローブの脂質二重層への直接の取り込みは、リポソームの層状性の可視化も可能にする(Bibi et al., 2011).
蛍光顕微鏡の欠点は、膜系へのプローブおよび染料の添加が、リポソーム送達系の特性を潜在的に妨害する可能性があることである(Bouvrais et al. ら、2 0 1 0;Bibi e t a l. ら,2 0 1 1;MurphyおよびDavidson,2 0 1 2b)。 しかしながら、低色素濃度(≧1mol%)の使用は、膜の物理的特性への影響が最小限であることが示されている(Bouvrais e t a l., 2010). いくつかの色素が宿主膜に大きな変化を誘発し、および/または実験的人工物を引き起こし、不正確なデータ解釈をもたらす可能性があるため、蛍光色素の選択は重要なステップであることに注意することもまた重要である(Bouvrais e t a l.,2 0 0 2)。, 2010). さらに、光誘起脂質過酸化は、単純な色素系でもドメイン形成につながる可能性があります。 このプロセスは、大きないかだの形成および自発的なファセット形成をもたらすことができる(Bouvrais e t a l., 2010). 蛍光灯への長期暴露はまた蛍光性の強度のbleachingそして損失で起因できます。 したがって、蛍光色素の選択および新しい膜プローブの開発は、蛍光顕微鏡を使用する際に重要な考慮事項である(Klymchenko et al., 2009).
共焦点顕微鏡
共焦点走査顕微鏡は、蛍光顕微鏡の分野で進歩してきました。 サンプル全体を照らすのではなく、サンプル全体の1つ(または複数)の集束光線をスキャンすることによって画像が構築されます。 照射されたサンプルから戻ってくる光は、対象平面の上下から焦点外の光を拒否する開口部を通過します; 小さな被写界深度からの画像のみが得られることを確実にし、面外分解能を大幅に改善する(Bibi e t a l. ら,2 0 1 1;MurphyおよびDavidson,2 0 1 2a)。 この技術を使用して、画像の「zスタック」が収集され、小胞の上部から始まり、定義されたz増分で採取された画像が試料の下部に続き、試料の複合3D画 ら,2 0 1 1;MurphyおよびDavidson,2 0 1 2a)。 共焦点の走査顕微鏡検査は優秀な画像明瞭さによるepifluorescent光学顕微鏡上のより魅力的な技術になりました。 Guvの場合、この技術は、脂質系の内部構造を視覚化することが可能であり、他の顕微鏡法ではしばしば不可能である(Ruozi e t a l. ら,2 0 1 1;MertinsおよびDimova,2 0 1 3)。 例えば、水性および脂質二重層相の分離は、より大きな小胞において明確に視覚化することができる(MertinsおよびDimova、2 0 1 3)。 しかし、共焦点顕微鏡は依然として回折限界であり、したがって、Suvまたはオリゴラメラリポソームの高精細画像を生成することができない(Ruozi e t a l., 2011).
電子顕微鏡技術
電子顕微鏡は、非常に高い倍率(ヘンリー、2005)の下で小胞の可視化のための方法です。 これは、電子波長(したがって回折限界分解能)として脂質小胞の特性評価に広く使用されており、光学顕微鏡のそれよりも数桁低く、したがって、小リポ ら、2 0 1 1;Ruozi e t a l., 2011). この技術は、様々な電磁レンズによって試料の表面に集束された電子ビームを使用する。 次に、電子は試料によって散乱され、次いで、イメージングカラム内のさらなる一連の電磁レンズによって再焦点および拡大され、投影画像を生成する(Henry、2005)。 電子顕微鏡にはさまざまな種類があり、それぞれ異なる試料調製方法が必要です。
走査型電子顕微鏡(SEM)
走査型電子顕微鏡(Sem)は、物体の拡大画像を生成するために(試料を介するのではなく)試料を横切ってまたは越えて走査された電子ビームを利用する(Adler and Schiemann、1985)。 Alder et al. 1984年にリポソームを特徴付けるためにSEMを使用することが最初に試みられた(Adler and Schiemann,1985)。 彼らは、SEM用のリポソーム試料を調製するために凍結乾燥法を使用すると、目に見える塊および痂皮材料の大部分が生じることを示した(AdlerおよびSchiemann、1985)。 より最近の研究は、リポソーム構造自体が、この調製技術に必要な高真空条件および染色プロセスに起因して摂動を受け得ることを示している(Ruozi et al., 2011). SEMは、画像化の前に試料を乾燥または固定する必要があるため、リポソームの分析には現在一般的に使用されていない(Ruozi e t a l., 2011). しかし、SEMは、異なる脂質層の同心構造に関する一般的な情報を提供することができ、また、調製物のサイズおよび球状形態に関する詳細を提供するこ, 2009).透過型電子顕微鏡(TEM)透過型電子顕微鏡(TEM)は、ナノ粒子の構造を評価するために最も頻繁に使用されるイメージング方法である(Henry、2005;Kuntsche et al., 2011). これは、真空チャンバ内に配置された薄いサンプル(<厚さ100nm)の調製を含む。 電子ビームは、それがその後、画像を形成するために対物レンズによって集束されているサンプルを、交差させます。 TEMは、1nm以下のサイズまでの空間分解能で軟質物質試料を容易に撮像することができる(Henry,2 0 0 5;Kuntsche e t a l. ら、2 0 1 1;Ruozi e t a l., 2011). この技術は利用されるサンプル準備方法に基づいて更に分類することができます-特に、否定的な汚損、凍結ひびおよび低温学TEM。 それは他の顕微鏡検査の技術よりイメージのよりよい対照そして輪郭を提供するのでnanoparticlesの表面の修正で情報を提供できます。 例えば、DSPC/コレステロールリポソームの表面へのトランスフェリンの抱合は、非抱合リポソーム調製物には存在しなかった陰性染色TEMを有する粒子状表面, 2005). 別の実験では、ヒトトランスフェリンに対して産生された特異的抗体を陰性染色手順の前に添加して、粒子状表面被覆の同一性を確認した(Anabousi e t a l., 2005). したがって、temは、リポソームの表面へのリガンドの共役を評価するときにはるかに改善された分解能を達成する可能性を提供する。
陰性染色技術
陰性染色TEMでは、サンプル調製は、グリッド上に配置されている水和サンプルの少量を含みます。 小胞がグリッドと直接接触しているので、それらの配向および形態が影響を受ける可能性があり、したがってこれは考慮されるべきである(Bibi et al., 2011). また、リポソームを適切な電子密度の高い材料(例えば、電子密度の高い材料)に埋め込むことも必要である。 高コントラストを提供するので、小胞は暗い染色された背景に対して見ることができる(Ruozi et al., 2011). 陰性染色技術は比較的速く簡単であるが、元のリポソーム構造に変化を引き起こすことが示されており、ラメラ構造と誤解される可能性のある明暗のフリンジの作成につながる可能性があることが示されている(Bibi et al. ら、2 0 1 1;Ruozi e t a l., 2011). さらに、試料を真空下に置くことは、試料のさらなる脱水を引き起こし得、これは再び小胞の構造の変化を引き起こし得る(Bibi e t a l., 2011). ネガ染色TEM技術は、イメージングナノ粒子のためのはるかに高い倍率を提供することができますが、リポソーム構造への損傷は、正確にサンプルの形態学 したがって、結果を確認するためには、他の画像化技術が一般的に必要とされる。
凍結破壊技術
凍結破壊技術は、乾燥プロセスを必要とせず、ナノ粒子の内部構造に関する追加情報を提供することができる(Kuntsche et al., 2011). この方法は、2つの銅または金のホルダの間に挟まれたTEMグリッド上にサンプルを配置することを含む(Severs、2007)。 サンプルは弱い分子相互作用のサンプルの区域に沿って折られる前に液体プロパンか液体窒素との急速な凍結によって、普通ガラス化されます。 この破壊表面は、さらにエッチングされ、薄い白金または炭素層でシャドウされて、破壊試料平面の「負の」レプリカを提供することができる(Severs,2 0 0 7;Kuntsche e t a l., 2011). 次に、レプリカを有機溶媒で洗浄して、TEM顕微鏡下で可視化する前にすべての残留物を除去する。 これらのレプリカは非常に安定しているので、後で保存して見ることができます(Kuntsche et al., 2011). この技術の主な利点は、レプリカが試料の本来の状態を密接に反映し、小胞の3D構造および二層組織に関する詳細な情報を提供できることである(Bibi et al. ら、2 0 1 1;Kuntsche e t a l., 2011). この情報には、多層構造と多層小胞の二重層パッキングが含まれます。 この技術はまた、凝集サイズを評価することができ、カチオン性リポソームとDNAとの相互作用を調べるために特に有用であり得る(Bibi e t a l., 2011). しかしながら、不十分な凍結速度、溶媒分子の再沈着および/または機械的応力のために、製造中に試料中にアーチファクトが依然として生じ得る(Severs,2 0 0 7;Kuntsche e t a l., 2011). 例えば、「波打つ効果」は、試料中のSuv上で起こり得る(Bibi e t a l., 2011). これは、凍結前のアシル鎖の遷移における無秩序に起因する一般的な二重層変形である。 前転移温度と実際の転移温度との間でベシクルをインキュベートすることもまた、波紋を引き起こし得る(Bibi e t a l., 2011). 興味深いことに、これは、リポソーム調製物のために使用される脂質の様々な性質で生じる脂質相転移への情報を提供するために使用され得る(Bibi e t a l., 2011).低温Tem(cryo-TEM)は、液体エタン中でガラス化された薄い水性水和膜がイメージングの前に使用されるTEMのバリエーションです。
低温TEM
低温tem(cryo-TEM)は、 この技術は、リポソームの最も天然の状態での分析を可能にし、リポソームのサイズ、形状、内部構造、および層状性を決定するための貴重なツールである(Weisman et al. ら、2 0 0 4;Bibi e t a l. ら、2 0 1 1;Kuntsche e t a l., 2011). リポソーム試料を急速に凍結させることの主な利点は、氷結晶の形成を最小限に抑え、タンパク質または他の材料を保存することである(Bibi et al. ら、2 0 1 1;Kuntsche e t a l., 2011). これは、タンパク質またはDNAがナノ粒子内に封入されている場合に有益である(Weisman e t a l. ら、2 0 0 4;Kuntsche e t a l., 2011). Cryo-TEMは、化学的固定、脱水、切断および染色の問題を回避するため、リポソームを研究するために現在利用可能な最も有用な顕微鏡法であり、そのすべてが小胞の形態に影響を与える可能性がある(Bibi et al., 2011). 分解能範囲は、フィルムの厚さによって定義されるように、≦5〜5 0 0nmである(Almgren e t a l., 2000). しかし、この技術では、2D画像のみが3Dオブジェクトから取得されるという事実を含むいくつかの制限が注意されるべきである(これは一般に、他の顕微鏡法のほとんどにも適用される)。 この制限を克服するために、無作為に配向された非球状粒子の十分に大きな数の2D画像からの3D形状の再構成が可能である(Orlova e t a l. ら、1 9 9 9)、ならびに3D形状に関する情報を得るために異なる傾斜角度で試料を観察する(Van AntwerpenおよびGilkey、1 9 9 4)。 代わりに、低温電子断層撮影(cryo-ET)を使用して、3D画像を得ることもできる(Le Bihan et al., 2009). Cryo-TEMはまた、より低い線量の電子を利用するので、他の方法と比較して分解能が低いことが多いことを意味する(Bibi et al. ら、2 0 1 1;Kuntsche e t a l., 2011). 人工物は、非晶質氷の薄膜の形成および膜形成の間にせん断力を加える試料上のブロッティングの使用のために、依然として可能である(Almgren et al. ら,2 0 0 0;Bibi e t a l., 2011).
環境走査電子顕微鏡(ESEM)
環境走査電子顕微鏡(ESEM)は、小胞の固定、染色または凍結の使用を必要とせず、以前のサンプル調製なしで湿ったシステ ら、2 0 0 5;Ruozi e t a l., 2011). ESEMの主な特長は顕微鏡の部屋の水蒸気の存在である。 部分的にまたは完全に水和され得る試料の周囲の水含有雰囲気を維持する能力は、撮像チャンバを最大5 5hPaの圧力で維持することを可能にする多 ら、2 0 1 1;Ruozi e t a l., 2011). 一次電子ビームは、検出器に到達する前に信号のカスケード増幅につながる、蒸気分子に遭遇した二次電子を生成することができます。 このため、ESEMは試料調製を必要としない(Muscariello e t a l., 2005). この技術は、一連の圧力、温度およびガス組成を通して試料環境の変化を可能にする(Mohammed e t a l. これは、環境変化が小胞にどのように影響するかを決定する際に有用である。 これは、ナノ医薬品の処方および安定性の研究に適用可能である(Bibi e t a l., 2011). ESEMはまた、リポソームの二層への薬物負荷を分析するためにも使用されている(Mohammed e t a l. ら、2 0 0 4)、ならびに小胞のサイズおよび形状を決定することを含む。 ESEMの制限は、ナノスケール構造のラメラリティおよび内部構造に関する詳細な情報を提供できないことである(Ruozi e t a l., 2011).原子間力顕微鏡(AFM)、また、走査力顕微鏡(SFM)として知られている原子間力顕微鏡(AFM)は、走査型プローブ顕微鏡技術の一種です。
原子間力顕微鏡(AFM)は、 それはサンプルの表面上の片持梁そしてセンサーに付す鋭い先端を動かし、調査とサンプル間の表面力を測定することによって働く(Sitterberg et al., 2010). 片持梁がサンプル表面に沿って動くと同時に、表面の特徴が上下に原因で動き、片持梁はそれに応じて逸れます。 この偏向は、通常、光学センサを使用して定量化され、レーザビームは、カンチレバーの背面で光検出器上に反射される(Sitterberg e t a l., 2010). AFMは真空中で動作する必要がなく、周囲の空気中または液体下で動作することができるため、ナノ粒子と同様に生物学的サンプルの画像化に使用されている(Liang et al. ら,2 0 0 4a,b;Ruoziら,2 0 0 4a,b;Ruoziら,, 2005, 2009). AFMはナノメートルの画分のオーダーで顕著な決断を有し、形態、サイズ分布、同質性および安定性の細部と共にリポソームの3Dイメージを提供できる(Liang et al. ら,2 0 0 4a,b;Ruoziら,2 0 0 4a,b;Ruoziら,, 2005, 2007, 2009). 重要なことに、AFMは、リポソームの表面修飾を特徴づけ、リポソーム膜表面で結合したリガンド(例えば、抗体およびポリマー)を検出するために使用され得る(Bendas e t a l. ら、1 9 9 9;Moutardier e t a l. ら,2 0 0 3;Anabousi e t a l. ら、2 0 0 5;Liang e t a l., 2005). 例えば、Bendas e t a l. AFMを使用してリポソーム膜境界を拡大し、リポソーム表面へのIgG抗体の結合を表す直径約8〜10nmの三量体構造を画像化することができた(Bendas et al., 1999). その結果,この技術の有効性は,PEG鎖に結合した抗体と比較して,リポソーム表面に直接結合した抗体がAFM(制限されたタンパク質移動度)で見えるコンジュゲーション法に大きく依存していることが分かった。 PEG鎖が高いタンパク質移動度を引き起こし、したがって、走査することができなかったことが示唆された(Bendas e t a l., 1999). 逆に、Anabousiらは、リポソームへのPeg化脂質の取り込みが、球状の形状を維持するリポソームによる立体安定化を誘導することを示した(Anabousi e t a l., 2005). 非結合リポソームの表面のAFM像は滑らかであり、構造は観察できなかったが、ペグ化リポソームの表面へのトランスフェリンの共役は小さな球状構造として可視化された(Anabousi et al., 2005). 同様に、moutardierらは、脂質小胞のコアを形成する高分子粒子に装填された薬物からなる高分子コア(LSP)を有するリポソームを製造した(Moutardier e t a l., 2003). AFMを用いて撮影された画像は、外部表面に高分子ネットワークの存在を示し、これは、コラーゲンポリマーコアが放射され、LSP上に表面層を形成することを示唆, 2003). 表面構造の詳細に加えて、AFMは、力測定を通じて試料表面の機械的および化学的特性に関する情報を提供することができる(Ruozi et al., 2007). 例えば、Mao e t a l. リポソームの弾性および接着特性を評価するためにこの技術を使用した(Mao e t a l., 2004). A FMの1つの制限は、雲母またはシリコンウエハのような支持体表面上にナノ粒子を吸着させる必要性である。 固体基質へのリポソームの吸着は、小胞のサイズおよび形状を変更し、それらの平坦化を引き起こす可能性を有する。 (Ruozi e t a l., 2007). さらに、プロービングチップの周期的な接触は、リポソームが試料中の小胞を横切って移動するときにリポソームを引きずることができる(Jass et al., 2000). それにもかかわらず、AFMはまだリポソームの評価に有用なツールです。
結論
リポソームの形態を評価するために利用可能なイメージング技術の広い範囲があり、それぞれが独自の長所と短所を有する。 光学顕微鏡は比較的速い方法のより大きい小胞のサイズそして形およびサンプルの同質性に関する一般的な細部を提供できます。 逆に、temはリポソームの形態をはるかに詳細に調べるために最も一般的に使用される技術です; しかし、結果を解釈する際には、染色および/または真空条件への曝露による各TEMサブタイプの構造変化の可能性を考慮する必要がある。 ESEMは、環境に応じてリポソームの変化を決定するときに最も有用であるが、AFMはナノ粒子の形態素解析に有用な方法として浮上しており、リポソーム表面の最大分解能を提供している。 AFMとTEMの両方がリポソームの表面に共役リガンドをイメージングすることが可能であり、表面修飾に関する相補的な情報を提供する。 全体として、技術の選択は、どの形態学的特性および詳細度が必要であるかに依存する。 さらに、各イメージング技術のサンプル調製方法の潜在的な効果を理解することは、選択プロセスにおいて重要である。
著者の貢献
原稿の起草:A-LRとSH。 重要な知的コンテンツのために批判的に記事を改訂:SH、PD、JF、WP、AM、DSとAW。
利益相反に関する声明
著者らは、この研究は、利益相反の可能性と解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言している。
謝辞
著者は、ニューサウスウェールズ州の薬局研究信託、レベッカL.クーパー医学研究財団、グラディスM.ブラウンフェローシップ、ausEE研究財団、ニューカッスル大学
Adler、K.、およびSchiemann、J.(1985)。 走査型電子顕微鏡および凍結破壊法によるリポソームの特性評価。 マイクロン-マイクロスコープ アクタ16,109-113. 土井: 10.1016/0739-6260(85)90039-5
CrossRef全文|Google Scholar
Almgren,M.,Edwards,K.,And Karlsson,G.(2000). リポソームおよび関連構造のクライオ透過型電子顕微鏡。 コロイドサーフ 物理学者。 Eng. Asp. 174, 3–21. doi:10.1016/S0927-7757(00)00516-1
CrossRef全文/Google Scholar
Anabousi,S.,Laue,M.,Lehr,C.M.,Bakowsky,U. およびEhrhardt,C.(2 0 0 5)。 原子間力顕微鏡および透過型電子顕微鏡によるリポソームのトランスフェリン修飾の評価。 ユーロ J.ファーム バイオファーム 60, 295–303. doi:10.1016/j.ejpb.2004.12.009
PubMed Abstract|CrossRef Full Text|Google Scholar
Bagatolli,L.A.(2009). 膜および蛍光顕微鏡検査。 2007年にavデビュー。 ニューヨーク、ニューヨーク:スプリンガー、33-51。 doi:10.1007/978-0-387-88722-7_2
CrossRef全文|Google Scholar
Bakker-Woudenberg,I.A.,Storm,G. およびWoodle,M.C.(1994)。 感染症の治療におけるリポソーム。 J.薬物標的。 2, 363–371. doi:10.3109/10611869408996811
Pubmed Abstract|CrossRef Full Text|Google Scholar
Bendas,G.(2001). イムノリポソーム:がん治療を標的とする有望なアプローチ。 15,215-224 doi:10.2165/00063030-200115040-00002
CrossRef全文|Google Scholar
Bendas,G.,Krause,A.,Bakowsky,U.,Vogel,J.,And Rote,U.(1999). 新しい抗体抱合技術によって調製された新規イムノリポソームの標的化能。 Int. J.ファーム 181, 79–93. doi:10.1016/S0378-5173(99)00002-2
PubMed Abstract|CrossRef Full Text|Google Scholar
Bibi,S.,Kaur,R.,Henriksen-Lacey,M.,McNeil,S.E.,Wilkhu,J.,Lattmann,E.、ら。 (2011). リポソームの顕微鏡イメージング:カバースリップから環境SEMへ。 Int. J.ファーム 417, 138–150. 土井:10.1016/j.ijpharm.2010.12.021
PubMed Abstract|CrossRef Full Text|Google Scholar
Bouvrais,H.,Pott,T.,Bagatolli,L.A.,Ipsen,J.H.,And Meleard,P.(2010). 脂質二重層の機械的性質に及ぼす膜アンカー蛍光プローブの影響。 バイオヒム バイオフィス・バイフィス・バイフィス アクタ1798,1333-1337. 土井:10.1016/j.bbamem.2010.03.026
Pubmed Abstract|CrossRef Full Text|Google Scholar
Cullis,P.R.,Chonn,A.,And Semple,S.C.(1998). リポソームと脂質ベースのキャリア系と血液タンパク質との相互作用: 生体内でのクリアランス挙動との関係。 Adv.Drug Deliv. 昭和32年3月17日 doi:10.1016/S0169-409X(97)00128-2
Pubmed Abstract|CrossRef Full Text|Google Scholar
Ding,B.S.,Dziubla,T.,Shuvaev,V.V.,Muro,S.,And Muzykantov,V.R.(2006年)。 血管内皮を標的とする高度な薬物送達システム。 モル インターヴ 6, 98–112. 土井:10.1124/mi。6.2.7
PubMed Abstract|CrossRef Full Text/Google Scholar
Henry,C.R.(2005). サポートされているナノ粒子の形態。 プログ サーフィン サイ… 80, 92–116. 土井:10.1016/j.progsurf.2005.09.004
CrossRef全文|Google Scholar
華、S.(2013)。 炎症部位を標的とする:新規炎症治療の標的としての細胞間接着分子-1。 フロント ファーマコール… 4:127. ドイ:10.3389/fphar.2013.00127
PubMed Abstract|CrossRef Full Text|Google Scholar
Hua,S.,Marks,E.,Schneider,J.J.,Keely,S.(2015). 炎症性腸疾患における結腸標的薬物送達のための経口ナノ送達システムの進歩: 健康なティッシュ対病気にかかったへの選択的な目標とすること。 1117年-1132年。 土井:10.1016/j.nano.2015.02.018
PubMed Abstract|CrossRef Full Text|Google Scholar
Hua,S.,Wu,S.Y.(2013). 目標とされた苦痛療法のための脂質ベースのnanocarriersの使用。 フロント ファーマコール… 4:143. ドイ:10.3389/fphar.2013.00143
PubMed Abstract|CrossRef Full Text|Google Scholar
Ishida,T.,Harashima,H.,Kiwada,H.(2001). リポソームとin vitroおよびin vivoでの細胞との相互作用: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L. ら、duportail,G.,et a l. (2009). 3-ヒドロキシフラボンに基づく環境感受性膜プローブを用いた巨大な単層小胞における脂質ドメインの可視化。 バイオヒム バイオフィス・バイフィス・バイフィス アクタ1788,495-499. 土井:10.1016/j.bbamem.2008.10.019
Pubmed Abstract|CrossRef Full Text|Google Scholar
Kuntsche,J.,Horst,J.C.,And Bunjes,H.(2011). コロイド薬物送達システムの形態を研究するための極低温透過型電子顕微鏡(cryo-TEM)。 Int. J.ファーム 417, 120–137. 土井:10.1016/j.ijpharm.2011.02.001
PubMed Abstract|CrossRef Full Text|Google Scholar
Le Bihan,O.,Bonnafous,P.,Marak,L.,Bickel,T.,Trepout,S.,Mornet,S.,et al. (2009). リポソームへのナノ粒子の移動のクライオ電子断層撮影。 J.Struct. バイオル 168, 419–425. 土井:10.1016/j.jsb.2009.07.006
Pubmed Abstract|CrossRef Full Text|Google Scholar
Liang,X.,Mao,G.,Ng,K.Y.(2004a). 原子間力顕微鏡による雲母上のコレステロール含有リポソームの機械的性質と安定性の測定。 J.コロイド界面Sci. 278, 53–62.
PubMed Abstract/Google Scholar
Liang,X.,Mao,G.,Ng,K.Y.(2005). PEO-PPO-PEOの鎖長が小一ラメラリポソームの形態と安定性に及ぼす影響:AFM調査。 J.コロイド界面Sci. 285, 360–372. 土井:10.1016/j.jcis.2004.11.042
Pubmed Abstract|CrossRef Full Text|Google Scholar
Liang,X.,Mao,G.,Simon Ng,K.Y.(2004b). 原子間力顕微鏡による雲母表面上の小さな単層卵子小胞のプロービング。 コロイドサーフ Bバイオインターフェイス34、41-51。
PubMed Abstract/Google Scholar
Mao,G.,Liang,X.,And Ng,K.Y.S.(2004). ナノ科学とナノテクノロジーの百科事典。 ニューヨーク、ニューヨーク:マルセルDekker。
Google Scholar
Mastrobattista、E.、Koning、G.A.、およびStorm、G.(1999)。 抗腫瘍薬の標的送達のためのImmunoliposomes。 Adv.Drug Deliv. 40巻103-127頁。 doi:10.1016/S0169-409X(99)00043-5
CrossRef全文|Google Scholar
Mertins,O. およびDimova,R.(2013)。 キトサンとリン脂質小胞との相互作用に関する洞察。 パートII:膜の補強および気孔の形成。 Langmuir29,14552-14559. doi:10.1021/la4032199
Pubmed Abstract|CrossRef Full Text/Google Scholar
Metselaar,J.M.,And Storm,G.(2005). 炎症性疾患の治療におけるリポソーム。 専門家のオピン。 ドラッグデリブ… 2, 465–476. doi:10.1517/17425247.2.3.465
PubMed Abstract|CrossRef Full Text/Google Scholar
Mohammed,A.R.,Weston,N. とができるようになることを期待しています。 難水溶性薬物のリポソーム製剤:薬物負荷の最適化と安定性のESEM分析。 Int. J.ファーム 285, 23–34. 土井:10.1016/j.ijpharm.2004.07.010
Pubmed Abstract|CrossRef Full Text|Google Scholar
Moutardier,V.,Tosini,F.,Vlieghe,P.,Cara,L.,Delpero,J.R.,And Clerc,T.(2003). 経口投与モデルにおけるコロイド型抗癌剤の生物学的利用能。 Int. J.ファーム 260, 23–38. 土井:10.1016/S0378-5173(03)00231-X
PubMed Abstract|CrossRef Full Text|Google Scholar
Murphy,D.B.,And Davidson,M.W.(2012a). 共焦点レーザー走査顕微鏡。 光学顕微鏡および電子イメージングの基礎、第2Edn。 Hoboken,NJ:John Wiley&Sons,265-305. doi:10.1002/9781118382905.ch13
CrossRef全文|Google Scholar
Murphy,D.B.,And Davidson,M.W.(2012b). 蛍光顕微鏡。 光学顕微鏡と電子イメージングの基礎。 ヴァインハイム: ジョン*ワイリー&息子、199-231。 doi:10.1002/9781118382905.ch11
CrossRef全文|Google Scholar
Murphy,D.B.,And Davidson,M.W.(2012c). 光学顕微鏡と電子イメージングの基礎。 Hoboken,NJ:John Wiley&Sons,1-19. doi:10.1002/9781118382905
CrossRef全文|Google Scholar
Murphy,D.B.,And Davidson,M.W.(2012d). 偏光顕微鏡。 光学顕微鏡と電子イメージングの基礎。 ホーボーケン: ジョン*ワイリー&息子、153-171。 doi:10.1002/9781118382905.ch9
CrossRef全文|Google Scholar
Muscariello,L.,Rosso,F.,Marino,G.,Giordano,A.,Barbarisi,M.,Cafiero,g.,et al. (2005). 生物学分野のESEMの適用の重大な概観。 J.セル。 フィジオール 205, 328–334. doi:10.1002/jcp。20444
PubMed Abstract|CrossRef Full Text|Google Scholar
Nallamothu,R.,Wood,G.C.,Pattillo,C.B.,Scott,R.C.,Kiani,M.F.,Moore,B.M.,et al. (2006). コンブレタスタチンA4のための腫瘍血管系標的リポソーム送達システム:デザイン、キャラクタリゼーション、およびin vitro評価。 AAPS PharmSciTech7:E32. doi:10.1208/pt070232
Pubmed Abstract|CrossRef Full Text/Google Scholar
Nirale,N.M.,Vidhate,R.D.,And Nagarsenker,M.S.(2009). 肺配達のためのFluticasoneのプロピオン酸塩のリポソーム。 インドのJ.Pharm。 サイ… 71, 709–711.
Google Scholar
Orlova、E.V.、Sherman、M.B.、Chiu、W.、Mowri、H.、Smith、L.C.、およびGotto、A.M.Jr.(1999)。 Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G. とができることを明らかにした。 原子間力顕微鏡と光子相関分光法:リポソームの迅速な特性評価のための二つの技術。 ユーロ J.ファーム サイ… 25, 81–89. 土井:10.1016/j.ejps.2005.01.020
PubMed Abstract|CrossRef Full Text/Google Scholar
Ruozi,B.,Tosi,G.,Leo,E.,And Vandelli,M.A.(2007). 薬物および遺伝子キャリアとしてリポソームを特徴付けるための原子間力顕微鏡の適用。 タランタ73年12月22日 土井:10.1016/j.talanta.2007.03.031
PubMed Abstract|CrossRef Full Text/Google Scholar
Ruozi,B.,Tosi,G.,Tonelli,M.,Bondioli,L.,Mucci,A.,Forni,F.,et al. (2009). ソフト水和されたサンプルのAFM段階イメージ投射:リポソームの化学物理的な調査を完了する多目的な用具。 J.リポソームRes.19,59-67. doi:10.1080/08982100802584071
PubMed Abstract|CrossRef Full Text|Google Scholar
Sawant,R.R.,And Torchilin,V.P.(2012). 標的型リポソーム治療薬の開発における課題。 AAPS J.14,303-315. 土井:10.1208/s12248-012-9330-0PubMed Abstract/CrossRef Full Text/Google Scholar
Senior,J.H.(1987). In vivoでのリポソームの運命と行動:制御因子のレビュー。 クリティカル・クリティカル・ サー牧師 薬物キャリアSyst。 3, 123–193.
PubMed Abstract/Google Scholar
Sercombe,L.,Veerati,T.,Moheimani,F.,Wu,S.Y.,Sood,A.K.,And Hua,S.(2015). リポソームの進歩と課題は、薬物送達を支援しました。 フロント ファーマコール… 6:286. ドイ:10.3389/fphar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
PubMed Abstract|CrossRef Full Text/Google Scholar
Torchilin,V.P.(1994). ImmunoliposomesおよびPEGylated immunoliposomes:イメージ投射代理店の目標とされた配達のための可能な使用。 4,244-258 ドイ:10.1006/immu.1994.1027
PubMed Abstract|CrossRef Full Text/Google Scholar
Van Antwerpen,R.,And Gilkey,J.C.(1994). クライオ電子顕微鏡は、人間の低密度リポタンパク質の下部構造を明らかにする。 J.脂質Res.35,2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
PubMed Abstract|CrossRef Full Text/Google Scholar
Willis,M.,And Forssen,E.(1998). リガンド標的型リポソーム。 Adv.Drug Deliv. 29,249-271. doi:10.1016/S0169-409X(97)00083-5
CrossRef全文/Google Scholar
Zununi Vahed,S.,Salehi,R.,Davaran,S.,Sharifi,S.(2017). がん細胞におけるリポソームベースの薬物共送達システム。 マーター サイ… Eng. Cマター バイオル Appl. 71, 1327–1341. doi:10.1016/j.msec。2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply