7.2:キモトリプシン
はじめに
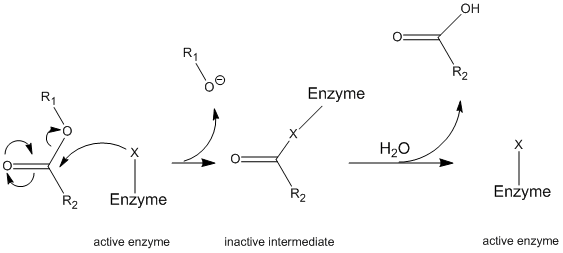
キモトリプシンは、その二相速度論のために最も研究されている酵素の一つである:前定常状態と定常状態。 これら二つの速度論的状態の研究は、”ピンポン”機構、共有結合加水分解反応につながる共有結合錯体の形成、および触媒反応の速度の証拠を与える。 キモトリプシンの合成は、主に膵臓で起こる。 しかし活動的な形態の代りにそれはchymotrypsinogenと呼出される不活性zymogenとしてプロテアーゼの活動が膵臓を消化することを防ぐために作り出されます。 小腸の内腔への分泌時に、それはトリプシンと呼ばれる別の酵素によってその活性形態に変換される。 プロテアーゼの活性化のための異なる酵素のこの依存性は、身体が器官の消化および他の有害な酵素の副作用を防ぐための一般的な方法である。キモトリプシンは、酵素が基質と反応して酵素中間体を形成するピンポン機構として知られる一般的な機構を介して作用する(図\(\PageIndex{1}\))。 この中間体は初期酵素とは異なる特性を有するので、初期酵素活性を再生するためには、二次基質と反応しなければならない。 このプロセスを以下に示します。
より具体的には、キモトリプシンは共有結合加水分解と呼ばれる特定のタイプのピンポン機構を介して動作 これは、酵素が最初に標的基質と共有結合を形成し、より安定な部分を溶液中に置換することを意味する。 この酵素-基質複合体は酵素中間体と呼ばれる。 次いで、中間体は水と反応し、これは最初の基質の残りの部分を置換し、最初の酵素を改革する。
キモトリプシンは、ほとんどの酵素と同様に、それが反応する基質の種類に特異的である。 プロテアーゼとして、それはポリペプチドを切断し、その固有の特異性は、それが芳香族残基のカルボキシ末端にのみ作用することを可能にする。 これはやや複雑なメカニズムであり、一連のステップで最もよく説明されています。
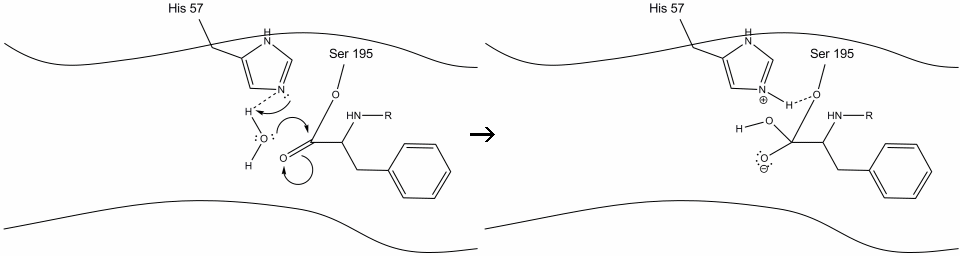
1. 標的はキモトリプシンの活性部位に入り、酵素残基の露出した非極性基と基質の非極性芳香族側鎖との間の疎水性相互作用によってそこに保持される。 ヒスチジン-57上のシッフ窒素とセリン-195の酸素側鎖との間の水素結合に注意することが重要である。
2. ヒスチジン-セリン水素結合によって助けられて、セリン-195上のヒドロキシル基は、同時にヒスチジンシッフ窒素にヒドロキシル水素を転送しながら、芳香族アミノ酸のカルボニル炭素に求核攻撃を行います。 この攻撃はπカルボニル電子をカルボニル酸素に押し込み、四つの単結合を持つc末端炭素からなる短命の中間体を形成する。: 酸素アニオン、芳香族アミノ酸のベータカーボン、基質蛋白質のそれに続くアミノ酸のn末端、およびセリン195側鎖の酸素。
.gif?revision=1&size=bestfit&width=720&height=192)
3. この中間体は、オキシアニオン電子が芳香族アミノ酸のc末端とのpi結合を再形成するため、短命である。 芳香族アミノ酸のカルボキシ末端とその後の残基のn末端との間の結合が切断され、その電子がヒスチジン-57上のプロトン化シッフ窒素の水素を抽出するために使用される。 カルボニル炭素とセリン-195酸素との間の結合はエステル配置のままである。 これはアシル酵素中間体と呼ばれる。 ポリペプチドのc末端側は、酵素の活性部位から自由に解離する。/p>
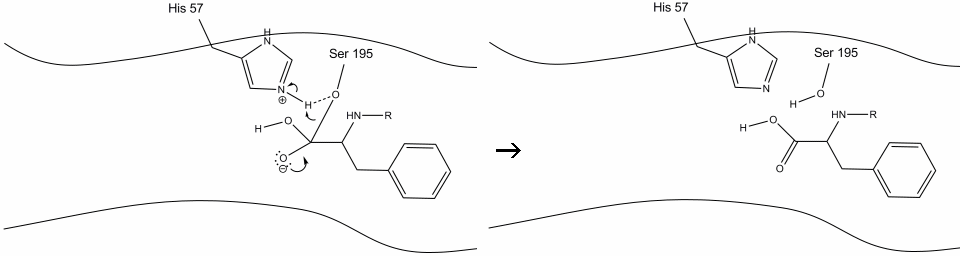
4. 水分子は現在、水の水素原子とヒスチジン-57シッフ窒素との間の水素結合を介して活性部位に入り結合することができる。
5. 水の酸素はアシル酵素中間体のカルボニル炭素に求核攻撃を行い、ヒスチジン-57が水からプロトンを一つ抽出するときにカルボニルのπ電子をカルボニル炭素に押し付ける。 これは、セリン、ヒドロキシル、オキシアニオン、および芳香族アミノ酸と共有結合した別の第四級炭素を形成する。 最近プロトン化されたヒスチジン-57上のプロトンは、セリン酸素と水素結合を作ることができるようになった。
6. オキシアニオン電子はカルボニルπ結合を再形成し、カルボニル炭素とセリンヒドロキシルの間の結合を切断する。 この結合の電子は、ヒスチジンシッフ窒素を脱プロトン化し、元の酵素を改革するためにセリン酸素によって使用される。 基質はもはや活性部位に対する親和性を有さず、そしてそれはすぐに複合体から解離する。
Leave a Reply