8.5:受容体チロシンキナーゼ(RTKs)
受容体チロシンキナーゼは、インスリンのようなペプチドホルモンや表皮成長因子のような成長因子を含む多数のシグナルに対する応答を仲介する。 Gpcrと同様に、受容体チロシンキナーゼはシグナルに結合し、次に一連の細胞内分子を介してメッセージを伝達し、最後の分子は標的タンパク質に作用して細胞の状態を変化させる。P>
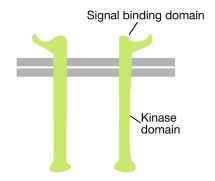
名前が示すように、受容体チロシンキナーゼは、チロシンキナーゼ活性も有する細胞表面受容体である。 受容体チロシンキナーゼのシグナル結合ドメインは細胞表面にあり、チロシンキナーゼの酵素活性はタンパク質の細胞質部分に存在する(上の図を参照)。 膜貫通αヘリックスは、受容体のこれら二つの領域を接続します。
シグナル分子が受容体チロシンキナーゼに結合するとどうなりますか?
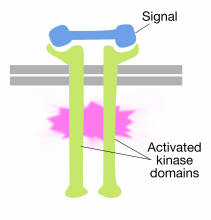
受容体チロシンキナーゼ分子の細胞外ドメインへのシグナル分子の結合は、二つの受容体分子を引き起こす。二量体化(一緒に来て、アソシエイト)。 これにより、受容体の細胞質尾部が互いに接近し、これらの尾部のチロシンキナーゼ活性がオンになる。 活性化された尾は、その後、いくつかのチロシン残基上で互いにリン酸化する。 これは自己リン酸化と呼ばれます。
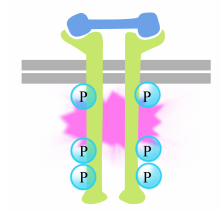
受容体テール上のチロシンのリン酸化は、テール上の細胞内シグナリング複合体のアセンブリをトリガします。 新たにリン酸化されたチロシンは、その後、まだ他のタンパク質にメッセージを渡すタンパク質をシグナリングするための結合部位として機能します。 その後、受容体チロシンキナーゼ上のシグナル伝達複合体によって活性化される重要なタンパク質は、Rasと呼ばれる。
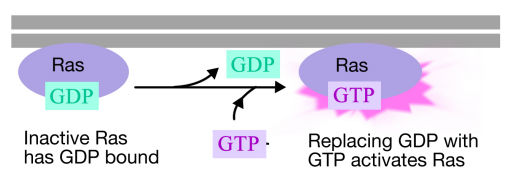
Rasタンパク質は、原形質膜の細胞質面に関連する単量体グアニンヌクレオチド結合タンパク質である(実際には、三量体Gタンパク質のアルファ Gタンパク質のαサブユニットと同様に、RASはGTPが結合しているときに活性であり、GDPが結合しているときに不活性である。また、αサブユニットと同様に、RasはGTPをGDPに加水分解することができる。
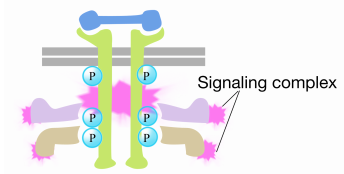
シグナルが受容体チロシンキナーゼに到着すると、受容体モノマーが一緒に来て、お互いのチロシンをリン酸化し、受容体の細胞質尾部 この複合体中のタンパク質の一つは、Rasと相互作用し、GTPのための不活性Rasに結合したGDPの交換を刺激する。 これによりRasが活性化されます。
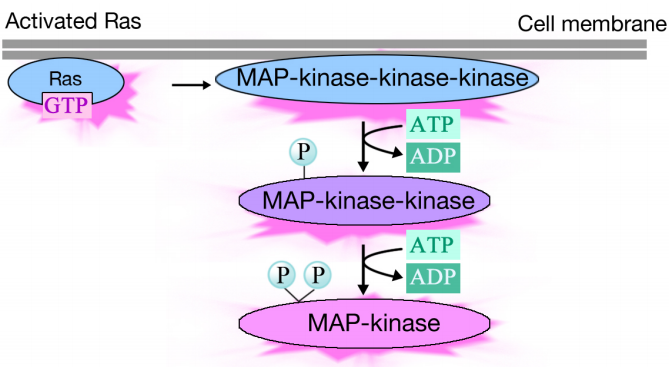
活性化されたRasは、シグナルを中継および分配する三つのプロテインキナーゼのリン酸化カスケード これらのプロテインキナーゼは、MAPキナーゼ(Mitogen Activated Protein Kinase)と呼ばれるグループのメンバーである。 このカスケードの最後のキナーゼは、遺伝子発現を調節する酵素および転写活性化剤を含む様々な標的タンパク質をリン酸化する。
様々な酵素のリン酸化は、それらの活性を変化させ、細胞内の新しい化学反応を引き起こす可能性があり、転写活性化剤のリン酸化は、発現される遺伝子を変化させる可能性がある。 遺伝子発現およびタンパク質活性の変化の複合効果は、細胞の生理学的状態を変化させる。
もう一度、RTKsによって媒介されるシグナル伝達の経路に従うことで、同じ基本的なイベントパターンを識別することが可能です: シグナルは受容体チロシンキナーゼの細胞外ドメインによって結合され、受容体二量体化と細胞質尾部の自己リン酸化をもたらし、細胞の内部にメッセージを伝える。
メッセージはシグナル伝達複合体を介してRasに渡され、その後一連のキナーゼを刺激する。 カスケード中の末端キナーゼは標的蛋白質に作用し,蛋白質活性と遺伝子発現の変化をもたらす。P>
上記の説明は、受容体の主要なクラスのいくつかの非常に簡単なスケッチを提供し、受容体の様々なタイプによっ 主要な持ち帰りレッスンは、異なる経路の本質的な類似性です。
心に留めておくべきもう一つのポイントは、我々は孤立して、個々の経路を見てきましたが、細胞は、任意の時点で一度に異なる応答の様々なオフに設定 上記の経路は、かなりの程度の「クロストーク」を示し、任意の所与の信号に対する応答は、細胞が同時に受信する他の信号によって影響される。 多数の異なる受容体、信号およびそれらの組み合わせは、細胞が膨大な多様な異なる状況に応答することができる手段である。
貢献者
-
Kevin Ahern博士とIndira Rajagopal博士(オレゴン州立大学)
Leave a Reply