Halobetasolのプロピオン酸塩の軟膏
適量形態:軟膏
医学的に見直されるDrugs.com最終更新日は2020年3月1日です。
- 概要
- 副作用
- 投与量
- プロフェッショナル
- 相互作用
- 詳細
ハロベタゾールプロピオン酸軟膏の説明
ハロベタゾールプロピオン酸軟膏、0.05%はハロベタゾールプロピオン酸塩、局所皮膚科学的使用のための合成コルチコステロイドを含む。 コルチコステロイドは炎症抑制および止痒性の代理店として原則的に使用される主に総合的なステロイドのクラスを構成します。
化学的にハロベタゾールプロピオン酸は、21-クロロ-6α、9-ジフルオロ-11β、17-ジヒドロキシ-16β-メチルプレグナ-1、4-ジエンである。-3-20-ジオン、17プロピオン酸塩、C25H31Clf2O5。 それは次の構造式を持っています:
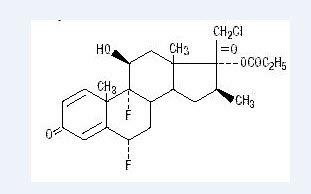
ハロベタゾールプロピオン酸塩は485の分子量を持っています。 それは水に不溶性の白色結晶性粉末である。
ハロベタゾールプロピオン酸軟膏の各グラムには0が含まれています。ステアリン酸アルミニウム、蜜蝋、pentaerythritolのcocoate、ワセリン、プロピレングリコール、sesquioleate sorbitanおよびステアリン酸塩の基盤のハロベタソールのプロピオン酸塩の5mg/g。
ハロベタソールプロピオン酸軟膏-臨床薬理学
他の局所コルチコステロイドと同様に、ハロベタソールプロピオン酸は、抗炎症、鎮痒および血管収縮作用 局所コルチコステロイドの抗炎症活性のメカニズムは、一般に、不明である。 しかし、コルチコステロイドは、リポコルチンと総称されるホスホリパーゼA2阻害タンパク質の誘導によって作用すると考えられている。 これらの蛋白質は共通の前駆物質のアラキドン酸の解放の禁止によってプロスタグランジンおよびleukotrienesのような発火の有効な仲介者の生合成を制御す アラキドン酸は、ホスホリパーゼA2によって膜リン脂質から放出される。
薬物動態
局所コルチコステロイドの経皮吸収の程度は、ビヒクルおよび表皮障壁の完全性を含む多くの要因によって決定される。 24時間までのヒドロコルチゾンによる閉塞包帯は、浸透を増加させることが実証されていない;しかし、96時間のヒドロコルチゾンの閉塞は著しく浸透 項目副腎皮質ホルモンは正常でそのままな皮から吸収することができます。 皮膚における炎症および/または他の疾患プロセスは、経皮吸収を増加させる可能性がある。
ヒトおよび動物実験では、ハロベタゾールプロピオン酸塩の適用用量の6%未満が、ハロベタゾールプロピオン酸塩軟膏の局所投与後96時間以内に循環
ハロベタゾールプロピオン酸軟膏を用いて行われた研究は、他の局所コルチコステロイドと比較して効力の超高範囲にあることを示している。
Halobetasolのプロピオン酸塩の軟膏のための徴候そして使用法
Halobetasolのプロピオン酸塩の軟膏は副腎皮質ホルモン敏感な皮膚病の炎症性およ 2週連続を超える治療は推奨されておらず、視床下部-下垂体-副腎(HPA)軸を抑制する可能性があるため、総投与量は50g/週を超えてはならない。 12歳未満の小児での使用はお勧めしません。
他の高活性コルチコステロイドと同様に、治療は制御が達成されたときに中止する必要があります。 2週間以内に改善が見られない場合は、診断の再評価が必要な場合があります。
禁忌
ハロベタゾールプロピオン酸軟膏は、製剤のいずれかの成分に対する過敏症の病歴を有する患者には禁忌である。
注意事項
一般
局所コルチコステロイドの全身吸収は、治療の撤退後にグルココルチコステロイド不全の可能性を有する可逆的な視床下部-下垂体-副腎(HPA)軸抑制を生じる可能性がある。 Cushingのシンドローム、hyperglycemiaおよびglucosuriaの明示はまた項目副腎皮質ホルモンの全身の吸収によって何人かの患者で間、処置で作り出すことができます。
大きな表面積または閉塞下の領域に局所ステロイドを適用している患者は、HPA軸抑制の証拠について定期的に評価されるべきである。 これはACTHの刺激、a.M.血しょうコルチゾールおよび尿の自由コルチゾールテストの使用によってされるかもしれません。 極度の有効な副腎皮質ホルモンを受け取っている患者はのために2週以上一度に扱われるべきではないし、小さい区域だけHPAの抑制の高められた危険が原因でいつでも扱われるべきである。
ハロベタゾールプロピオン酸軟膏は、乾癬患者で一週間のために一日あたり7グラムで分割用量で使用されたときにHPA軸抑制を生産しました。 これらの効果は、治療の中止時に可逆的であった。
HPA軸抑制が注目されている場合は、薬物を撤回したり、適用頻度を減らしたり、より強力でないコルチコステロイドを代用したりする試みを行 HPAの軸線機能の回復は項目副腎皮質ホルモンの停止に一般に敏速です。 まれに、glucocorticosteroidの不十分の印そして徴候は補足の全身の副腎皮質ホルモンを要求して発生するかもしれません。 全身の補足の情報のために、それらのプロダクトのための情報を規定することを見なさい。
小児患者は、皮膚表面と体重比が大きいため、同等の用量から全身毒性の影響を受けやすくなる可能性があります(注意事項:小児使用を参照)。
刺激が発症した場合は、ハロベタゾールプロピオン酸軟膏を中止し、適切な治療を開始する必要があります。 コルチコステロイドによるアレルギー性接触皮膚炎は、通常、コルチコステロイドを含まないほとんどの局所製品と同様に臨床的悪化に注意するのではなく、治癒の失敗を観察することによって診断される。 そのような観察は適切な診断パッチテストと確証されるべきです。
付随する皮膚感染症が存在するか、または発症する場合は、適切な抗真菌剤または抗細菌剤を使用する必要があります。 好ましい応答がすみやかに起こらなければ、伝染が十分に制御されたまでHalobetasolのプロピオン酸塩の軟膏の使用は中断されるべきです。
ハロベタゾールプロピオン酸軟膏は、酒さまたは口周囲皮膚炎の治療に使用すべきではなく、顔面、鼠径部、または腋窩に使用すべきではない。
患者のための情報
局所コルチコステロイドを使用している患者は、以下の情報および指示を受けるべきである:
- 薬は医師の指示 それは外的な使用だけのためです。 目との接触を避ける。
- 薬は、それが処方されたもの以外の障害に使用すべきではありません。
- 治療された皮膚領域は、医師の指示がない限り閉塞するように、包帯をしたり、そうでなければ覆われたり包まれたりしてはならない。
- 患者は医師に局所的な副作用の兆候を報告する必要があります。\
実験室試験
以下の試験は、HPA軸抑制のための患者の評価に有用であり得る:ACTH刺激試験;A.M.血漿コルチゾール試験;尿中遊離コルチゾール試験。
発癌、突然変異誘発、生殖能力の障害
ハロベタゾールプロピオン酸塩の発癌性を評価するための長期動物研究は行われていない。 二つの遺伝毒性アッセイで陽性の変異原性効果が観察された。 プロピオン酸ハロベタゾールはチャイニーズハムスター小核試験およびinvitroでのマウスリンパ腫遺伝子変異アッセイで陽性であった。
経口投与後のラットにおける50mcg/kg/日までの用量レベルでの研究では、生殖能力または一般的な生殖能力の障害は示されなかった。
他の遺伝毒性試験では、プロピオン酸ハロベタゾールは、エイムズ/サルモネラアッセイ、チャイニーズハムスターの体細胞における姉妹染色分体交換試験、げっ歯類の胚および体細胞の染色体異常試験、および点突然変異を決定するための哺乳類のスポット試験では遺伝毒性ではないことが判明した。
妊娠
催奇形性効果:妊娠カテゴリー C
コルチコステロイドは、比較的低い投与量レベルで全身投与された場合、実験動物で催奇形性であることが示されている。 ある副腎皮質ホルモンは実験動物の皮膚適用の後で催奇形性であるために示されていました。
ハロベタソールプロピオン酸塩は、SPFラットおよびチンチラ型ウサギにおいて、ラットでは0.04-0.1mg/kg、ウサギでは0.01mg/kgの用量で妊娠中に全身投与された場合、催奇形性であることが示されている。 これらの用量は、ハロベタゾールプロピオン酸軟膏のヒト局所用量である、それぞれ約13、33および3倍である。 ハロベタソールプロピオン酸はウサギでははい毒性であったが,ラットでは毒性ではなかった。
口蓋裂はラットとウサギの両方で観察された。 オムファロセレはラットでは見られたが,ウサギでは見られなかった。
妊婦におけるハロベタゾールプロピオン酸塩の催奇形性に関する適切かつ十分に制御された研究はない。 Halobetasolのプロピオン酸塩の軟膏は潜在的な利点が胎児への潜在的な危険を正当化するときだけ妊娠の間に使用されるべきです。
授乳中の母親
全身投与されたコルチコステロイドは、ヒトミルクに現れ、成長を抑制したり、内因性コルチコステロイド産生を妨害したり、他の厄介な効果を引き起こす可能性がある。 副腎皮質ホルモンの項目管理が十分な全身の吸収で人間のミルクの探索可能な量を作り出すために起因できるかどうか知られていません。 多くの薬剤が人間のミルクで排泄されるので、ハロベタゾールのプロピオン酸塩の軟膏が看護の女性に管理されるとき注意は運動されるべきです。
小児使用
小児患者におけるハロベタゾールプロピオン酸軟膏の安全性と有効性は確立されておらず、12歳未満の小児患者での使用は推奨されていない。 ボディ固まりへの皮の表面積のより高い比率のために、小児科の患者は項目副腎皮質ホルモンと扱われるときhpaの軸線の抑制およびCushingのシンドローム 従ってそれらは処置の回収の間にまたはの後で副腎の不十分のより大きい危険にまたあります。 脈理を含む有害作用は幼児および子供の項目副腎皮質ホルモンの不適当な使用と報告されました。
hpa軸抑制、クッシング症候群、線形成長遅延、遅延体重増加および頭蓋内高血圧は、局所コルチコステロイドを受けている小児で報告されている。 小児における副腎抑制の発現には、血漿コルチゾールレベルの低下およびACTH刺激に対する応答の欠如が含まれる。 頭蓋内圧亢進症の症状には、膨隆した泉門、頭痛、および両側乳頭浮腫が含まれる。
高齢者の使用
ハロベタゾールプロピオン酸軟膏で治療された850人の患者の臨床研究では、21%が61歳以上であり、6%が71歳以上であった。 これらの患者と若年患者の間で安全性または有効性の全体的な違いは観察されず、他の報告された臨床経験では、高齢者と若年患者の間で反応の差が確認されていないが、一部の高齢者の感受性が高いことを排除することはできない。
有害反応
対照臨床試験では、ハロベタゾールプロピオン酸軟膏について報告された最も頻繁な有害事象には、患者の1.6%で刺すか燃焼が含まれていた。 あまり頻繁に報告されていない副作用は、膿疱症、紅斑、皮膚萎縮、白皮症、ざ瘡、かゆみ、二次感染、毛細血管拡張症、蕁麻疹、乾燥肌、miliaria、感覚異常、および発疹であった。
以下の追加の局所有害反応は、局所コルチコステロイドではまれに報告されており、ハロベタゾールプロピオン酸軟膏などの高効力コルチコステロイドではより頻繁に発生することがある。 これらの反応は、発生のおおよその減少順に記載されています:毛嚢炎、多毛症、にきび形発疹、色素沈着低下、口周囲皮膚炎、アレルギー性接触皮膚炎、二次感染、脈理およびmiliaria。
有害反応の疑いを報告するには、Teligent Pharma,Inc.にお問い合わせください。 1-856-697-1441、または1-800-FDA-1088またはwwwのFDAで。fdaだgov/medwatch.
Overdosage
局所的に適用される、ハロベタソールプロピオン酸軟膏は、全身効果を生成するのに十分な量で吸収することができます(注意事項を参照)h
ハロベタソールプロピオン酸軟膏の投与量および投与
あなたの医師の指示に従って、毎日一度か二度、影響を受けた皮膚にハロベタソールプロピオン酸軟膏の薄層を適用し、優しく、完全にこする。
ハロベタゾールプロピオン酸軟膏は、超高効力の局所コルチコステロイドである; したがって、治療は2週間に制限されるべきであり、50g/wkを超える量は使用すべきではない。 他の副腎皮質ホルモンと同じように、療法は制御が達成されるとき中断されるべきです。 2週間以内に改善が見られない場合は、診断の再評価が必要な場合があります。
Halobetasolのプロピオン酸塩の軟膏は閉鎖的なドレッシングと使用されるべきではないです。
ハロベタソールプロピオン酸軟膏はどのように供給されていますか
ハロベタソールプロピオン酸軟膏は、0.05%以下のチューブサイズで供給されてい:
50g(NDC63739-998-67)
保管
ハロベタゾールプロピオン酸軟膏を15°C〜30°C(59°F〜86°F)の間で保管してください。
50g(NDC63739-998-67)
50g(NDC63739-998-67)
保管
製造者:Teligent Pharma,Inc.
Buena,NJ08310
Distributed by:
McKesson Corporation
dba Sky Packaging
4971Southridge Blvd.,Suite101
Memphis,TN38141
PI-073-00
C101430Rev02/2020
パッケージラベル。主要な表示パネル50グラムのカートン
Ndc63739-998-67ハロベタゾールのプロピオン酸塩軟膏、項目使用だけのための0.05%
。
目には使用できません。
純重量。 50 grams
Rx Only

| HALOBETASOL PROPIONATE Halobetasol Propionate Ointment |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – McKesson Corporation (140529962)
Registrant – Teligent Pharma, Inc. (011036910)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Teligent Pharma, Inc. | 011036910 | manufacture(63739-998) | |
Frequently asked questions
- Halobetasol vs. clobetasol – how do they compare?
- これはツタウルシに使用できますか?
- 頭皮に使用できますか?
ハロベタゾール局所についての詳細
- 副作用
- 妊娠中または授乳中
- 投与量情報
- 薬物相互作用
- 代替案を比較
- 価格&クーポン
- 25レビュー
- 薬物クラス: topical steroids
Consumer resources
- Patient Information
- Halobetasol Topical application (Advanced Reading)
Professional resources
- Prescribing Information
- Halobetasol (FDA)
- Halobetasol Cream (FDA)
- Halobetasol Foam (FDA)
Other brands Ultravate, Lexette, Bryhali, Halonate
Related treatment guides
- Plaque Psoriasis
- Eczema
- Psoriasis
- Atopic Dermatitis
- Granuloma Annulare
- Dermatitis
Medical Disclaimer
Leave a Reply