국경에서는 약리학
소개
리 유형의 nanocarrier 가 널리 이사에 대한 약물 전달 목적입니다. 이들은 별개의 수성 공간을 둘러싸는 인지질 이중층으로 구성되어있어서 친수성 및 소수성 화합물 모두의 캡슐화를 허용한다(Metselaar and Storm,2005). 리포좀은 치료 화합물을 안정화시키고 세포 및 조직 흡수에 대한 장벽을 극복 할 수있다(Ding et al., 2006; 후아와 우,2013). 이것은 그들이 질병 부위로의 화합물의 표적화를 개선하고 결과적으로 비 표적 기관에서의 축적을 감소시킬 수있게한다(Bakker-Woudenberg et al.,1994;Mastrobattista 외.,1999;Hua,2013;Hua 외.,2015;Sercombe 외.,2015;주 누니 바헤드 외., 2017). 네 가지 주요 형태의 리에 따라 그들의 표면 특성–종래의 리 PEGylated 리 ligand 대상으로 리,theranostic 리(그림 1;Sercombe et al., 2015). Ligand 대상으로 리를 제공한 잠재적 위해 사이트별 전달하는 약물의 특정 조직 또는 장기하는 선택적으로 표현한 표적 ligand(윌리스와 Forssen,1998;Bendas,2001;Sawant 및 Torchilin,2012)는 반면,PEGylated 리를 부여 입체적 방해를 향상 순환의 반감기의 전달 시스템을 다음과 같은 조직 관리(Torchilin,1994;왕 et al., 2015). 리 조합의 다양한 배송 플랫폼을 향상시킬 수 있습 배달의 캡슐화된 화합물,경로에 따라 관리하고 사이트의 질환입니다.
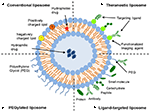
그림 1. 상이한 유형의 리포좀 성 약물 전달 시스템의 개략적 표현–(A)통상적 인 리포좀,(B)페 길화 된 리포좀,(C)리간드-표적화 된 리포좀 및(D)Theranostic 리포좀(Sercombe et al., 2015).
다음과 같은 제조 프로세스,리 특징을 보장 동질성의 번호를 통해 매개변수를 포함하여 약 캡슐에 넣기,리간드-활용,지질 구성,표면의 충전,형태학적 속성(예를들면,크기,모양,그리고 수 lamellae)(Kuntsche et al., 2011). 이러한 특성이 중요 그들이 큰 영향을 미칠 수 있는 행동에 리의 모두에서 vitro 및 in vivo(Sawant 및 Torchilin,2012;Sercombe et al., 2015). 인식 및 통관 리의 몸에 의해의 방어를 포함하여 세망 내피 시스템(RES)고의 흡착 opsonins 이후 흡수에 의해 단핵세포,시스템의 주요 참가자를 통관 및 성능 저하의 리(Senior,1987;Cullis et al.,1998;이시다 외., 2001). 따라서,제조 된 리포좀의 물리 화학적 특성을 결정할 수있는 것은 추가 병진 평가를 위해 제형을 최적화하는 데 중요합니다.
리포좀의 물리 화학적 평가에서 중요한 측면은 현미경을 사용하여 나노 입자의 형태를 시각화하는 것입니다. 의 숫자가 사용할 수 있는 기법이 이미징 리고 다른 나노입자가 될 수 있는 광범위하게 분류된 빛으로,전자,또는 원자력 현미경(비비 et al., 2011). 각 기술에는 나노 입자 기반 약물 전달 시스템에 대한 연구를 평가할 때 고려해야하는 고유 한 장점과 한계가 있습니다(표 1). 이 검토는 리포좀의 형태 학적 특성을 평가하는 데 사용 된 각 이미징 기술을 평가합니다.

표 1. 리포좀 형태학을 특성화하기위한 현재의 이미징 기술의 요약.
광학 현미경
빛나 광학 현미경을 참조하여 현미경을 이용하는 가시광고의 배열을 확대하기 위하여 렌즈의 분야기(머피와 Davidson,2012c). 기초 광학 현미경으로 자체를 제공할 수 없는 종합적인 정보에 대해 지질 bilayer 에 비해 세부사항 제공하여 다른 현미경 기법입니다. 그러나 기본 실험실 장비를 사용하여 소포의 이미지를 신속하게 얻는 데 사용할 수 있습니다(Bibi et al., 2011). 이 기술은 특히 유용할 수 있습할 때 수집하는 일반적인 정보에 대한 크기,모양,동질성,고도의 집계의 샘플 리포좀(Nallamothu et al., 2006). 빛을 현미경 궁극적 인 해상도의∼250nm(의 가장 작은 회절한 점 크기를 얻을 수 있는 악기에 의해)및 이와 같은 일반적으로 불가능한 자세한 정보를 제공에 관한 구조물의 작은 추가 되었 소포(Suv)및 lamellarity 소포(비비 et al., 2011). 일반적으로,광학 현미경으로만 제공할 수 있습에 대한 중요한 정보를 거대한에 추가 되었 소포(GUVs),할 수 있는 범위에서 단일의 수백 마이크로미터에서는 직경(Bagatolli,2009). 법인의 형광 프로브,양극화 기술,응용 프로그램의 높은 해상도의 공초점 현미경을 제공할 수 있는 더 많은 정보에 대해 3 차원 구조 및 lamellarity 의 소포(Bagatolli,2009).
편광 현미경
이 유형의 광학 현미경을 이용한 기능의 극화된 가벼운 상호 작용하 polarizable 채권렬의 분자(머피와 Davidson,2012d). 향상된 광 흡수는 샘플의 분자 쌍극자가 입사 광파의 편광 벡터와 정렬 될 때 발생합니다; 결과적으로 샘플링 광선간에 위상차가 발생하여 차례로 이미지 평면에서 진폭의 간섭 의존적 변화를 생성합니다(Murphy and Davidson,2012d). 그런 다음 이미지 콘트라스트는 간섭 및 회절의 영향뿐만 아니라 정렬 된 분자 배열의 존재로 인해 발생합니다(Murphy and Davidson,2012d). 그것은 혈장 막의 지질 이중층을 포함하여 많은 정렬 된 세포 구조의 형태와 역학을 연구하는데 사용될 수있다(Bibi et al. 그 결과,그 결과는 다음과 같습니다. 이미지는 단색 또는 컬러로 얻을 수 있습니다. 이 기술은 특히 소포의 형성을 확인하기 위해 리포좀을 시각화하는 대체 방법을 제공합니다. 그것은 소포의 이중층 특성 또는 라멜라성에 관한 결정적인 관찰을 제공하지 않는다(Bibi et al., 2011). 또한,편광 현미경 또한 제한의 크기에 의해 소포할 수 있는 시각,대형 소포에서 마이크로미터 범위는 데 최적의 명확성입니다. 이 기술은 나노 미터 범위의 입자의 선명한 이미지를 제공하지 않습니다.
Fluorescence Microscopy
형광 또는”epifluorescence”현미경은 특별한 형태의 광학 현미경을 악용하는 능력의 fluorochromes 을 방출한 후에 빛으로 흥분되는 빛의 특정 파장(머피와 Davidson,2012b). 이 기술은 막 구성 요소의 구조와 역학에 대한 필수 정보를 제공하기 위해 생물 물리학에서 널리 사용됩니다(Bouvrais et al., 2010). 이러한 연구에서 형광 프로브는 조사중인 멤브레인에 특이 적으로 통합되어 구조의 시각화를 허용합니다. 다양한 화학 및 광자 특성을 지닌 광범위한 형광 염료가 시판되어 다양한 연구 질문에 응합니다. 예를 들어,특정 형광 염료는 상이한 배열 및 측면 패킹을 나타내는 특정 막 환경을 선호 할 수있다(Bouvrais et al., 2010). 이와 같이,형광 현미경할 수 있습에 대한 잠재력을 동시에 적용하는 여러 프로브에서 견본에 대한 정보를 제공하고 막는 구조 자체입니다. 형광 프로브는 리포좀의 지질 이중층뿐만 아니라 수성 구획 내에 배치 될 수있다(Bibi et al., 2011). 이 배열은 지질 소포의 모양,크기 및 유동성에 관한 정보를 얻을 수있는 Guv 를 볼 때 특히 유용 할 수있다(Klymchenko et al.,2009;Bouvrais 외., 2010). 지질 이중층에 직접 로다 민-표지 된 지질과 같은 프로브의 혼입은 또한 리포좀의 라멜라 성의 시각화를 허용 할 수있다(Bibi et al., 2011).
단점의 형광 현미경을은 또한 프로브와 염료는 막 시스템을 잠재적으로 방해한 속성의 자주 배달 시스템(Bouvrais et al.,2010;비비 외. 그 결과,그 결과는 다음과 같습니다. 그러나,낮은 염료 농도(≤1mol%)의 사용은 막의 물리적 특성에 최소한의 영향을 미치는 것으로 나타났다(Bouvrais et al., 2010). 그것은 또한 중요한 선택의 형광성 염료 중요한 단계,일부로 염색을 일으킬 수 있는 큰 변화는 호스트에서 멤브레인 및/또는 원인 실험적 유물의 결과,부정확한 데이터 해석(Bouvrais et al., 2010). 또한,사진-유도 지질 과산화는 또한 단순한 염료 시스템에서도 도메인 형성을 초래할 수있다. 이 과정은 큰 뗏목의 형성과 자발적인 패싯 형성을 초래할 수있다(Bouvrais et al., 2010). 형광등에 장기간 노출되면 표백 및 형광 강도의 손실이 발생할 수도 있습니다. 따라서 형광 염료의 선택과 새로운 막 프로브의 개발은 형광 현미경을 사용할 때 중요한 고려 사항입니다(Klymchenko et al., 2009).
공 초점 현미경
공 초점 스캐닝 현미경은 형광 현미경의 영역에서 발전되어왔다. 보다 빛나 전체 샘플 이미지는 내장 된 스캔하여 하나의(또는 그 이상)의 초점을 맞춘 광선에서 샘플입니다. 빛에서 돌아온 조명 예제를 통해 전달 조리개를 거부할 수 있는 초점 빛을 위 아래에서 비행기 의자; 작은 피사계 심도에서 이미지 만 얻을 수 있도록 보장하여 평면 외 해상도를 크게 향상시킵니다(Bibi et al. 그 결과,그 결과,그 결과는 다음과 같다. 이 기술을 이용하여,”z-스택”이 이미지의 수집에서 시작하여,최고의 기 뒤에 이미지를 촬영에서 정의 z-씩의 아래쪽 예제에서 결과 종합 3D 이미지 샘플의(비비 et al. 그 결과,그 결과,그 결과는 다음과 같다. 공 초점 스캐닝 현미경은 우수한 이미지 선명도로 인해 에피 형광 빛 현미경보다 더 매력적인 기술이되었습니다. 의 경우에 GUVs,이 기술은 수상은 내부 구조는 지질의 시스템은 종종 가능하지 않은 다른 현미경 방법(Ruozi et al. 그 결과,그 결과는 다음과 같습니다. 예를 들어,수성 및 지질 이중층 단계의 분리는 더 큰 소포체에서 명확하게 시각화 될 수있다(Mertins and Dimova,2013). 그러나,공초점 현미경은 여전히 회절 제한되고,따라서 할 수 없을 생산하는 고화질의 이미지를 Suv 차량 또는 oligolamellar 리(Ruozi et al., 2011).
전자 현미경 기법
전자 현미경 방법에 대한 시각화의 소에서 매우 높은 배율(Henry,2005). 그것은에서 널리 이용되는 특성을 지질 소포으로 전자파장(따라서 회절한 해결)의 많은 주문 크기의 그것 보다는 더 낮은 광학 현미경,따라서 제공하는 최고해상도에 대한 명확한 시각화의 작은 리(비비 et al.,2011;Ruozi 외., 2011). 이 기술은 다양한 전자기 렌즈에 의해 시료의 표면에 초점을 맞춘 전자 빔을 사용합니다. 전자는 다음에 흩어져에 의해 샘플을,그리고 다음 재 집중하고 확대하여 더욱 시리즈의 전자기 렌즈에 이미징 열을 생산 계획한 이미지(Henry,2005). 전자 현미경에는 여러 가지 유형이 있으며,각각 다른 샘플 준비 방법이 필요합니다.
스캐닝 전자 현미경(SEM)
스캐닝 전자 현미경(SEMs)을 활용하는 전자 빔을 스캔하거나 통해 샘플을(을 통해 보다는 오히려 샘플)생산 확대된 이미지의체(Adler 및 Schiemann,1985). 알더 등. 1984 년 리포좀을 특성화하기 위해 sem 을 처음 사용하려고 시도했다(Adler and Schiemann,1985). 그들이 나타났을 사용하여 동결 건조 방법을 준비하는 리포좀 샘플 SEM 결과에 큰 비중의 덩어리를 볼 수 있고 딱지 재료(Adler 및 Schiemann,1985). 더 많은 최근의 연구는 리포좀 구조물 자체의 고통을 수 있습니다 물결로 인해 고진공의 조건과 염색 과정에 필요한이 준비 기법(Ruozi et al., 2011). Sem 은 이제 이미징 전에 샘플을 건조 또는 고정해야하기 때문에 리포좀 분석에 일반적으로 사용되지 않습니다(Ruozi et al., 2011). 그러나,SEM 을 제공할 수 있는 일반적인 내용에 동심 구조의 다른 지질 층을 줄 뿐만 아니라 세부사항에 크기와 구형의 형태를 준비(Nirale et al., 2009).
투과 전자 현미경(TEM)
투과 전자 현미경(TEM)은 나노 입자의 구조 평가에 가장 자주 사용되는 이미징 방법입니다(Henry,2005;Kuntsche et al., 2011). 그것은 포함한 준비의 얇은 표본(<100nm 두께)에 배치되는 진공 챔버입니다. 전자빔은 샘플을 가로 지르며,여기서 대물 렌즈에 의해 초점을 맞추어 이미지를 형성합니다. TEM 은 크기가 1nm 이하인 공간 해상도로 연질 물질 샘플을 쉽게 이미지화 할 수 있습니다(Henry,2005;Kuntsche et al.,2011;Ruozi 외., 2011). 이 기술은 될 수 있습니다 추가 기준으로 분류됩 샘플 준비 방법을 활용–특히,부정적인 염색,냉동 골절하고 저온 TEM. 그것은 정보를 제공할 수 있는 표면에 수정 나노 입자를 제공하므로 더 잘 반면과 윤곽의 이미지보다는 다른 현미경 기법입니다. 예를 들어,DSPC/콜레스테롤 리포좀의 표면으로의 트랜스페린의 접합은 비 접합 리포좀 제제(Anabousi et al., 2005). 별도의 실험,특정 항체를 제기에 대하여 인간의 transferrin 추가하기 전에 부정적인 얼룩한 절차를 확인합의 id 를 입자 표면 코팅(Anabousi et al., 2005). 따라서,tem 은 리포좀의 표면에 대한 리간드의 결합을 평가할 때 훨씬 향상된 분해능을 달성 할 수있는 가능성을 제공한다.
부정적인 염색 기법
에 부정적인 얼룩 TEM,샘플 준비는 포함한 작은 양의 수분 샘플에 배치됩니다. 소포가 그리드와 직접 접촉함에 따라,그들의 방향 및 형태가 영향을받을 수 있으며,따라서이를 고려해야한다(Bibi et al., 2011). 또한 리포좀을 적절한 전자 고밀도 물질(예: 무거운 금속 염 다음과 같 uranyl 아세테이트나 phosphotungstic 산)가 제공하는 높은 반면,그래서 소포 볼 수 있습니다에 대하여 다크 스테인드 배경(Ruozi et al., 2011). 음-염색 기술은 상대적으로 빠르고 간단하다;그러나,그것을 일으키는 원인이 되기 위하여 보였 변경 사항을 원래 liposome 구조할 수 있도 빛과 어둠의 변두리일 수 있는 착각 표층 구조(비비 et al.,2011;Ruozi 외., 2011). 또한,샘플을 배치하는 진공 상태에서 될 수 있습니다 추가 탈수 샘플의 수 있는 다시 원인 변화에서의 구조는 소포(비비 et al., 2011). 는 동안 부정적인 얼룩 TEM 기술을 제공할 수 있습이 훨씬 더 높은 배율을 위한 영상 나노 입자,손상을 liposome 구조물을 정확하게 평가하는 형태적 특성의 샘플입니다. 따라서 일반적으로 결과를 확인하기 위해 다른 이미징 기술이 필요합니다.
냉동 골절한 기술
정 골절한 기술이 필요하지 않습 건조 과정을 제공할 수 있습니다 추가적인 정보에 대한의 내부 구조를 나노입자(Kuntsche et al., 2011). 이 방법은 두 개의 구리 또는 금 홀더(Severs,2007)사이에 끼워지는 TEM 그리드에 샘플을 배치하는 것을 포함합니다. 샘플은 유리화를 통해 급속 동결,일반적으로 액체 프로판 또는 액체 질소,되기 전에 골절에 따라 영역으로 샘플의 약한 분자 상호 작용합니다. 이 골절 표면이 될 수 있습니다 추가로 에칭하고 숨겨진 얇은 백금 또는 탄소 층을 제공”부정적인”의 복제본이 골절 샘플이 비행기(절단,2007;Kuntsche et al., 2011). 그런 다음 복제본을 유기 용매로 세척하여 TEM 현미경으로 시각화하기 전에 모든 잔류 물을 제거합니다. 이러한 복제본은 매우 안정적이므로 나중에 저장하고 볼 수 있습니다(Kuntsche et al., 2011). 의 주요 장점 이 기술은 복제 밀접하게 반영하는 기본 상태의 샘플을 제공할 수 있습니다에 대한 자세한 정보를 3 차원 구조의 소포 bilayer 조직(비비 et al.,2011;Kuntsche 외., 2011). 이 정보에는 다층성 소포의 다층성 건설 및 이중층 패킹이 포함됩니다. 이 기술은 또한 집계 크기를 평가할 수 있으며 DNA 와 양이온 성 리포좀의 상호 작용을 검사하는 데 특히 유용 할 수 있습니다(Bibi et al., 2011). 그러나 유물에 여전히 발생할 수 있습니다 샘플 준비하는 동안 부족으로 인해 동결 속도,재 deposition 용매의 분자 및/또는 기계적 스트레스(서버,2007;Kuntsche et al., 2011). 예를 들어,샘플의 Suv 에서”졸졸 효과”가 발생할 수 있습니다(Bibi et al., 2011). 이것은 동결에 앞서 아실 사슬의 전이에 장애로 인한 일반적인 이중층 변형입니다. 전이 전 온도와 실제 전이 온도 사이의 배양 소포는 또한 잔물결을 일으킬 수있다(Bibi et al., 2011). 흥미롭게도,이를 제공하는 데 사용할 수 있습으로 정보를 지질 위상 전환으로 발생하는 다양한 자연의 지질 사용을 위한 자주 준비(비비 et al., 2011).
극저온 TEM
극저온 TEM(cryo-TEM)의 변형 TEM 는 얇은 수용성 수화 영화는 유리화 액체에서 에탄은 사용하기 전에 이미징. 이 기술을 이용한 분석의 리서 그들의 대부분의 네이티브 상태,그리고 유용한 도구입니다 확인 크기,형태,내부 구조,그리고 lamellarity 의 리(와이즈먼 et al.,2004;비비 외.,2011;Kuntsche 외., 2011). 급속 냉동 리포좀 샘플의 주요 이점은 얼음 결정의 형성을 최소화하고 단백질 또는 기타 물질을 보존하는 것입니다(Bibi et al.,2011;Kuntsche 외., 2011). 이것은 단백질 또는 DNA 가 나노 입자 내에 캡슐화 된 곳에서 유익하다(Weisman et al.,2004;Kuntsche 외., 2011). Cryo-TEM 가 가장 유용한 형태의 현미경 현재 사용할 수 있는 연구 리,그것이 문제를 피할 수는 화학 고정,탈수,절단하고 염색의 모든에 영향을 미칠 수 있는 형태의 소포(비비 et al., 2011). 해상도 범위는 필름의 두께에 의해 정의 된 바와 같이∼5 내지 500nm 이다(Almgren et al., 2000). 그러나 몇 가지 제한 사항이 주목해야한다 이 기술을 포함한다는 사실만 2D 이미지에서 얻어진 3D 객체(일반적으로 또한 적용하는 대부분의 다른 현미경 기법). 이러한 한계를 극복하기 위해,재건의 3 차원 형상에서 충분히 많은 수의 2D 의 이미지를 임의로주가 아닌 구형 입자를 가능(Orlova et al.,1999)뿐만 아니라 3D 모양에 대한 정보를 얻기 위해 다른 기울기 각도로 샘플을 볼 수 있습니다(Van Antwerpen and Gilkey,1994). 저온 전자 단층 촬영(cryo-ET)은 또한 3D 이미지를 얻기 위해 대신 사용될 수있다(Le Bihan et al., 2009). Cryo-TEM 은 또한 낮은 용량의 전자를 이용하는데,이는 종종 다른 방법에 비해 낮은 해상도를 갖는다는 것을 의미한다(Bibi et al.,2011;Kuntsche 외., 2011). 유물은 여전히 가능하의 형성으로 인해 얇은 필름의 무조직 아이스의 사용 압에서 샘플을 적용하는 전단력하는 동안 필름 형성(Almgren et al.,2000;비비 외., 2011).
환경 스캐닝 전자 현미경(ESEM)
환경 스캐닝 전자 현미경(ESEM)은 이미징 시스템을 필요로하지 않는 사용은 고정,염색 또는 동결 소포할 수 있도록 허용상의 동적인 변화의 젖은 시스템에없이 이전 샘플 준비(Muscariello et al.,2005;Ruozi 외., 2011). ESEM 의 주요 특징은 현미경 챔버에 물 증기가 존재한다는 것입니다. 를 유지하는 능력 물 함유 분위기는 샘플이 될 수 있는 부분적으로 또는 완전히 수화가 만들어 가능한 사용에 의하여 다중 조리개,졸업 진공할 수 있는 시스템 이미징 약실을 지속적인 압력에서 최대 55hPa(비비 et al.,2011;Ruozi 외., 2011). 기본 전자 빔을 생성할 수 있 이차 전자는 다음을 발생하는 수증기 분자,주요 캐스케이드의 신호 증폭에 도달하기 전에 검출기입니다. 이 때문에 ESEM 은 샘플 준비가 필요하지 않습니다(Muscariello et al., 2005). 이 기술은 일련의 압력,온도 및 가스 조성을 통해 샘플 환경의 변화를 허용합니다(Mohammed et al.,2004),이는 환경 변화가 소포에 미치는 영향을 결정할 때 유용하다. 이것은 나노 의약품 제형 및 안정성 연구에 적용 가능하다(Bibi et al., 2011). ESEM 은 또한 리포좀의 이중층으로 약물 로딩을 분석하는 데 사용되어왔다(Mohammed et al.,2004)뿐만 아니라 소포의 크기와 모양을 결정합니다. ESEM 의 한계는 나노 스케일 구조의 라멜라 성 및 내부 아키텍처에 관한 자세한 정보를 제공 할 수 없다는 것이다(Ruozi et al., 2011).
원자 힘 현미경(AFM)
원자 힘 현미경(AFM),일컬어 스캐닝 힘 현미경(sfm)는,스캐닝 조사 현미경 기술의 유형입니다. 그것은 작품을 실행하여 날카로운 끝에 부착된 캔틸레버 및 센서의 샘플을 측정하는 표면 사이의 힘은 조사와 샘플(Sitterberg et al., 2010). 캔틸레버가 샘플 표면을 따라 달리면서 표면 특징으로 인해 위아래로 이동하고 그에 따라 캔틸레버가 편향됩니다. 이 편향은 일반적으로 광 센서를 사용하여 정량화되며,레이저 빔은 캔틸레버의 뒷면에 광 검출기로 반사됩니다(Sitterberg et al., 2010). AFM 이 필요하지 않습를 진공에서 운영하고 운영할 수 있습니다에서 주변 공기 또는 액체;그러므로 그는 사례가 늘어나고 있는 것도 이미지를 사용 생물학적 샘플을 뿐만 아니라 나노(리앙 et al.,2004a,b;Ruozi et al., 2005, 2009). AFM 은 뛰어난 해상도의 순서에 분수의 나노과를 제공할 수 있는 3 차원 이미지의 리라에 대한 자세한 내용과 형태,크기 분포,동질성,안정성(리앙 et al.,2004a,b;Ruozi et al., 2005, 2007, 2009). 중요하게,AFM 은 리포좀의 표면 변형을 특성화하고 리포좀 막 표면에서 접합 된 리간드(예:항체 및 중합체)를 검출하는데 사용될 수있다(Bendas et al.,1999;Moutardier 외.,2003;Anabousi 외.,2005;리앙 외., 2005). 예를 들어,Bendas et al. 사용 AFM 를 확 자주 막 국경을 할 수 있었던 이미지 trimeric 구조,약 8~10nm 의 직경에서는 표시되링 IgG 항체를 리포좀 표면(Bendas et al., 1999). 연구 결과를 보여주는 효과의 기술 의존도가 높았 활용에 사용되는 방법으로,항체 활용에 직접 자주면 표시되는 AFM(제한된 이동성 단백질)에서 항체를 연결하는 페 체인입니다. 페그 사슬이 높은 단백질 이동성을 유발하고 따라서 스캔 할 수 없다는 것을 암시했다(Bendas et al., 1999). 반대로,Anabousi et al 보는 법인의 PEGylated 로 지질 리 유도 입체적 안정화과 리를 유지하는 둥근 모양(Anabousi et al., 2005). AFM 의 이미지를 표면의 접합 리었 부드럽고 구조물을 관찰할 수 있는 반면,결합의 transferrin 의 표면 PEGylated 리 표현되었으로 작은 구형 구조물(Anabousi et al., 2005). 마찬가지로,Moutardier et al 리조와 고분자 코어(LSP)구성되어 약물의 로드된 고분자 입자 형성하는 core 지질 vesicles(Moutardier et al., 2003). 촬영된 이미지를 사용하여 AFM 존재를 보여주었의 중합체 네트워크에 외부 표면에는 것을 제안하겐 고분자 핵심 밖으로 발광을 형성 표면층에 LSP(Moutardier et al., 2003). 또한 표면의 구조적 정보,AFM 에 대한 정보를 제공할 수 있습 기계적 및 화학적 특성 표본의 표면을 통해 힘을 측정(Ruozi et al., 2007). 예를 들어,Mao et al. 리포좀의 탄성 및 접착 특성을 평가하기 위해이 기술을 사용했다(Mao et al., 2004). AFM 의 한 가지 한계는 나노 입자가 운모 또는 실리콘 웨이퍼와 같은지지 표면에 흡착 될 필요가 있다는 것입니다. 고체 기질 상에 리포좀의 흡착은 소포의 크기 및 형상을 변형시키고,이들의 평탄화를 유발할 잠재력을 갖는다. (Ruozi 외., 2007). 또한,프로빙 팁의주기적인 접촉은 샘플에서 소포를 가로 질러 이동함에 따라 리포좀을 끌 수있다(Jass et al., 2000). 그럼에도 불구하고,AFM 은 여전히 리포솜의 평가에 유용한 도구이다.
결론
넓은 범위가있 이미징 기술을 사용할 수 있는 평가를 위한 형태의 리,각각은 그것의 자신의 장단점이 있습니다. 광학 현미경을 제공할 수 있는 일반적인 정보에 관한 크기 및 모양의 크 소포과 동질성의 샘플을 상대적으로 빠른 방식이다. 반대로,tem 은 리포좀의 형태를 훨씬 더 자세히 조사하기 위해 가장 일반적으로 사용되는 기술입니다; 그러나 잠재력에 대한 구조적 변경 내용과 함께 각 TEM sub-type 로 인한 염색법 및/또는 노출하는 진공 조건을 고려해야 할 때는 해석의 결과입니다. ESEM 가 가장 유용한 결정할 때에는 자주 변화에 대응하여,환경,반면 AFM 로 떠오르고 있는 유용한 방법에서 형태 학적 분석의 나노 입자를 제공하는 최대 해상도의 자주면. AFM 과 TEM 은 모두 리포좀의 표면에 접합 된 리간드를 이미징 할 수 있으며 표면 변형에 대한 보완 정보를 제공합니다. 전반적으로,기술의 선택은 어떤 형태 학적 특성과 세부 사항의 정도가 필요한지에 달려있다. 또한,각 이미징 기술의 샘플 준비 방법의 잠재적 효과를 이해하는 것이 선택 과정에서 중요합니다.
저자 기고
원고의 초안 작성:A-LR 및 SH. SH,PD,JF,WP,AM,DS 및 AW 와 같은 중요한 지적 내용에 대해 비판적으로 기사를 수정합니다.
이해의 충돌 문
저자가 선언하는 연구가 수행되었의 부재에서 어떠한 상업 또는 금융 서비스를 제공하는 것으로 해석될 수 있는 잠재적인 이해의 충돌.
감사
작가 감사의 말을 전하고 싶은 약학 연구의 신뢰 New South Wales,의 레베카 L.Cooper 의료 연구 기초,글래디스 M. 힘 Fellowship,ausEE 연구재단,및 대학 뉴캐슬의 제공을 위한 금융 지원에 대한 우리의 연구이다.나는 이것이 어떻게 작동하는지 잘 모르겠습니다. 주사 전자 현미경 및 동결 파괴 기술에 의한 리포좀의 특성 분석. 마이크론 마이크로. 액타 16,109-113. 도이: 10.1016/0739-6260(85)90039-5
CrossRef 전체 텍스트|Google Scholar
Almgren,M.,Edwards,K. 및 Karlsson,G.(2000). 리포좀 및 관련 구조의 Cryo 투과 전자 현미경 검사. 콜로이드 서핑. Physicochem. 엥. Asp. 174, 3–21. doi:10.1016/S0927-7757(00)00516-1
CrossRef 전체 텍스트|Google Scholar
Anabousi,S.,Laue,M.,Lehr,C.M.,Bakowsky,U. 그리고,Ehrhardt,C.(2005). 원자 힘 현미경 및 투과 전자 현미경에 의한 리포좀의 트랜스페린 변형 평가. Eur. J. 팜. 바이오 팜. 60, 295–303. doi:10.1016/j.ejpb.2004.12.009
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Bagatolli,La(2009). 멤브레인 및 형광 현미경. 형광 2007 에 대한 리뷰. 뉴욕,뉴욕:스프링거,33-51. doi:10.1007/978-0-387-88722-7_2
CrossRef 전체 텍스트|Google Scholar
Bakker-Woudenberg,I.A.,Storm,G. 그리고 우들,M.C.(1994). 감염의 치료에 리포좀. J. 약물 표적. 2, 363–371. doi:10.3109/10611869408996811
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Bendas,G.(2001). Immunoliposomes:암 치료를 표적으로하는 유망한 접근법. 바이오 러그 15,215-224. doi:10.2165/00063030-200115040-00002
CrossRef 전체 텍스트|Google Scholar
Bendas,G.,Krause,A.,Bakowsky,U.,Vogel,J.,및 Rothe,U.(1999). 새로운 항체 접합 기술에 의해 제조 된 신규 면역 리포 좀의 표적 가능성. Int. J. 팜. 181, 79–93. doi:10.1016/S0378-5173(99)00002-2
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Bibi,S.,Kaur,R.,Henriksen-Lacey,M.,McNeil,S.E.,Wilkhu,J.,Lattmann,E.,et al. (2011). 리포좀의 현미경 이미징:coverslips 에서 환경 SEM 에 이르기까지. Int. J. 팜. 417, 138–150. 도이:10.1016/j.ijpharm.2010.12.021
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Bouvrais,H.,Pott,T.,Bagatolli,L.A.,Ipsen,J.H.,and Meleard,P.(2010). 지질 이중층의 기계적 특성에 대한 막 고정 형광 프로브의 영향. 바이오킴. 바이오피스. 액타 1798,1333-1337. doi:10.1016/j.bbamem.2010.03.026
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Cullis,P.R.,Chonn,A.,and Semple,S.C.(1998). 혈액 단백질과 리포좀과 지질 기반 캐리어 시스템의 상호 작용: 생체 내 클리어런스 행동과의 관계. Adv. 약물 Deliv. 목사 32,3-17. doi:10.1016/S0169-409X(97)00128-2
PubMed 추상|CrossRef 전체 텍스트|Google Scholar
Ding,B.S.,Dziubla,T.,Shuvaev,V.V.,Muro,S.,및 Muzykantov,V.R.(2006). 혈관 내피를 표적으로하는 고급 약물 전달 시스템. 몰. 인터브. 6, 98–112. 도이:10.1124/마일.6.2.7
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Henry,C.R.(2005). 지원되는 나노 입자의 형태학. 음식물. 서핑. Sci. 80, 92–116. doi:10.1016/j.progsurf.2005.09.004
CrossRef 전체 텍스트|Google Scholar
Hua,S.(2013). 염증 부위를 표적으로 함:새로운 염증 요법의 표적으로 세포 간 접착 분자 -1. 앞. Pharmacol. 4:127. 도이:10.3389/fphar.2013.00127
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Hua,S.,Marks,E.,Schneider,J.J.,and Keely,S.(2015). 염증성 장 질환에서 결장 표적 약물 전달을위한 경구 나노 전달 시스템의 발전: 병에 걸린 대 건강한 조직에 대한 선택적 표적화. 나노 의학 11,1117-1132. doi:10.1016/j.나노.2015.02.018
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Hua,S.,And Wu,S.Y.(2013). 표적 통증 치료를위한 지질 기반 나노 캐리어의 사용. 앞. Pharmacol. 4:143. 도이:10.3389/fphar.2013.00143
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Ishida,T.,Harashima,H. 및 Kiwada,H.(2001). 시험 관내 및 생체 내 세포와 리포좀의 상호 작용: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L.,Duportail,G.,et al. (2009). 3-하이드 록시 플라본을 기반으로 한 환경에 민감한 막 프로브를 사용하여 거대한 일 측성 소포에서 지질 도메인의 시각화. 바이오킴. 바이오피스. 액타 1788,495-499. doi:10.1016/j.bbamem.2008.10.019
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Kuntsche,J.,Horst,J.C.,And Bunjes,H.(2011). 콜로이드 성 약물 전달 시스템의 형태를 연구하기위한 극저온 투과 전자 현미경(cryo-TEM). Int. J. 팜. 417, 120–137. 도이:10.1016/j.ijpharm.2011.02.001
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Le Bihan,O.,Bonnafous,P.,Marak,L.,Bickel,T.,Trepout,S.,Mornet,S.,et al. (2009). 리포좀으로 나노 입자 transmigration 의 Cryo-electron tomography. J.Struct. 바이올. 168, 419–425. 도이:10.1016/j.jsb.2009.07.006
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Liang,X.,Mao,G. 및 Ng,K.Y.(2004a). 원자 힘 현미경에 의한 운모상의 콜레스테롤 함유 리포좀의 기계적 성질 및 안정성 측정. J. 콜로이드 인터페이스 Sci. 278, 53–62.
PubMed Abstract|Google Scholar
Liang,X.,Mao,G. 및 Ng,K.Y.(2005). 작은 unilamellar 리포좀 형태 및 안정성에 대한 PEO-PPO-PEO 의 사슬 길이의 효과:AFM 조사. J. 콜로이드 인터페이스 Sci. 285, 360–372. 도이:10.1016/j.jcis.2004.11.042
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Liang,X.,Mao,G. 및 Simon Ng,K.Y.(2004b). 원자 힘 현미경에 의해 운모 표면에 작은 unilamellar EggPC 소포를 프로빙. 콜로이드 서핑. B 바이오인터페이스 34,41-51.
PubMed Abstract|Google Scholar
Mao,G.,Liang,X. 및 Ng,K.Y.S.(2004). 나노 과학 및 나노 기술 백과 사전. 뉴욕,뉴욕:마르셀 데커.
Google 학술검색
Mastrobattista,E.,Koning,G.A.,폭풍,G.(1999). 항 종양 약물의 표적 전달을위한 면역 리포 좀이다. Adv. 약물 Deliv. 목사 40,103-127. doi:10.1016/S0169-409X(99)00043-5
CrossRef 전체 텍스트/Google Scholar
Mertins,O.,및 Dimova,R.(2013). 인지질 소포와 키토산의 상호 작용에 대한 통찰력. 2 부:막 경직 및 기공 형성. 랑 뮤어 29,14552-14559. doi:10.1021/la4032199
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Metselaar,Jm,And Storm,G.(2005). 염증성 질환의 치료에서 리포좀. 전문가 Opin. 마약 델리브. 2, 465–476. doi:10.1517/17425247.2.3.465
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Mohammed,A.R.,Weston,N. 이러한 유형의 치료법은 질병의 발병을 예방하는 데 도움이 될 수 있습니다. 저조한 물 용해성 약물의 리포좀 제제:약물 로딩의 최적화 및 안정성의 ESEM 분석. Int. J. 팜. 285, 23–34. 도이:10.1016/j.ijpharm.2004.07.010
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Moutardier,V.,Tosini,F.,Vlieghe,P.,Cara,L.,Delpero,J.R.,and Clerc,T.(2003). 경구 투여 모델에서 콜로이드 항암제 생체 이용률. Int. J. 팜. 260, 23–38. 도이:10.1016/S0378-5173(03)00231-X
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Murphy,D.B. 및 Davidson,M.W.(2012a). 공 초점 레이저 스캐닝 현미경. 광 현미경 및 전자 이미징의 기본,2nd Edn. Hoboken,NJ:John Wiley&Sons,265-305. doi:10.1002/9781118382905.ch13
CrossRef 전체 텍스트|Google 학술검색
머피,D.B. 및 Davidson,M.W.(2012b). 형광 현미경. 가벼운 현미경 및 전자 이미징의 기본. 와인 하임: John Wiley&Sons,199-231. doi:10.1002/9781118382905.ch11
CrossRef 전체 텍스트|Google 학술검색
머피,D.B. 및 Davidson,M.W.(2012c). 가벼운 현미경 및 전자 이미징의 기본. Hoboken,NJ:John Wiley&Sons,1-19. doi:10.1002/9781118382905
CrossRef 전체 텍스트|Google 학술검색
머피,D.B. 및 Davidson,M.W.(2012d). 편광 현미경. 가벼운 현미경 및 전자 이미징의 기본. 뉴저지 호보 켄: John Wiley&Sons,153-171. doi:10.1002/9781118382905.ch9
CrossRef 전체 텍스트|Google Scholar
Muscariello,L.,Rosso,F.,Marino,G.,Giordano,A.,Barbarisi,M.,Cafiero,G.,et al. (2005). 생물 분야에서의 ESEM 응용에 대한 중요한 개요. J. 셀. Physiol. 205, 328–334. doi:10.1002/jcp.20444
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Nallamothu,R.,Wood,G.C.,Pattillo,C.B.,Scott,R.C.,Kiani,M.F.,Moore,B.M.,et al. (2006). Combretastatin A4 를위한 종양 혈관 표적화 된 리포좀 전달 시스템:설계,특성 분석 및 시험 관내 평가. AAPS PharmSciTech7:E32. doi:10.1208/pt070232
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Nirale,N.M.,Vidhate,R.D. 및 Nagarsenker,M.S.(2009). 폐 전달을위한 플루 티카 손 프로 피오 네이트 리포좀. 인도 J.Pharm. Sci. 71, 709–711.
Google 학술검색
Orlova,E.V.,Sherman,M.B.,애기,W.,Mowri,H.,스미스,L.C.,그리고 고토,A.M. 주니어(1999). Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G. 이러한 유형의 치료법은 환자의 상태를 악화시키는 데 도움이 될 수 있습니다. 원자 힘 현미경 및 광자 상관 분광법:리포좀의 신속한 특성 분석을위한 두 가지 기술. Eur. J. 팜. Sci. 25, 81–89. doi:10.1016/j.ejps.2005.01.020
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Ruozi,B.,Tosi,G.,Leo,E. 및 Vandelli,M.A.(2007). 리포좀을 약물 및 유전자 운반체로 특성화하기위한 원자 힘 현미경의 적용. 탈란 타 73,12-22. 도이:10.1016/j.탈란 타.2007.03.031
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Ruozi,B.,Tosi,G.,Tonelli,M.,Bondioli,L.,Mucci,A.,Forni,F.,et al. (2009). 연 수화 샘플의 AFM 위상 이미징:리포좀의 화학적-물리적 연구를 완료하는 다목적 도구. J. 리포좀 Res.19,59-67. doi:10.1080/08982100802584071
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Sawant,R.R. 및 Torchilin,V.P.(2012). 표적화 된 리포좀 치료제 개발의 과제. AAPS J.14,303-315. doi:10.1208/s12248-012-9330-0
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Senior,J.H.(1987). 생체 내 리포좀의 운명과 행동:조절 인자에 대한 검토. 치명타. 목사. 약물 캐리어 Syst. 3, 123–193.
PubMed Abstract|Google Scholar
Sercombe,L.,Veerati,T.,Moheimani,F.,Wu,S.Y.,Sood,A.K. 및 Hua,S.(2015). 리포좀 보조 약물 전달의 진보와 도전. 앞. Pharmacol. 6:286. 도이:10.3389/fphar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Torchilin,V.P.(1994). Immunoliposomes 및 PEGylated immunoliposomes:이미징 에이전트의 표적 전달에 가능한 사용. 면역 측정법 4,244-258. 도이:10.1006/immu.1994.1027
PubMed 추상|CrossRef 전체 텍스트|Google 학술검색
밴 안트베르펜,R.,그리고 Gilkey,J.C.(1994)등이 있습니다. Cryo-electron microscopy 는 인간의 저밀도 지단백질 하부 구조를 보여줍니다. J. 지질 Res.35,2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Willis,M. 및 Forssen,E.(1998). 리간드-표적 리포좀. Adv. 약물 Deliv. 목사 29,249-271. doi:10.1016/S0169-409X(97)00083-5
CrossRef 전체 텍스트|Google Scholar
Zununi Vahed,S.,Salehi,R.,Davaran,S. 및 Sharifi,S.(2017). 암세포에서 리포좀 계 약물 공동 전달 시스템. 이잖아요. Sci. 엥. C 이잖아요. 바이올. 아플. 71, 1327–1341. doi:10.1016/j.msec.2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply