유기 화학 II

실험적으로,그러나,그것은 있다는 것을 관찰은 중요한 장벽을 회전에 대한 C2-C3 채권,그리고 전체 분자가 평면입니다. 또한,C2-C3 채권 148 은 한,보다 짧은 전형적인 탄소-탄소 단일 결합(대 154 동)지만,더 이상 보다 일반적인 이중 채권(에 대해 134pm).
분자 궤도 이론은 delocalized pi 결합의 개념으로 이러한 관찰을 설명합니다. 이 그림에서 4 개의 2p 원자 궤도는 수학적으로 결합하여 증가하는 에너지의 4 개의 pi 분자 궤도를 형성합니다. 이러한 두–접착 pi orbitals–에서 낮은 에너지 보 p 원자 궤도에서 그들이 형성되면서,두–antibonding pi*궤도–에서 더 높은 에너지입니다.

가장 낮은 에너지 분자 궤도,pi1,는 건설적인 상호 작용 및 제 노드입니다. 에서 높은 에너지이지만,여전히 낮보다 절연 p orbitals,the pi2 궤도가 있는 한 노드 하지만 두 개의 건설적인 상호 작용–따라서 그것은 여전히 접합을 전반적으로 궤도. 보고 두 antibonding orbitals,pi3*는 두 개의 노드 중 하나는 건설적인 상호 작용하는 동안,pi4*세 개의 노드로 건설적인 상호 작용합니다.
aufbau 원리에 의해,분리 된 2pz 원자 오비탈로부터 4 개의 전자는 결합 pi1 및 pi2MO’s 에 배치된다. 기 때문에 pi1 포함한 건설적인 사이의 상호 작용 C2,C3,거기에도에서,1,3-부타디엔 분자,파이의 결합 간의 상호 작용 이러한 두 개의 탄소,계정에 대한 짧은 길이의 장벽을 회전입니다. 원자 채권의 사진 1,3-부타디엔 보여 두 개의 파이 채권에서 고립되기는 하나,다른 각각의 쌍 파이 전자는’붙어’에 자신의 파이 채권. 그러나 분자 궤도 이론 예측(정확한)는 네 개의 파이 전자는 어느 정도 delocalized,또는’퍼져’,전체 파이 시스템입니다.

1,3-부타디엔은 공액 pi 결합 시스템의 가장 간단한 예이다. 하는 것으로 간주에 활용,두 개 또는 더 파이 채권해야로 구분하여 단 하나의 단일 결합에 다른 단어가 될 수 없습니다 중간 sp3-교배 및 탄소이기 때문에,이 분 최 겹치는 시스템의 병렬 p orbitals. 아래의 화합물에서,예를 들어,C1-C2 및 C3-C4 이중 결합은 접합되는 반면,C6-C7 이중 결합은 sp3-혼성화 된 C5 에 의해 다른 두 개의 pi 결합으로부터 분리된다.

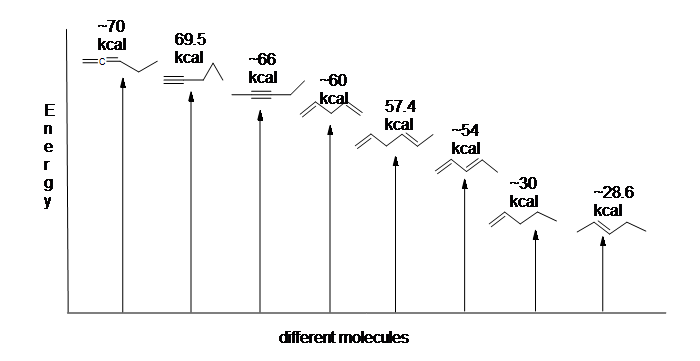
명심해야 할 매우 중요한 개념은 접합과 관련된 고유 한 열역학적 안정성이 있다는 것입니다. 이 안정성은 두 가지 다른 디엔의 수소화 열을 비교하여 실험적으로 측정 할 수 있습니다. (수소첨가는 반응을 입력하는 우리는 것이 훨씬 더 많은 정보에 대해 제 15 장:기본적으로,그것은 프로세스의 추가 수소 분자–두 가지 양자와 두 개의 전자–를 p 채권). 1,3-펜타 디엔의 2 개의 공액 이중 결합이’수소화’되어 펜탄을 생성 할 때,형성된 펜탄의 몰당 약 225kJ 가 방출된다. 1,4-펜타 디엔에서 두 개의 분리 된 이중 결합이 수소화되어 또한 펜탄을 형성 할 때 방출되는 약 250kJ/mol 과 비교한다.
1,3-부타디엔 및 이소프렌과 같은 디엔으로부터의 합성 중합체의 형성은 18.5 절에서 논의된다. 합성 고분자는 더 작은 반복 단위로 구성된 큰 분자입니다. 당신은 아마 약간의 숫자에 익숙한 이러한 중합체;예를 들어,폴 리 에틸렌,폴리프로필렌,폴리스티렌 및 폴리(염화 비닐).

그 13.6:에너지는 다이어그램에 대해 수소첨가의 1,3-부타디엔(not to scale).
으로 수소첨가의 1,3-부타디엔 릴리스보다는 예측은 양의 에너지,에너지의 콘텐츠 1,3-부타디엔보다 낮아야 합니다 우리가 예상됩니다. 다른 말로하면,1,3-부타디엔은 그 공식이 제시하는 것보다 더 안정하다.
공액 디엔은 에너지가 낮다:다시 말해,보다 안정하다. 일반적으로,공액 pi 결합은 분리 된 pi 결합보다 안정하다.
여기에는 에너지 도표의 비교는 다른 종류의 채권들의 열의 수소첨가(당 몰)을 보여 상대적 안정성의 각 분자는(1kcal=4.18kJ). (수소화(파이 결합 당)의 열이 낮을수록 구조가 더 안정하다.)
접합에 의한 디엔의 안정화는 벤젠의 방향족 안정화보다 덜 극적이다. 그럼에도 불구하고,접합에 대한 유사한 공명 및 분자 궤도 설명이 쓰여질 수있다.
의 합성 dienes
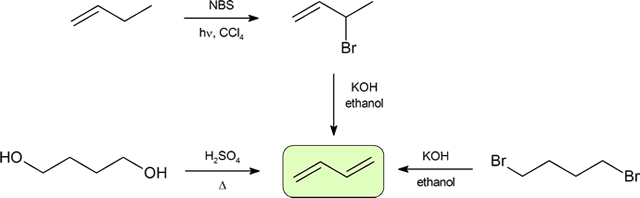
두 개의 가장 빈번한 방법으로 합성 활용 dienes 는 탈수의 알코올과 dehydrohalogenation 의 organohalides 는 소개의 제조에 알켄(섹션 9.9). 다음의 방식은 공액 디엔을 제조하는 경로 중 일부를 도시한다.
Conjugated pi 시스템을 포함할 수 있는 산소 및 질소 원자뿐만 아니라는 탄소입니다. 지방 분자의 신진 대사에서 핵심 반응 중 일부는 카르보닐기에 접합 된 알켄을 포함합니다.

MO 이론은 매우 유용하는 이유를 설명하는 유기 분자를 포함하는 확장된 시스템의 활용 파이 채권종 독특한 색상입니다. 당근의 주황색을 담당하는 화합물 인 베타 카로틴은 11 개의 공액 파이 결합으로 확장 된 시스템을 가지고 있습니다.


운동 2.10:토마토의 붉은 색 화합물 인 리코펜에서 모든 분리되고 접합 된 pi 결합을 식별합니다. 얼마나 많은 pi 전자가 접합 된 pi 시스템에 포함되어 있습니까?나는 이것을 할 수 없다.
Leave a Reply