포스과(PFK)
콘텐츠
- 1
- 2 역할에서 분해
- 3 메커니즘과 규정의 포스과
- 4 조절
- 5 구조적 변화에 Dimeric 단위의 PFK
- 6 개의 중요한 구조적 변화에서 소 단위의 PFK.
- 7Mutagenesis 사이트
- 8 질병
- 9 3D 구조의 PFK
소개
포스과-1(PFK-1)is a glycolytic enzyme that catalyzes the transfer of a phosphoryl group from 을 굴복. 당분 해 효소를 참조하십시오. Mg2+는 또한이 반응에서 중요합니다(). Phosphofructokinase-2(PFK-2)는 ADP 를 산출하기 위하여 동일한 기질에 행동하고. . PFK 반응은 생리 조건 하에서 강하게 exergonic(돌이킬 수없는)이며 따라서 당분 해 경로의 속도 결정 단계 중 하나입니다. 대부분의 생물/조직,PFK 은 당분 경로의 주요 유량 조절하는 효소;그 활동에 의해 통제 농도의 비정상적으로 많은 수의 대사물질 포함 ATP,ADP,AMP,PEP 및 fructose-2,6-bisphosphate.
는 동일한 320-잔기 서브유닛의 사량체이다. 그것은 allosterism 의 대칭 모델을 사용하여 설명되는 allosteric 효소이며,이로써 고 활성 R 상태에서 저 활성 T 상태로의 공동 전환이 있습니다. 효소의 r 및 T 상태 모두의 X 선 구조가보고되었다. Binding 하나의 분자의 기판 F6P 결합 R 효소의 상태와 높은 선호도 하지만을 T 상태 효소와 낮은 선호도,원인 PFK 하는 연구는 상태에서 차례로 증가한 바인딩을 선호도의 효소를 위한 추가적인 F6P(a homotropic 효과). 활성화와 같은 ADP 및 AMP 바인딩 소 allosteric 사이트,바인딩 사이트에서 뚜렷한 활동이트,그들도 마찬가지로의 형성을 촉진하는 R 국가와 따라서 활성화효소(a heterotropic 효과 ADP,되는 제품의 PFK 반응,또한 바인딩에서 효소의 활성이트). 마찬가지로,억제제와 같은 PEP 바인딩 allosteric 사이트(의 경우에 PFK 겹치를 활성화하 allosteric 사이트)는 그들의 형성을 촉진을 T 상태,그로 인하여 억제 효소입니다.
효소의 활성 부위 중 2 개는 마젠타의 활성 부위 계면과 시안의 기질과 함께 계면에 위치한다. 두 개의 더 활동적인 사이트는 서브 유닛 B(녹색)와 C(분홍색)의 인터페이스에 있습니다. 근접 촬영의의 소 단위 D(노란색)를 보여주는 것에서 아미노산은 모두 subunits A(밝은 파란색)및 D(노란색)에 기여하는 바인딩 F6P. 의 두 allosteric 사이트의 인터페이스에 위치하고 두 가지의 인터페이스에 subunits C 및 D 에서 다시 인터페이스가 마젠타 함께 allosteric 리간드에서 시안입니다. 하위 단위 a 의 근접 촬영은 두 하위 단위에서 ADP 의 바인딩에 대한 기여를 보여줍니다. PFK 의 R 상태와 T 상태 사이에가는 구조적 변화는 아래에 나와 있습니다.
원자 좌표 R 국가 PFK 에서 얻을 수 있었 4pfk;그 T 상태 PFK 에서 얻을 수 있었 립 Evans,MRC 실험실 분자생물학,Cambridge,U.K. 지만 지금으로 사용할 수 있 6pfk.
역할에서 분해
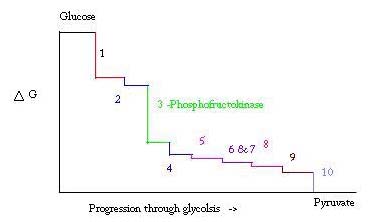
분해가는 과정에 대한 준비 및 파괴,포도당하 pyruvic 산에 사용되는 혐기성 호흡의 하나로 시작하는 반응물에 구연산을 주기입니다. 당분 해의 과정에서 세 가지 점은 큰 음의 자유 에너지로 발생하므로 돌이킬 수 없습니다. 이러한 세 개의 포인트는 헥소,포스과,그리고 pyruvate kinase;이러한 세 가지 PFK 으로 간주 중요한 규제점에 대한 해당 작용에서와 함께 근육 ΔG=-25.9kJ/mol.
Phosphofructokinase 의 메커니즘 및 조절
Phosphofructokinase 는 mg2+-ATP 와 fructose-6-phosphate(F6P)를 결합하여 fructose-1,6-bisphosphate 와 Mg2+-ADP 를 만든다. 이 두 제품을 가진 심상은 결정되지 않았더라도,효소에 결합해 되었습니다. 서브 유닛 당 3 개의 리간드 결합 부위가 있습니다. 두 개는 f6p 와 ATP 를 묶는 활성 부위를 구성하는 반면,세 번째는 알로 스테 릭 결합 부위입니다. 활성 사이트에 관련된 일부 제안 된 잔류 물은 다음과 같습니다. PFK 는 두 가지 일치 상태로 존재하며 둘 다 평형 상태에있다. ATP 는 두 가지 형태 모두에서 활성 및 알로 스테 릭 부위를 결합합니다. 동 ATP 묶 active 사이트는 동일하게,그것이 우선적으로 결합 allosteric 사이트의 T 상태이 특가 바인 원인에서 근무평형의 두국,하의 큰 금액을 T 상태 감소에 대한 선호도 F6P. 또한 바인딩을 allosteric 사이트를 증가율 R 포스과 상태. ADP,AMP 및 F2 와 함께 6P 는 ATP 의 규제 역할을 억제합니다. ATP 에 대한 PFK 의 Km 입니다.020mM 및.032mM.
조절
당분 해는 생존을위한 필수 대사 과정입니다. 따라서,그것의 활성화 및 억제에서 고도로 조절되어야한다. 당분 해의 과정에서 세 가지 점은 큰 음의 자유 에너지로 발생하므로 돌이킬 수 없습니다. 이 세 가지 포인트는 헥소 키나아제,포스 포 프루토 키나아제 및 피루 베이트 키나아제입니다. 이 세 가지 반응은 높은 부정적인 자유 에너지 때문에 규제의 주요 포인트가 될 후보자입니다. 의 세,PFK 으로 간주 중요한 규제점에 대한 분해(3 위에 아래 그림)에서,근육으로 ΔG=-25.9kJ/mol 기 때문에 그것을 투입한 단계입니다. 일단 PFK 가 F6P 를 F1,6P 로 변환하면 뒤로 가기 위해 극복해야하는 높은 양의 에너지 때문에 반응이 쉽게 역전되지 않습니다. . 이 에너지 장벽을 만든 감각으로 보고 pyruvate 니 catalyzes 최종 반응(#10)헥소(#1)이지에 관련된 분해 모든 프로세스가 시작에서 glycogen.
PFK 는 ATP,AMP 및 ADP 에 의해 규제됩니다. 동 ATP 바인딩에서 현재 사이트에서 동일하게 모두 R T 국,그것이 우선적으로 결합 allosteric 사이트의 T 상태이 특가 바인 원인에서 근무평형의 두국,하의 큰 금액을 T 상태 감소에 대한 선호도 F6P. Allosteric 활성 ADP 또한 바인딩 allosteric 사이트를 증가율 R 포스과 상태. 아래 그래프에서 볼 수 있듯이 PFK 의 활동에 대한 플롯은 sigmoidal 입니다. 이것은 효소의 협력 적 특성을 더 보여줍니다. 초기 바인딩 기판의 효소 어렵지만,그것은 바와 힘을 상태 변경에서 T->R,다른 기판에 바인딩을 훨씬 더 쉽게입니다. 그래프는 또한 ATP 를 추가하면 플롯이 오른쪽으로 이동하고(즉,F6P 에 대한 선호도가 감소 함)AMP 를 추가하면 왼쪽으로 이동한다는 것을 보여줍니다.
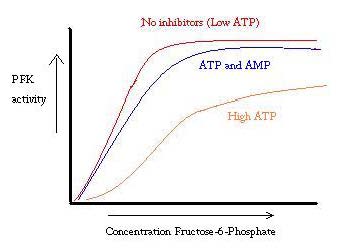
규제 시스템은 PFK 의 기능과 잘 일치합니다. Pfk 가 활성화되면 ATP 는 추가 제품이 더 완전하게 분해됨에 따라 그로부터 스트림 아래로 생산되고 있습니다. 따라서 ATP 수준이 낮고 더 많은 필요가있을 때 ADP 가 고농도로 존재하기 때문에 PFK 의 활성이 증가 할 것입니다. 높은 ATP 농도가 단백질 활동을 억제하기 때문에 반대도 마찬가지입니다. 그럼에도 불구하고,이 설명이 없습니다 완전히 계정의 규정에 대한 PFK 기 때문에,수준의 ATP 에 따른 변화가 크지 않은 사이 충분히 활동하고 쉬고 근육이다. 알로 스테 릭 조절의 또 다른 수단을 찾아야합니다.
ATP 에 대한 PFK 의 Km 입니다.020mM 및.032 미리메터.
이 Kinemage 운동은 두 가지로 구성됩 kinemage 장면을 보여 주는 일부의 allosterically-유도 구조적 변경 내용에서 발생하는 PFK 에서 균 stearothermophilus.
구조적 변화에 Dimeric 단위의 PFK
이 kinemage 보여줍니다 두 가지 하위 단위의 tetramer 의 인터페이스를 포함하는 두 개의 활성은 곳입니다. (KineMage 현재 지원되지 않음),첫 번째 보기 1:PFK dimer,보여줍니다 두 가지 하위 단위에서 자신의 R 국가 형태로 대표되는 그들의 캘리포니아 등뼈와 소 단위에서 1 분홍색 색조와 소 단위 2 에서 핑크입니다. 두 가지 측면에서 체인의 각 소 단위가 표시되어,그들의 글루 161(빨간색)및 Arg162(청록색),일부 의 F6P 바인딩 사이트에서 T 및 R 국,srespectively(아래 참조). F6P(hotpink)와 ADP(녹색;”ADP-active”)는 각 하위 단위의 활성 사이트에 바인딩됩니다. 추가 ADP(노란색;”ADP-allo”)는 각 하위 단위의 별도의 소위 allosteric 사이트에 바인딩됩니다. ADPs 는 각각 연관된 Mg2+를 가지며,여기에 결합하는 ADP 와 동일한 색상의 볼로 표시됩니다.
“ANIMATE”버튼을 클릭하여 r 상태와 T 상태 사이의 이량 체를 전환하십시오. T 상태에서 서브 유닛 1 은 bluetint 이고 서브 유닛 2 는 skyblue 입니다. 측면 체인의 글루 161Arg162 에서 모두 subunits 은 빨간색과 청록색으로 전(만 캘리포니아 및 Cb 의 원자 Arg162 드 체인에서 소 단위 1 는 관찰에서 X-ray 구조의 상태;그들의 소 단위 2 는 모든 관찰). T 상태 효소는 억제제 2-포스 포 글리콜 레이트(금;”PGC”),당분 해 중간체 포스 포에 놀 피루 베이트(PEP)의 비 생리 학적 유사체를 결합시킨다. T 상태에서 PGC 의 결합 부위는 R 상태(“ADP-allo”)에서 ADP 의 알로 스테 릭 결합 부위와 겹치므로 이들의 결합은 상호 배타적이라는 점에 유의하십시오. T 가 활성 상태 사이트는 포함하지 않 F6P 으로 표시됩니”유령”F6Ps(회색;”F6P 사이트”),동일한 위치로 수행 F6Ps R 국가 효소입니다.
두 번째 보 2:Allo/Act 사이트는 근접의 상부의 첫 번째 보기 모두 보여주는 활동이트 및 allosteric 사이트 이 지역에서. 참고하는 활동에 위치한 이 인터페이스 사이의 두 subunits allosteric 사이트를 직접 상호 작용으로 현재 사이트에 인접한 소 단위. 한 번에 두 가지를 모두 표시하거나”ANIMATE”를 클릭하여 R 상태 및 T 상태 일치를 비교하십시오. R 상태에서 효소에 결합 된 각 ADPs 와 관련된 Mg2+이온을 확인할 수 있습니까? 어떤 ADP 원자가이 Mg2+이온을 조정합니까?
인산의 그룹 PGC 묶 allosteric 사이트에서 T 상태에 매우 거의 같은 위치에 있는 베타 인산의 그룹”ADP-allo”묶 R 국가 allosteric 사이트;두 그룹 인산염 바인딩을 측면 체인의 같은 세 가지 잔류물(2arg1Lys;하지 않음).
에서 활동하는 R,상태를 긍정적으로 부드 체인의 Arg162 형태의 수소 결합 소금은 다리의 부정적인 요금이 부과 6-인산의 그룹 F6P(흰 점선),상호 작용하는 아마도를 안정화시킨 R 인 상태 T 상태에 따라서 부분에 대한 책임 F6P 의 homotropic 효과가 있다.
PFK 의 하위 단위에서 주요 구조적 변화.
이 키네 마지는 알로 스테 릭 부위 근처의 해당 세그먼트를 보여줍니다(잔기 53-60 은 여기에 표시되지 않음). 로 KINEMAGE1,폴리펩타이드에 표시된 캘리포니아와 체인 R 상태의 하위 단위 1 과 2 에 redtint 핑크,T 상태의 하위 단위 1 과 2 에 bluetint 및 skyblue. (KineMage 현재 지원되지 않음)KINEMAGE2 에서 보기 1:Allosteric 사이트에 R 상태를 보여주는 인산의 그룹 F6P(hotpink)바인딩에서 효소의 활성이트에서 수소 결합 솔트 브리지(선 흰색인)가이드 체인의 Arg162(청록색). ADP(노란색;”ADP-allo”)는 인접한 알로 스테 릭 부위를 차지합니다. “ANIMATE”를 한 번 클릭하여 T 상태로 전환하십시오. 이것은 r 상태 알로 스테 릭 부위의 ADP 를 억제제 및 PEP 아날로그 PGC(금)로 대체합니다. F6P 더 이상을 차지 활성이 그것의 위치에 상태가 표시된”유령”F6P(회색;를 클릭하여 볼”F6P 사이트”).
r 대 T 전이에서 중심 폴리펩티드 헬리컬 세그먼트(잔기 149-164)는 어떻게됩니까? 이것은 음으로 하전 된 Glu161 과 양으로 하전 된 Arg162 의 상대적인 위치에 무엇을합니까? “F6P 사이트”를 클릭하십시오. Arg162 의 양전하의 부재는 F6P 의 결합에 어떤 영향을 미칠까요? 이것은 T 상태 PFK 가 F6P 에 대한 선호도가 낮은 이유를 적어도 부분적으로 설명합니까? 보기 2 로 이동:근접 촬영,F6P-사이드 체인 상호 작용의 근접 촬영. “도구”메뉴에서”pickcenter”를 선택하고 athe atom 을 클릭하여 분자를 가운데에 놓습니다. “확대/축소”슬라이더를 슬라이드하여보기를 확대하십시오.
사이트 Mutagenesis
한 번에 부정적인 요금의 글루 161 었다고 생각에 대한 부정적인 영향을 미칠 F6P 바인딩을 T 상태입니다. 이 아이디어는 현장 지시 돌연변이 유발 실험에 의해 뒷받침되지 않았다. R162a,E161A 및 R162A/E161A 를 포함한 여러 돌연변이 Pfk 가 만들어졌다.R162a 돌연변이는 F6P 결합에서 30 배 감소를 일으켰다. 그러나 E161A 돌연변이는 PEP 가 F6P 결합을 억제하는 능력에 거의 영향을 미치지 않았다.
질병
상속 적혈구 PFK 결핍증 관련된 근육병 및 혈(Tarui 질환).
PFK 의 3D 구조
Phosphofructokinase3D 구조
Leave a Reply