7.2: chimotripsina
Introducere
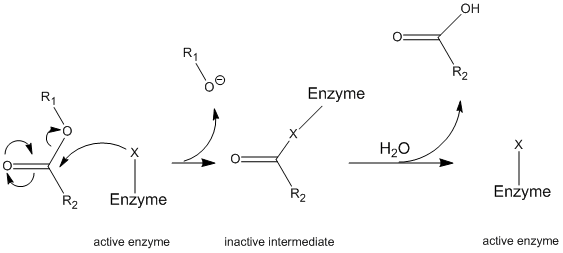
chimotripsina este una dintre cele mai studiate enzime datorită cineticii sale în două faze: starea de echilibru și starea de echilibru. Studiul acestor două stări cinetice oferă dovezi ale mecanismului „Ping-Pong”, formarea complexelor covalente care conduc la reacții de hidroliză covalentă și rata reacțiilor catalizate. Sinteza chimotripsinei are loc în principal în pancreas. În loc de forma activă, totuși, este produs ca un zymogen inactiv numit chimotripsinogen pentru a împiedica activitatea proteazei să digere pancreasul. După secreția în lumenul intestinului subțire, acesta este transformat în forma sa activă de o altă enzimă numită tripsină. Această dependență a unei enzime diferite pentru activarea unei proteaze este o modalitate comună pentru organism de a preveni digestia organelor și a altor efecte secundare enzimatice dăunătoare.chimotripsina funcționează printr-un mecanism general cunoscut sub numele de mecanism de ping-pong (figura \(\PageIndex{1}\)) prin care enzima reacționează cu un substrat pentru a forma o enzimă intermediară. Acest intermediar are proprietăți diferite de enzima inițială, astfel încât pentru a regenera activitatea enzimatică inițială, trebuie să reacționeze cu un substrat secundar. Acest proces este ilustrat mai jos:

mai precis, chimotripsina funcționează printr-un anumit tip de mecanism de ping-pong numit hidroliză covalentă. Aceasta înseamnă că enzima formează mai întâi o legătură covalentă cu substratul țintă, deplasând partea mai stabilă în soluție. Acest complex enzimă-substrat se numește enzimă intermediară. Intermediarul reacționează apoi cu apa, care deplasează partea rămasă a substratului inițial și reformează enzima inițială.
chimotripsina, la fel ca majoritatea enzimelor, este specifică tipurilor de substraturi cu care reacționează. Ca protează, scindează polipeptidele, iar specificitatea sa inerentă îi permite să acționeze numai asupra carboxi-terminalului reziduurilor aromatice. Este un mecanism oarecum complicat și este cel mai bine explicat într-o serie de pași.
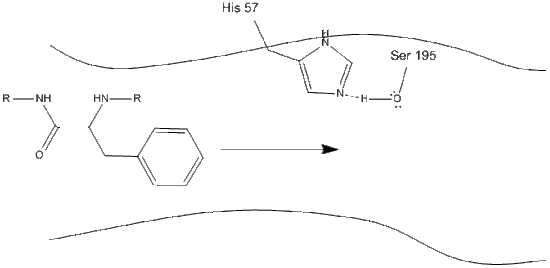
1. Ținta intră în locul activ al chimotripsinei și este ținută acolo prin interacțiuni hidrofobe între grupurile nepolare expuse de reziduuri enzimatice și lanțul lateral aromatic nepolar al substratului. Este important de remarcat legătura de hidrogen dintre azotul Schiff pe histidină-57 și lanțul lateral de oxigen al serinei-195.
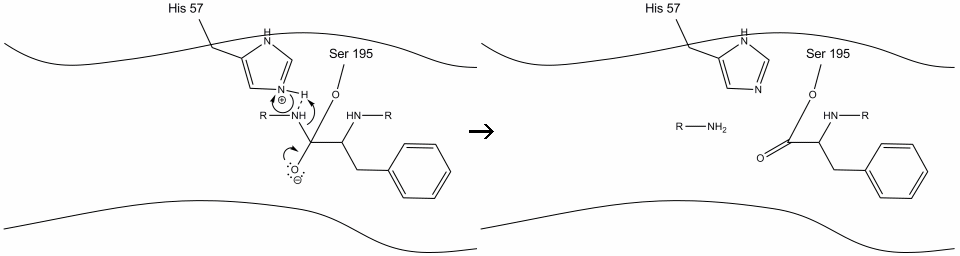
2. Ajutat de legarea hidrogenului histidină-serină, gruparea hidroxil pe serină-195 efectuează un atac nucleofil asupra carbonului carbonil al unui aminoacid aromatic în timp ce transferă simultan hidrogenul hidroxil în azotul histidină Schiff. Acest atac împinge electronii carbonilici pi pe oxigenul carbonil, formând un intermediar de scurtă durată format dintr-un carbon C-terminal cu patru legături simple: un anion de oxigen, beta-carbonul aminoacidului aromatic, capătul N al aminoacidului ulterior al proteinei substratului și oxigenul lanțului lateral serină-195.
.gif?revision=1&size=bestfit&width=720&height=192)
3. Acest intermediar este de scurtă durată, deoarece electronii oxianioni reformează legătura pi cu capătul C al aminoacidului aromatic. Legătura dintre carboxi-terminalul aminoacidului aromatic și n-terminalul reziduului ulterior este scindată, iar electronii săi sunt utilizați pentru a extrage hidrogenul azotului Schiff protonat pe histidină-57. Legăturile dintre carbonul carbonil și oxigenul serină-195 rămân într-o configurație esterică. Aceasta se numește intermediar acil-enzimă. Partea C-terminală a polipeptidei este acum liberă să se disocieze de locul activ al enzimei.
4. Moleculele de apă sunt acum capabile să intre și să se lege de situsul activ prin legarea hidrogenului între atomii de hidrogen ai apei și azotul histidină-57 Schiff.
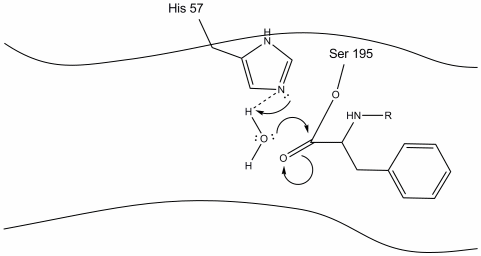
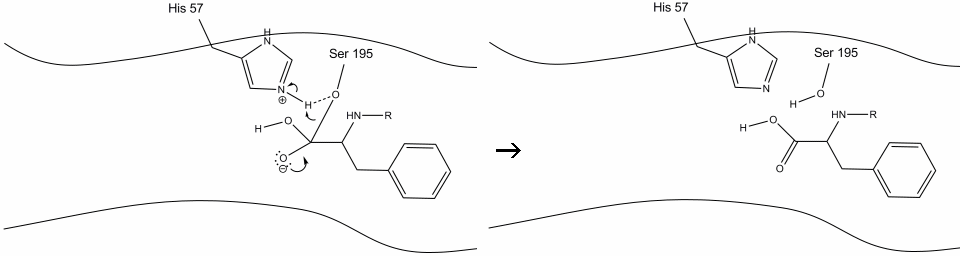
5. Oxigenul din apă face acum un atac nucleofil asupra carbonului carbonil al intermediarului acil-enzimă, împingând electronii pi ai carbonilului pe carbonul carbonil, pe măsură ce histidina-57 extrage un proton din apă. Aceasta formează un alt carbon cuaternar legat covalent cu serină, un hidroxil, un oxianion și aminoacidul aromatic. Protonul de pe histidina-57 recent protonată este acum capabil să facă o legătură de hidrogen cu oxigenul serinic.
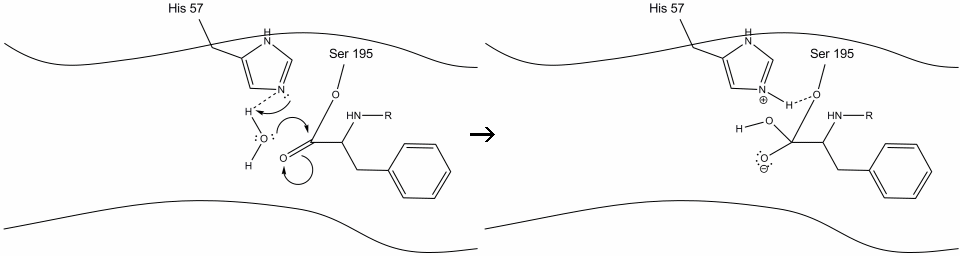
6. Electronii oxianioni reformează legătura carbonil pi, scindând legătura dintre carbonul carbonil și Serina hidroxil. Electronii din această legătură sunt utilizați de oxigenul serinic pentru a deprotona azotul histidină Schiff și pentru a reforma enzima originală. Substratul nu mai are afinitate pentru situl activ și în curând se disociază de complex.
Leave a Reply