Chimie organică II

experimental, cu toate acestea, se observă că există o barieră semnificativă în rotație în jurul legăturii C2-C3 și că întreaga moleculă este plană. În plus, legătura C2-C3 are o lungime de 148 pm, mai scurtă decât o legătură unică carbon-carbon tipică (aproximativ 154 pm), deși mai lungă decât o legătură dublă tipică (aproximativ 134 pm).teoria orbitală moleculară explică aceste observații cu conceptul de legături pi delocalizate. În această imagine, cei patru orbitali atomici 2p se combină matematic pentru a forma patru orbitali moleculari pi de energie în creștere. Două dintre acestea-orbitalii pi legați – sunt mai mici în energie decât orbitalii atomici p din care sunt formați, în timp ce doi – orbitalii pi* antibonding-sunt mai mari în energie.

orbitalul molecular cu cea mai mică energie, pi1, are doar interacțiune constructivă și noduri zero. Mai mare în energie, dar încă mai mică decât orbitalii p izolați, orbitalul pi2 are un nod, dar două interacțiuni constructive – deci este încă un orbital de legătură în general. Privind la cei doi orbitali antibonding, pi3 * are două noduri și o interacțiune constructivă, în timp ce pi4* are trei noduri și zero interacțiuni constructive. conform principiului aufbau, cei patru electroni din orbitalii atomici 2PZ izolați sunt plasați în legăturile pi1 și pi2 MO. Deoarece pi1 include interacțiunea constructivă între C2 și C3, există un grad, în molecula 1,3-butadienă, de interacțiune de legătură pi între acești doi atomi de carbon, ceea ce explică lungimea sa mai scurtă și bariera de rotație. Imaginea legăturii de valență a 1,3-butadienei arată cele două legături pi ca fiind izolate una de cealaltă, cu fiecare pereche de electroni pi ‘blocați’ în propria legătură pi. Cu toate acestea, teoria orbitală moleculară prezice (cu exactitate) că cei patru electroni pi sunt într-o oarecare măsură delocalizați sau ‘răspândiți’ pe întregul sistem pi.

1,3-butadiena este cel mai simplu exemplu de sistem de legături pi conjugate. Pentru a fi considerate conjugate, două sau mai multe legături pi trebuie separate printr – o singură legătură-cu alte cuvinte, nu poate exista un carbon hibridizat SP3, deoarece acest lucru ar rupe sistemul suprapus al orbitalilor p paraleli. În compusul de mai jos, de exemplu, legăturile duble C1-C2 și C3-C4 sunt conjugate, în timp ce legătura dublă C6-C7 este izolată de celelalte două legături pi prin SP3-hibridizat C5.

un concept foarte important de reținut este că există o stabilitate termodinamică inerentă asociată cu conjugarea. Această stabilitate poate fi măsurată experimental prin compararea căldurii de hidrogenare a două diene diferite. (Hidrogenarea este un tip de reacție despre care vom afla mult mai multe în capitolul 15: în esență, este procesul de adăugare a unei molecule de hidrogen – doi protoni și doi electroni – la o legătură p). Când cele două legături duble conjugate de 1,3-pentadienă sunt hidrogenate pentru a produce pentan, se eliberează aproximativ 225 kJ pe mol de pentan format. Comparați asta cu cei aproximativ 250 kJ/mol eliberați atunci când cele două legături duble izolate din 1,4-pentadienă sunt hidrogenate, formând și pentan.
formarea polimerilor sintetici din diene precum 1,3-butadienă și izopren este discutată în secțiunea 18.5. Polimerii sintetici sunt molecule mari formate din unități repetate mai mici. Probabil că sunteți oarecum familiarizați cu un număr de acești polimeri; de exemplu, polietilenă, polipropilenă, polistiren și poli(clorură de vinil).

figura 13.6: diagrama Energetică pentru hidrogenarea 1,3-butadienei (nu la scară).
deoarece hidrogenarea 1,3-butadienei eliberează mai puțin decât cantitatea de energie prevăzută, conținutul energetic al 1,3-butadienei trebuie să fie mai mic decât ne-am fi putut aștepta. Cu alte cuvinte, 1,3-butadiena este mai stabilă decât sugerează formula sa.
diena conjugată este mai mică în energie: cu alte cuvinte, este mai stabilă. În general, legăturile pi conjugate sunt mai stabile decât legăturile pi izolate.
iată o diagramă energetică care compară diferite tipuri de legături cu căldurile lor de hidrogenare (pe mol) pentru a arăta stabilitatea relativă a fiecărei molecule (1 kcal = 4,18 kJ). (Cu cât este mai mică căldura de hidrogenare (per legătură pi), cu atât structura este mai stabilă.)
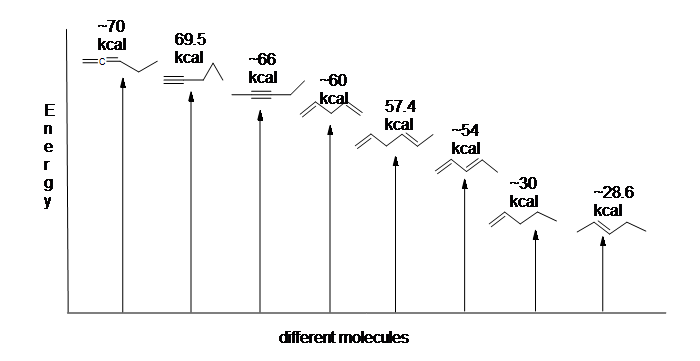
stabilizarea dienelor prin conjugare este mai puțin dramatică decât stabilizarea aromatică a benzenului. Cu toate acestea, pot fi scrise descrieri similare de rezonanță și orbitale moleculare ale conjugării.
sinteza dienelor
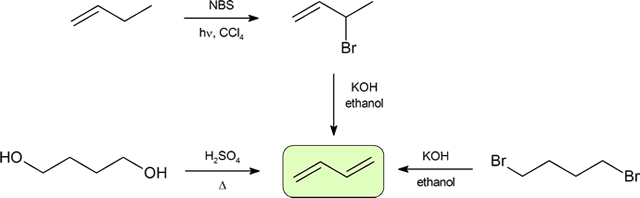
cele două moduri cele mai frecvente de a sintetiza dienele conjugate sunt deshidratarea alcoolilor și dehidrohalogenarea organohalidelor, care au fost introduse în prepararea alchenelor (secțiunea 9.9). Următoarea schemă ilustrează unele dintre căile de preparare a unei diene conjugate.
sistemele pi conjugate pot implica atomi de oxigen și azot, precum și carbon. În metabolismul moleculelor de grăsime, unele dintre reacțiile cheie implică alchene care sunt conjugate cu grupări carbonil.

teoria MO este foarte utilă în explicarea motivului pentru care moleculele organice care conțin sisteme extinse de legături pi conjugate au adesea culori distincte. beta-carotenul, compusul responsabil pentru culoarea portocalie a morcovilor, are un sistem extins de 11 legături pi conjugate.

exerciții
exercițiul 2.9: Identificați toate legăturile duble conjugate și izolate în structurile de mai jos. Pentru fiecare sistem pi conjugat, specificați numărul de orbitali P care se suprapun și câți electroni pi sunt împărțiți între ei.

exercițiul 2.10: identificați toate legăturile pi izolate și conjugate din licopen, compusul de culoare roșie din roșii. Câți electroni pi sunt conținuți în sistemul pi conjugat?
Leave a Reply