Fosfofructokinaza (PFK)
cuprins
- 1 Introducere
- 2 rol în glicoliza
- 3 mecanismul și reglarea Fosfofructokinazei
- 4 regulament
- 5 modificări conformaționale într-o unitate dimerică de PFK
- 6 modificările conformaționale majore într-o unitate subunitatea PFK.
- 7 mutageneză direcționată pe situs
- 8 boală
- 9 structuri 3D ale PFK
Introducere
Fosfofructokinaza-1 (PFK-1) este o enzimă glicolitică care catalizează transferul unei grupări fosforil de la la la randament și . Vezi Enzimele Glicolizei. Mg2 + este, de asemenea, important în această reacție (). Fosfofructokinaza – 2 (PFK-2) acționează pe aceleași substraturi pentru a produce ADP și . . Reacția PFK este puternic exergonică (ireversibilă) în condiții fiziologice și, prin urmare, este una dintre etapele de determinare a ratei căii glicolitice. În majoritatea organismelor/țesuturilor, PFK este principala enzimă de reglare a fluxului pe calea glicolitică; activitatea sa este controlată de concentrațiile unui număr neobișnuit de mare de metaboliți, inclusiv ATP, ADP, AMP, PEP și fructoză-2,6-bifosfat.
este un tetramer de subunități identice de 320 de reziduuri. Este o enzimă alosterică care este descrisă folosind modelul de simetrie al alosterismului prin care există o tranziție concertată de la starea R cu activitate ridicată la starea T cu activitate scăzută. Au fost raportate structurile cu raze X ale stărilor R și T ale enzimei. Legarea unei molecule a substratului său F6P, care se leagă de enzima de stare R cu afinitate ridicată, dar de enzima de stare T cu afinitate scăzută, determină PFK să preia starea R, ceea ce, la rândul său, crește afinitatea de legare a enzimei pentru F6P suplimentar (un efect homotropic). Activatorii, cum ar fi ADP și AMP se leagă de așa-numitele situri alosterice, situri de legare distincte de situsul activ, unde facilitează, de asemenea, formarea stării R și, prin urmare, activează enzima (un efect heterotrop; ADP, fiind un produs al reacției PFK, se leagă și la situsul activ al enzimei). În mod similar, inhibitori precum PEP se leagă de situsurile alosterice (care în cazul PFK se suprapune sitului alosteric activator) unde promovează formarea stării T, inhibând astfel enzima.
două dintre situsurile active ale enzimei sunt localizate la interfața cu interfețele situsului activ din magenta cu substraturile din cyan. Alte două site-uri active se află la interfața subunităților B (verde) și C (roz). Un prim plan al subunității D (galben) arată că aminoacizii din ambele subunități a (Albastru deschis) și D (Galben) contribuie la legarea F6P. două dintre siturile alosterice sunt situate la interfața și două la interfața subunităților C și D. din nou interfețele sunt magenta cu ligandul alosteric în cyan. Un prim plan al subunității A arată contribuțiile ambelor subunități la legarea ADP. Modificările conformaționale în trecerea între stările R și T ale PFK sunt ilustrate mai jos.coordonatele atomice pentru PFK de Stat R au fost obținute de la 4pfk; cele pentru PFK de stat T au fost obținute de la Philip Evans, Laboratorul MRC de Biologie Moleculară, Cambridge, Marea Britanie, dar sunt acum disponibile ca 6pfk.
rol în glicoliză
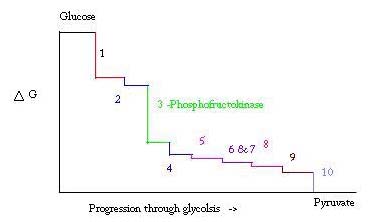
glicoliza este procesul de preparare și descompunere a glucozei pentru a produce acid piruvic, care este utilizat în respirația anaerobă sau ca unul dintre reactanții de pornire din ciclul acidului citric. Trei puncte în procesul de glicoliză apar cu o mare energie liberă negativă și, prin urmare, sunt ireversibile. Aceste trei puncte sunt hexokinaza, fosfofructokinaza și piruvat kinaza; dintre aceste trei PFK este considerat principalul punct de reglementare pentru glicoliza în mușchi cu un HECTOLIX= -25,9 kJ/mol.
mecanismul și reglarea Fosfofructokinazei
Fosfofructokinaza leagă atât MG2+-ATP, cât și fructoză-6-fosfat (F6P) pentru a produce fructoză-1,6-bifosfat și Mg2+-ADP. Deși imaginea cu ambele aceste produse nu a fost determinată, legat de enzima a fost. Există trei site-uri de legare a ligandului pe subunitate. Două alcătuiesc situsul activ, care leagă F6P și ATP, în timp ce al treilea este un situs de legare alosterică. Unele reziduuri propuse implicate la locul activ includ . PFK există în două stări conformaționale, ambele și care sunt în echilibru. ATP leagă atât situsurile active, cât și cele alosterice în ambele conformații. În timp ce ATP leagă situsul activ la fel de bine, se leagă preferențial situsul alosteric al stării T această legare preferențială determină o trecere de la echilibrul celor două stări, la o cantitate mai mare de stare T , ceea ce scade afinitatea pentru F6P. de asemenea, se leagă de situsul alosteric pentru a crește raportul fosfofructokinazei de stare R. Împreună cu ADP, AMP și F2, 6P inhibă rolul de reglementare al ATP. Km PFK pentru ATP este .020mM și .032mm.
Regulamentul
glicoliza este un proces metabolic esențial pentru supraviețuire. Prin urmare, în activarea și suprimarea sa trebuie să fie foarte reglementată. Trei puncte în procesul de glicoliză apar cu o mare energie liberă negativă și, prin urmare, sunt ireversibile. Aceste trei puncte sunt hexokinaza, fosfofructokinaza și piruvat kinaza. Aceste trei reacții sunt candidați pentru a fi punctele majore de reglementare din cauza energiilor lor libere negative ridicate. Dintre cele trei, PFK este considerat principalul punct de reglementare pentru glicoliză (#3 în imaginea de mai jos) în mușchi, cu un HECTOLIX= -25,9 kJ/mol, deoarece este un pas angajat. Odată ce PFK convertește F6P în F1, 6p, reacția nu va fi ușor inversată din cauza cantității mari de energie care trebuie depășită pentru a merge înapoi. . Această barieră energetică are sens, deoarece piruvat kinaza catalizează reacția finală (#10) și hexokinaza (#1) nu este deloc implicată în glicoliză atunci când procesul este început din glicogen.
PFK este reglementat de ATP, AMP și ADP. În timp ce ATP se leagă la situsul activ la fel de bine atât în stările R, cât și în cele T, se leagă preferențial situsul alosteric al stării T , această legare preferențială determină o schimbare de la echilibrul celor două stări, la o cantitate mai mare de stare T, ceea ce scade afinitatea pentru F6P. activatorul alosteric ADP se leagă, de asemenea, de situsul alosteric pentru a crește raportul fosfofructokinazei de stare R. După cum se poate observa din graficul de mai jos, parcelele pentru activitatea PFK sunt sigmoidale. Acest lucru demonstrează în continuare natura cooperativă a enzimei. Legarea inițială a substratului la enzimă este dificilă, dar odată ce este legată și forțează schimbarea stării de la T -> R, celelalte substraturi se leagă mult mai ușor. Graficul arată, de asemenea, că adăugarea ATP mută complotul la dreapta (adică scade afinitatea pentru F6P), în timp ce adăugarea AMP îl mută spre stânga.
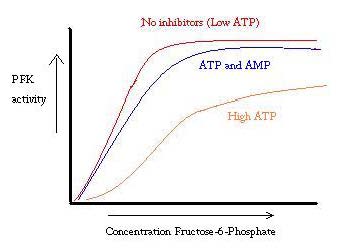
sistemul de reglare se potrivește bine cu funcția PFK. Atunci când PFK este activ, ATP este produs în jos fluxul de la ea ca alte produse sunt defalcate mai complet. Astfel, atunci când nivelurile ATP sunt scăzute și trebuie făcute mai multe, activitatea PFK va fi crescută, deoarece ADP va fi în concentrație ridicată. Opusul este valabil, de asemenea, deoarece concentrația mare de ATP inhibă activitatea proteinelor. Și totuși, această explicație nu poate explica complet reglarea PFK, deoarece nivelurile de ATP nu variază suficient de mult între mușchii activi și cei în repaus. Trebuie găsit un alt mijloc de reglare alosterică.
km PFK pentru ATP este .020mM și .032mM.
acest exercițiu Kinemage constă din două scene kinemage care ilustrează unele dintre modificările conformaționale induse de alosteric care apar în PFK de la Bacillus stearothermophilus.
modificări conformaționale într-o unitate dimerică a PFK
acest kinemage arată cele două subunități ale tetramerului a căror interfață conține două site-uri active. (KineMage nu este acceptat în prezent) prima vizualizare, 1: dimerul PFK, arată cele două subunități în conformația lor de stare R, reprezentată de coloanele vertebrale Ca cu subunitatea 1 în nuanță roz și subunitatea 2 în roz. Sunt prezentate două lanțuri laterale din fiecare subunitate, cele ale Glu 161 (roșu) și ARG 162 (cyan), care fac parte din site-ul de legare F6P în stările T și R, srespectiv(vezi mai jos). Un F6P (hotpink) și un ADP (verde; „ADP-activ”) sunt legate în site-ul activ al fiecărei subunități. Un ADP suplimentar (galben; „ADP-allo”) este legat într-un așa-numit sit alosteric separat al fiecărei subunități. ADP-urile au fiecare un Mg2+ asociat, care este reprezentat aici de o bilă de aceeași culoare ca ADP-ul de care se leagă.
Faceți clic pe butonul „animați” pentru a comuta dimerul între stările sale R și T. În starea sa T, subunitatea 1 este bluetint și subunitatea 2 este skyblue. Lanțurile laterale ale Glu 161 și ARG 162 în ambele subunități sunt roșii și cyan ca înainte (numai atomii de Ca și Cb ai lanțului lateral Arg 162 în subunitatea 1 sunt observate în structura cu raze X a stării T; cele ale subunității 2 sunt toate observate). Enzima de stare T leagă inhibitorul 2-fosfoglicolat (aur; „PGC”), un analog nefiziologic al fosfoenolpiruvatului intermediar glicolitic (PEP). Rețineți că situl de legare al PGC în starea T se suprapune sitului de legare alosteric al ADP în starea R („ADP-allo”) și, prin urmare, legarea lor se exclude reciproc. Siturile active de stare T, care nu conțin F6P, sunt marcate cu „fantomă” F6Ps (gri;”site-ul F6P”), care au aceleași poziții ca și F6Ps în enzima de stare R.
a doua Vizualizare, 2: site-uri Allo / Act, este un prim plan al porțiunii superioare a primei vizualizări care arată atât site-ul activ, cât și site-ul alosteric din această regiune. Rețineți că site-ul activ este situat la interfața dintre două subunități și că site-ul alosteric interacționează direct cu site-ul activ din subunitatea adiacentă. Comparați conformațiile stării R și stării T afișând ambele simultan sau făcând clic pe „ANIMATE”. Puteți identifica ionul Mg2 + asociat cu fiecare dintre ADP-urile legate de enzimă în starea R? Ce atomi ADP coordonează acești ioni Mg2+?
grupul fosfat al PGC se leagă de situsul alosteric în starea T în foarte aproape aceeași poziție pe care grupul beta fosfat al „ADP-allo” se leagă de situsul alosteric al stării R; ambele grupări fosfat se leagă de lanțurile laterale ale acelorași trei reziduuri (2 arg și 1 Lys; nu este prezentat).
În starea R cu activitate ridicată, lanțul lateral încărcat pozitiv al Arg 162 formează o punte de sare legată de hidrogen cu grupa 6-fosfat încărcată negativ a F6P (linii punctate albe), o interacțiune care probabil stabilizează starea R în raport cu starea T și, prin urmare, este parțial responsabilă pentru efectul homotrop al F6P.
modificările conformaționale majore într-o subunitate a PFK.
acest KINEMAGE arată acele segmente în apropierea sitului alosteric (reziduurile 53-60 nu sunt afișate aici). Ca și în KINEMAGE 1, polipeptida este reprezentată de lanțul său Ca cu subunitățile de stare R 1 și 2 în roșu și roz și subunitățile de stare T 1 și 2 în bluetint și skyblue. (KineMage nu este acceptat în prezent)KINEMAGE 2 apare în vizualizarea 1: situsul alosteric, în starea R arătând grupul fosfat de F6P (hotpink) legat în situsul activ al enzimei într-o punte de sare legată de hidrogen (linii albe întrerupte) cu lanțul lateral al Arg 162 (cyan). Un ADP (galben; „ADP-allo”) ocupă situl alosteric adiacent. Faceți clic o dată pe” ANIMATE ” pentru a comuta la starea T. Aceasta înlocuiește ADP în situsul alosteric al statului R cu inhibitorul și analogul Pep PGC (aur). F6P nu mai ocupă site-ul activ, dar poziția sa în starea R este indicată de „fantoma” F6P (gri; vizualizat făcând clic pe „site-ul F6P”).
Ce se întâmplă cu segmentul elicoidal polipeptidic central (reziduurile 149-164) în tranziția R la T? Ce face acest lucru cu pozițiile relative ale Glu 161 încărcat negativ și ARG 162 încărcat pozitiv? Faceți clic pe”site-ul F6P”. Ce influență ar avea absența sarcinii pozitive a Arg 162 asupra legării F6P? Explică acest lucru, cel puțin parțial, de ce T State PFK are o afinitate scăzută pentru F6P? Accesați View 2: Closeup, pentru un closeup al interacțiunilor F6P-sidechain. Centrați moleculele alegând „pickcenter” din meniul „Instrumente” și făcând clic pe atomul pe care doriți să îl aflați în centru. Glisați glisorul” zoom ” pentru a mări vizualizarea.
mutageneză direcționată pe Site
la un moment dat, sarcina negativă a Glu 161 a fost considerată a avea un efect negativ asupra legării F6P în starea T. Această idee nu a fost susținută de experimente de mutageneză direcționate pe site. Au fost făcute mai multe PFK-uri mutante, inclusiv R162A, e161a și R162A/E161A. mutația R162A a provocat o scădere de 30 de ori a legării F6P. Cu toate acestea, mutația E161A a avut un efect redus asupra capacității PEP de a inhiba legarea F6P.
boala
eritrocite moștenite deficitul PFK este asociat cu miopatie și hemoliză (boala Tarui).
structuri 3D ale PFK
structuri 3D Fosfofructokinază
Leave a Reply