frontiere în farmacologie
Introducere
lipozomii sunt un tip de nanocarrier care au fost investigate pe scară largă în scopuri de administrare a medicamentelor. Acestea sunt compuse din bistraturi fosfolipidice care cuprind un spațiu apos distinct, permițând astfel încapsularea atât a compușilor hidrofili, cât și a celor hidrofobi (Metselaar și Storm, 2005). Lipozomii sunt capabili să stabilizeze compușii terapeutici și să depășească barierele în calea absorbției celulare și a țesuturilor (Ding și colab., 2006; Hua și Wu, 2013). Acest lucru le permite să îmbunătățească direcționarea compușilor către locurile bolii și, prin urmare, să reducă acumularea în organele nețintă (Bakker-Woudenberg și colab., 1994; Mastrobattista și colab., 1999; Hua, 2013; Hua și colab., 2015; Sercombe și colab., 2015; Zununi Vahed și colab., 2017). Există patru tipuri principale de lipozomi pe baza caracteristicilor lor de suprafață-lipozomi convenționali, lipozomi pegilați, lipozomi vizați de ligand și lipozomi teranostici (Figura 1; Sercombe și colab., 2015). Lipozomii vizați de Ligand oferă potențialul de livrare specifică a medicamentelor către anumite țesuturi sau organe care exprimă selectiv ligandul vizat (Willis și Forssen, 1998; Bendas, 2001; Sawant și Torchilin, 2012), în timp ce lipozomii pegilați conferă obstacole sterice pentru a spori timpul de înjumătățire al circulației sistemului de livrare după administrarea sistemică (Torchilin, 1994; Wang și colab., 2015). Lipozomii care încorporează o combinație a diferitelor platforme de livrare pot îmbunătăți și mai mult livrarea compușilor încapsulați, în funcție de calea de administrare și locul bolii.
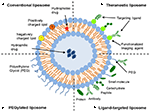
figura 1. Reprezentarea schematică a diferitelor tipuri de sisteme lipozomale de administrare a medicamentelor – (a) lipozom convențional, (b) lipozom pegilat, (C) lipozom orientat spre Ligand și (D) lipozom Teranostic (Sercombe și colab., 2015).
în urma procesului de fabricație, lipozomii sunt caracterizați pentru a asigura omogenitatea într-un număr de parametri, inclusiv încapsularea medicamentului, conjugarea ligandului, compoziția lipidelor, încărcarea suprafeței și proprietățile morfologice (de exemplu, dimensiunea, forma și numărul lamelelor) (Kuntsche și colab., 2011). Aceste caracteristici sunt importante deoarece pot avea un impact major asupra comportamentului lipozomilor atât in vitro, cât și in vivo (Sawant și Torchilin, 2012; Sercombe și colab., 2015). Recunoașterea și eliminarea lipozomilor de către apărarea organismului, inclusiv sistemul reticuloendotelial (RES) și adsorbția opsoninelor cu absorbția ulterioară de către sistemul fagocitar mononuclear, contribuie major la eliminarea și degradarea lipozomilor (Senior, 1987; Cullis și colab., 1998; Ishida și colab., 2001). Prin urmare, posibilitatea de a determina proprietățile fizico-chimice ale lipozomilor fabricați este importantă pentru a optimiza o formulare pentru o evaluare translațională ulterioară.un aspect major în evaluarea fizico-chimică a lipozomilor este vizualizarea morfologiei nanoparticulelor prin microscopie. Există o serie de tehnici disponibile pentru imagistica lipozomilor și a altor nanoparticule care pot fi clasificate în general în microscopie cu lumină, electroni sau forță atomică (Bibi și colab., 2011). Fiecare tehnică are propriile avantaje și limitări, care ar trebui luate în considerare la evaluarea studiilor privind sistemele de livrare a medicamentelor pe bază de nanoparticule (Tabelul 1). Această revizuire va evalua fiecare tehnică imagistică utilizată pentru a evalua caracteristicile morfologice ale lipozomilor.

tabelul 1. Rezumatul tehnicilor imagistice actuale pentru caracterizarea morfologiei lipozomilor.
microscopie luminoasă
microscopia luminoasă sau optică se referă la microscoape care utilizează lumina vizibilă și un aranjament de lentile pentru a mări un câmp vizual (Murphy și Davidson, 2012c). Microscopia luminoasă de bază în sine nu este în măsură să furnizeze informații complete despre bistratul lipidic în comparație cu detaliile oferite de alte tehnici de microscopie. Cu toate acestea, poate fi folosit pentru a obține rapid o imagine a veziculelor folosind echipamente de laborator de bază (Bibi și colab., 2011). Această tehnică poate fi deosebit de utilă atunci când se colectează informații generale despre dimensiunea, forma, omogenitatea și gradul de agregare a unei probe de lipozomi (Nallamothu și colab., 2006). Microscoapele de lumină au o rezoluție finală de 250 nm (guvernată de cea mai mică dimensiune a spotului limitată de difracție care poate fi realizată de instrument) și, ca atare, sunt de obicei incapabile să furnizeze informații detaliate cu privire la structurile veziculelor unilamelare mici (SUV-uri) și lamelaritatea veziculelor (Bibi și colab., 2011). În general, microscopia cu lumină poate oferi doar informații semnificative despre veziculele unilamelare gigantice (Guv), care pot varia de la un singur la sute de micrometri în diametru (Bagatolli, 2009). Încorporarea sondelor fluorescente, tehnicile de polarizare și aplicarea microscopiei confocale de înaltă rezoluție pot oferi mai multe informații despre structura 3D și lamelaritatea veziculelor (Bagatolli, 2009).
microscopie de polarizare
acest tip de microscopie luminoasă utilizează capacitatea unică a luminii polarizate de a interacționa cu legăturile polarizabile ale moleculelor ordonate (Murphy și Davidson, 2012d). Absorbția îmbunătățită a luminii are loc atunci când dipolii moleculari din probă sunt aliniați cu vectorul de polarizare al undei luminoase incidente; rezultând diferențe de fază între eșantionarea razelor de lumină, care la rândul lor produc modificări dependente de interferență în amplitudine în planul imaginii (Murphy și Davidson, 2012d). Contrastul imaginii apare nu numai din efectele interferenței și difracției, ci și din cauza prezenței aranjamentelor moleculare ordonate (Murphy și Davidson, 2012d). Poate fi folosit pentru a studia forma și dinamica multor structuri celulare ordonate, inclusiv bistraturile lipidice ale membranelor plasmatice (Bibi și colab., 2011; Murphy și Davidson, 2012d). Imaginile pot fi obținute fie în monocrom, fie în culori. Această tehnică oferă o metodă alternativă de vizualizare a lipozomilor, în special pentru a confirma formarea veziculelor. Nu oferă observații concludente cu privire la caracteristicile bistrat sau lamelaritatea veziculelor (Bibi și colab., 2011). În plus, microscopia de polarizare este limitată și de dimensiunea veziculelor care pot fi vizualizate, veziculele mari din gama micrometrică având claritatea optimă. Această tehnică nu oferă imagini clare ale particulelor din gama nanometrică.
microscopia fluorescentă
fluorescența sau microscopia „epifluorescență” este o formă specială de microscopie luminoasă care exploatează capacitatea fluorochromilor de a emite lumină după ce au fost excitați cu lumină de o anumită lungime de undă (Murphy și Davidson, 2012b). Această tehnică este utilizată pe scară largă în biofizică pentru a furniza informații esențiale despre structura și dinamica componentelor membranei (Bouvrais și colab., 2010). În aceste studii, sondele fluorescente sunt încorporate în mod specific în membrana investigată, permițând vizualizarea structurii. O gamă largă de coloranți fluorescenți cu diferite proprietăți chimice și fotonice sunt disponibile în comerț, răspunzând la o varietate de întrebări de cercetare. De exemplu, anumiți coloranți fluorescenți pot prefera medii membranare specifice care prezintă aranjamente diferite și ambalare laterală (Bouvrais și colab., 2010). Ca atare, microscopia fluorescentă permite potențialul de a aplica simultan mai multe sonde într-o probă pentru a furniza informații despre structura membranei în sine. Sondele fluorescente pot fi plasate în compartimentul apos, precum și bistratul lipidic al lipozomilor (Bibi și colab., 2011). Acest aranjament poate fi util în special la vizualizarea Guv – urilor, unde se pot obține informații cu privire la forma, dimensiunea și fluiditatea veziculelor lipidice (Klymchenko și colab., 2009; Bouvrais și colab., 2010). Încorporarea sondelor, cum ar fi lipidele marcate cu rodamină, direct în bistratul lipidic poate permite, de asemenea, vizualizarea lamelarității lipozomilor (Bibi și colab., 2011).
dezavantajul microscopiei fluorescente este că adăugarea de sonde și coloranți la un sistem de membrană poate interfera potențial cu proprietățile sistemului de livrare lipozomală (Bouvrais și colab., 2010; Bibi și colab., 2011; Murphy și Davidson, 2012b). Cu toate acestea, s-a demonstrat că utilizarea concentrațiilor scăzute de coloranți (1 mol%) are un impact minim asupra proprietăților fizice ale membranei (Bouvrais și colab., 2010). De asemenea, este important să rețineți că alegerea colorantului fluorescent este un pas critic, deoarece unii coloranți pot induce modificări mari în membrana gazdă și/sau pot provoca artefacte experimentale, rezultând o interpretare inexactă a datelor (Bouvrais și colab., 2010). În plus, peroxidarea lipidică indusă foto poate duce, de asemenea, la formarea domeniului chiar și în sistemele simple de colorare. Acest proces poate duce la formarea de plute mari și formarea spontană a fațetelor (Bouvrais și colab., 2010). Expunerea prelungită la lumina fluorescentă poate duce, de asemenea, la albirea și pierderea intensității fluorescenței. Prin urmare, alegerea colorantului fluorescent și dezvoltarea de noi sonde cu membrană sunt considerente importante atunci când se utilizează microscopia fluorescentă (Klymchenko și colab., 2009).
microscopie confocală
microscopia de scanare confocală a fost un progres în domeniul microscopiei fluorescente. În loc să ilumineze întregul eșantion, o imagine este construită prin scanarea unuia (sau mai multor) fascicule de lumină focalizate pe eșantion. Lumina care se întoarce din eșantionul iluminat trece printr-o deschidere care respinge lumina în afara focalizării de deasupra și dedesubtul planului de interes; asigurarea faptului că sunt obținute numai imagini de la o adâncime mică de câmp, îmbunătățind foarte mult rezoluția în afara planului (Bibi și colab., 2011; Murphy și Davidson, 2012a). Folosind această tehnică, se colectează o” stivă z ” de imagini, pornind de la partea de sus a veziculei urmată de imagini luate în trepte z definite până la partea de jos a eșantionului, rezultând o imagine 3D compusă a eșantionului (Bibi și colab., 2011; Murphy și Davidson, 2012a). Microscopia de scanare confocală a devenit o tehnică mai atractivă față de microscoapele cu lumină epifluorescentă datorită clarității superioare a imaginii. În cazul Guv-urilor, această tehnică este capabilă să vizualizeze structura internă a sistemelor lipidice, ceea ce adesea nu este posibil cu alte metode de microscopie (Ruozi și colab., 2011; Mertins și Dimova, 2013). De exemplu, separarea fazei bistrat apoase și lipidice poate fi vizualizată în mod clar în vezicule mai mari (Mertins și Dimova, 2013). Cu toate acestea, microscopia confocală este încă limitată la difracție și, prin urmare, nu poate produce imagini de înaltă definiție ale SUV-urilor sau lipozomilor oligolamelari (Ruozi și colab., 2011).
tehnici de microscopie electronică
microscopia electronică este o metodă de vizualizare a veziculelor sub mărire foarte mare (Henry, 2005). Este utilizat pe scară largă în caracterizarea veziculelor lipidice ca lungime de undă a electronilor (și, prin urmare, rezoluție limitată la difracție), este cu multe ordine de mărime mai mică decât cea a microscopiei optice și, prin urmare, oferă super-rezoluție pentru vizualizarea clară a lipozomilor mici (Bibi și colab., 2011; Ruozi și colab., 2011). Această tehnică folosește un fascicul de electroni focalizat pe suprafața eșantionului de diferite lentile electromagnetice. Electronii sunt apoi împrăștiați de eșantion și sunt apoi reorientați și măriți de o serie suplimentară de lentile electromagnetice în coloana de imagistică pentru a produce o imagine proiectată (Henry, 2005). Există o serie de tipuri diferite de microscoape electronice, fiecare necesitând o metodă diferită de preparare a probelor.
microscopie electronică de scanare (sem)
microscoapele electronice de scanare (SEMs) utilizează un fascicul de electroni care este scanat peste sau peste o probă (mai degrabă decât printr-o probă) pentru a produce o imagine mărită a unui obiect (Adler și Schiemann, 1985). Alder și colab. prima încercare de a utiliza sem pentru a caracteriza lipozomii în 1984 (Adler și Schiemann, 1985). Ei au arătat că utilizarea metodei de liofilizare pentru prepararea probelor de lipozomi pentru SEM a dus la o proporție mare de bulgări vizibile și material crustat (Adler și Schiemann, 1985). Studii mai recente au arătat că structura lipozomilor în sine poate suferi perturbații din cauza condițiilor de vid ridicat și a proceselor de colorare necesare pentru această tehnică de preparare (Ruozi și colab., 2011). SEM nu este acum utilizat în mod obișnuit pentru analiza lipozomilor, deoarece necesită uscarea sau fixarea probei înainte de imagistică (Ruozi și colab., 2011). Cu toate acestea, SEM poate oferi informații generale despre structura concentrică a diferitelor straturi lipidice, precum și detalii despre dimensiunea și morfologia sferică a unui preparat (Nirale și colab., 2009).
microscopia electronică de transmisie (TEM)
microscopia electronică de transmisie (TEM) este cea mai frecvent utilizată metodă imagistică pentru evaluarea structurii nanoparticulelor (Henry, 2005; Kuntsche și colab., 2011). Aceasta implică prepararea unei probe subțiri (<grosime de 100 nm) care este plasată într-o cameră de vid. Fasciculul de electroni traversează proba, unde este apoi focalizat de lentila obiectivului pentru a forma o imagine. TEM poate imagina cu ușurință probe de materie moale cu o rezoluție spațială până la o dimensiune mult sub 1 nm (Henry, 2005; Kuntsche și colab., 2011; Ruozi și colab., 2011). Această tehnică poate fi clasificată în continuare pe baza metodei de preparare a eșantionului utilizată-în special, colorarea negativă, fractura de îngheț și TEM criogenic. Poate furniza informații despre modificările de suprafață ale nanoparticulelor, deoarece oferă un contrast și un contur mai bun al imaginilor decât alte tehnici de microscopie. De exemplu, conjugarea transferinei pe suprafața lipozomilor DSPC/colesterol a arătat o acoperire a suprafeței particulelor cu TEM de pată negativă, care a fost absentă în preparatele lipozomice neconjugate (Anabousi și colab., 2005). Într-un experiment separat, anticorpii specifici crescuți împotriva transferinei umane au fost Adăugați înainte de procedura de colorare negativă pentru a confirma identitatea stratului de suprafață a particulelor (Anabousi și colab., 2005). Prin urmare, TEM oferă posibilitatea de a obține o rezoluție mult îmbunătățită atunci când se evaluează conjugarea liganzilor la suprafața lipozomilor.
tehnica de colorare negativă
în tem-pată negativă, prepararea probei implică o cantitate mică de probă hidratat fiind plasat pe o grilă. Deoarece veziculele sunt în contact direct cu grila, orientarea și morfologia lor pot fi afectate și, prin urmare, acest lucru ar trebui luat în considerare (Bibi și colab., 2011). De asemenea, este necesar să încorporați lipozomii într-un material adecvat dens de electroni (de ex., săruri de metale grele precum acetat de uranil sau acid fosfotungstic) care oferă un contrast ridicat, astfel încât veziculele pot fi privite pe un fundal întunecat (Ruozi și colab., 2011). Tehnica de colorare negativă este relativ rapidă și simplă; cu toate acestea, s-a demonstrat că provoacă modificări ale structurii originale a lipozomilor și poate duce la crearea de franjuri ușoare și întunecate care pot fi confundate cu structuri lamelare (Bibi și colab., 2011; Ruozi și colab., 2011). În plus, plasarea probei sub vid poate provoca deshidratarea ulterioară a probei, ceea ce poate provoca din nou modificări ale structurii veziculelor (Bibi și colab., 2011). În timp ce tehnica TEM cu pată negativă poate oferi o mărire mult mai mare pentru nanoparticulele imagistice, deteriorarea structurii lipozomilor face dificilă evaluarea exactă a caracteristicilor morfologice ale probei. Prin urmare, alte tehnici imagistice sunt, în general, necesare pentru a confirma rezultatele.
tehnica de înghețare a fracturilor
tehnica de înghețare a fracturilor nu necesită niciun proces de uscare și poate oferi informații suplimentare despre structura internă a nanoparticulelor (Kuntsche și colab., 2011). Această metodă implică plasarea unui eșantion pe o rețea TEM care este sandwich între două suporturi de cupru sau aur (Severs, 2007). Eșantionul este vitrificat prin congelare rapidă, de obicei cu propan lichid sau azot lichid, înainte de a fi fracturat de-a lungul zonelor probei cu interacțiuni moleculare slabe. Această suprafață de fractură poate fi gravată și umbrită în continuare cu un strat subțire de platină sau carbon pentru a oferi o replică „negativă” a planului eșantionului de fractură (Severs, 2007; Kuntsche și colab., 2011). Replica este apoi curățată cu un solvent organic pentru a îndepărta toate reziduurile înainte de vizualizare sub un microscop TEM. Deoarece aceste replici sunt atât de stabile, ele pot fi stocate și vizualizate mai târziu (Kuntsche și colab., 2011). Avantajul major al acestei tehnici este că replicile reflectă îndeaproape starea nativă a eșantionului și pot oferi informații detaliate despre structura 3D a veziculelor și a organizării bistrat (Bibi și colab., 2011; Kuntsche și colab., 2011). Aceste informații includ construcția multilamelară și ambalarea cu două straturi a veziculelor multilamelare. Această tehnică poate evalua, de asemenea, dimensiunea agregată și poate fi deosebit de utilă pentru examinarea interacțiunii lipozomilor cationici cu ADN-ul (Bibi și colab., 2011). Cu toate acestea, artefactele pot apărea în probă în timpul preparării din cauza ratei insuficiente de îngheț, a re-depunerii moleculelor de solvent și/sau a stresului mecanic (Severs, 2007; Kuntsche și colab., 2011). De exemplu, un” efect de ondulare ” poate apărea pe SUV-urile din eșantion (Bibi și colab., 2011). Aceasta este o deformare comună cu două straturi care se datorează unei tulburări în tranzițiile lanțurilor acil înainte de îngheț. Incubarea veziculelor între pre-tranziție și temperatura reală de tranziție poate provoca, de asemenea, valuri (Bibi și colab., 2011). Interesant este că acest lucru poate fi utilizat pentru a furniza informații despre tranzițiile de fază lipidică care apar cu natura variabilă a lipidelor utilizate pentru preparatele lipozomale (Bibi și colab., 2011).
TEM criogenic
TEM criogenic (crio-TEM) este o variație a TEM în care filmele subțiri hidratate apoase care sunt vitrificate în etan lichid sunt utilizate înainte de imagistică. Această tehnică permite analiza lipozomilor în starea lor cea mai nativă și este un instrument valoros pentru a determina dimensiunea, forma, structura internă și lamelaritatea lipozomilor (Weisman și colab., 2004; Bibi și colab., 2011; Kuntsche și colab., 2011). Avantajul major al înghețării rapide a probelor de lipozomi este minimizarea formării cristalelor de gheață și conservarea proteinelor sau a altor materiale (Bibi și colab., 2011; Kuntsche și colab., 2011). Acest lucru este benefic în cazul în care proteinele sau ADN-ul au fost încapsulate în nanoparticule (Weisman și colab., 2004; Kuntsche și colab., 2011). Crio-TEM este cea mai utilă formă de microscopie disponibilă în prezent pentru a studia lipozomii, deoarece evită problemele legate de fixarea chimică, deshidratarea, tăierea și colorarea – toate acestea pot afecta morfologia veziculelor (Bibi și colab., 2011). Intervalul de rezoluție este de la 5 la 500 nm, așa cum este definit de grosimea filmului (Almgren și colab., 2000). Cu toate acestea, ar trebui remarcate mai multe limitări cu această tehnică, inclusiv faptul că doar o imagine 2D este obținută din obiecte 3D (care, în general, se aplică și majorității celorlalte tehnici de microscopie). Pentru a depăși această limitare, este posibilă reconstrucția formelor 3D dintr-un număr suficient de mare de imagini 2D ale particulelor non-sferice orientate aleatoriu (Orlova și colab., 1999), precum și vizualizarea eșantionului la diferite unghiuri de înclinare pentru a obține informații despre forma 3D (Van Antwerpen și Gilkey, 1994). Tomografia electronică criogenică (crio-ET) poate fi, de asemenea, utilizată pentru a obține imagini 3D (Le Bihan și colab., 2009). Crio-TEM utilizează, de asemenea, doze mai mici de electroni, ceea ce înseamnă că are adesea o rezoluție mai mică în comparație cu alte metode (Bibi și colab., 2011; Kuntsche și colab., 2011). Artefactele sunt încă posibile datorită formării unui film subțire de gheață amorfă și a utilizării blotării pe eșantion aplicând forțe de forfecare în timpul formării filmului (Almgren și colab., 2000; Bibi și colab., 2011).
microscopie electronică de scanare de mediu (ESEM)
microscopie electronică de scanare de mediu (ESEM) este un sistem de imagistică care nu necesită utilizarea fixării, colorării sau înghețării veziculelor și poate permite imagistica modificărilor dinamice ale sistemelor umede fără pregătirea anterioară a eșantionului (Muscariello și colab., 2005; Ruozi și colab., 2011). Caracteristica principală a ESEM este prezența vaporilor de apă în camera microscopului. Capacitatea de a menține o atmosferă care conține apă în jurul probei, care poate fi parțial sau chiar complet hidratată, este posibilă prin utilizarea unui sistem de vid gradat cu diafragmă multiplă, care permite camerei de imagistică să fie susținută la presiuni de până la 55 hPa (Bibi și colab., 2011; Ruozi și colab., 2011). Fasciculul de electroni primar poate genera electroni secundari care apoi întâlnesc molecule de vapori, ducând la o amplificare în cascadă a semnalului înainte de a ajunge la detector. Din această cauză, ESEM nu necesită pregătirea probei (Muscariello și colab., 2005). Această tehnică permite variația mediului eșantionului printr-o serie de compoziții de presiune, temperatură și gaze (Mohammed și colab., 2004), care este utilă la determinarea modului în care schimbările de mediu afectează veziculele. Acest lucru se aplică formulării nanofarmaceutice și studiilor de stabilitate (Bibi și colab., 2011). ESEM a fost, de asemenea, utilizat pentru a analiza încărcarea medicamentului în bistratul lipozomilor (Mohammed și colab., 2004), precum și determinarea dimensiunii și formei veziculelor. O limitare a ESEM este că nu poate furniza informații detaliate privind lamelaritatea și arhitectura internă a structurilor la scară nanometrică (Ruozi și colab., 2011).
microscopia Forței Atomice (AFM)
microscopia Forței Atomice (AFM), cunoscută și sub denumirea de microscopie a forței de scanare (SFM), este un tip de tehnică a microscopului sondei de scanare. Funcționează prin rularea unui vârf ascuțit atașat la o consolă și senzor pe suprafața unei probe și măsurarea forțelor de suprafață dintre sondă și probă (Sitterberg și colab., 2010). Pe măsură ce consola rulează de-a lungul suprafeței eșantionului, se mișcă în sus și în jos datorită caracteristicilor suprafeței, iar consola deviază în consecință. Această deviere este de obicei cuantificată folosind un senzor optic, fasciculul laser fiind reflectat pe partea din spate a consolei pe detectorul de lumină (Sitterberg și colab., 2010). AFM nu trebuie să funcționeze în vid și poate funcționa în aerul înconjurător sau sub lichid; prin urmare, este din ce în ce mai folosit pentru a imagina probe biologice, precum și nanoparticule (Liang și colab., 2004a, b; Ruozi și colab., 2005, 2009). AFM are o rezoluție remarcabilă în ordinea fracțiilor unui nanometru și poate oferi o imagine 3D a lipozomilor împreună cu detalii despre morfologie, distribuția mărimii, omogenitate și stabilitate (Liang și colab., 2004a, b; Ruozi și colab., 2005, 2007, 2009). Important, AFM poate fi utilizat pentru a caracteriza modificările de suprafață ale lipozomilor și pentru a detecta liganzi (de exemplu, anticorpi și polimeri) conjugați la suprafața membranei lipozomale (Bendas și colab., 1999; Moutardier și colab., 2003; Anabousi și colab., 2005; Liang și colab., 2005). De exemplu, Bendas și colab. au folosit AFM pentru a mări marginea membranei lipozomale și au putut imagina structuri trimerice, cu diametrul de aproximativ 8-10 nm, care au reprezentat cuplarea anticorpilor IgG la suprafața lipozomilor (Bendas și colab., 1999). Rezultatele au arătat că eficacitatea tehnicii a fost foarte dependentă de metoda de conjugare utilizată, anticorpii conjugați direct pe suprafața lipozomală fiind vizibili cu AFM (mobilitate proteică limitată), în comparație cu anticorpii atașați la lanțurile PEG. A fost sugestiv faptul că lanțurile cuier au provocat o mobilitate ridicată a proteinelor și, prin urmare, nu au putut fi scanate (Bendas și colab., 1999). În schimb, Anabousi și colab au arătat că încorporarea lipidelor pegilate în lipozomi a indus o stabilizare sterică cu lipozomi menținând o formă sferică (Anabousi și colab., 2005). Imaginile AFM ale suprafeței lipozomilor neconjugați au fost netede și nu au putut fi observate structuri, în timp ce conjugarea transferinei la suprafața lipozomilor pegilați au fost vizualizate ca structuri globulare mici (Anabousi și colab., 2005). În mod similar, Moutardier și colab au fabricat lipozomi cu miezuri polimerice (LSP) care au constat din medicamente încărcate în particule polimerice care au format nucleul veziculelor lipidice (Moutardier și colab., 2003). Imaginile realizate folosind AFM au arătat prezența unei rețele de polimeri pe suprafața exterioară, ceea ce a sugerat că miezul polimeric de colagen a radiat și a format un strat de suprafață pe LSP (Moutardier și colab., 2003). Pe lângă detaliile structurale ale suprafeței, AFM poate furniza informații despre proprietățile mecanice și chimice ale unei suprafețe de probă prin măsurători ale forței (Ruozi și colab., 2007). De exemplu, Mao și colab. a folosit această tehnică pentru a evalua elasticitatea și proprietățile adezive ale lipozomilor (Mao și colab., 2004). O limitare a AFM este necesitatea ca nanoparticulele să fie adsorbite pe suprafețele de sprijin, cum ar fi mica sau plachetele de siliciu. Adsorbția lipozomilor pe un substrat solid are potențialul de a modifica dimensiunea și forma veziculelor și de a provoca aplatizarea acestora. (Ruozi și colab., 2007). În plus, contactul periodic al vârfului de sondare poate trage lipozomii în timp ce se deplasează peste vezicule într-o probă (Jass și colab., 2000). În ciuda acestui fapt, AFM este încă un instrument util în evaluarea lipozomilor.
concluzie
există o gamă largă de tehnici imagistice disponibile pentru evaluarea morfologiei lipozomilor, fiecare având propriile avantaje și dezavantaje. Microscopia cu lumină poate oferi detalii generale cu privire la dimensiunea și forma veziculelor mai mari și omogenitatea unei probe într-o manieră relativ rapidă. În schimb, TEM este tehnica cea mai frecvent utilizată pentru a examina morfologia lipozomilor mult mai detaliat; cu toate acestea, la interpretarea rezultatelor trebuie luat în considerare potențialul de modificări structurale pentru fiecare Subtip TEM din cauza colorării și/sau a expunerii la condiții de vid. ESEM este cel mai util atunci când se determină modificările lipozomale ca răspuns la mediu, în timp ce AFM apare ca o metodă utilă în analiza morfologică a nanoparticulelor și asigură rezoluția maximă a suprafeței lipozomale. Atât AFM, cât și TEM sunt capabile să creeze liganzi conjugați la suprafața lipozomilor și să ofere informații complementare despre modificările suprafeței. În general, alegerea tehnicii depinde de caracteristicile morfologice și de gradul de detaliu necesar. În plus, înțelegerea efectelor potențiale ale metodei de preparare a eșantionului pentru fiecare tehnică imagistică este importantă în procesul de selecție.
contribuții autor
redactarea manuscrisului: A-LR și SH. Revizuirea critică a articolului pentru conținut intelectual important: SH, PD, JF, WP, am, DS și AW.
Declarație privind conflictul de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
mulțumiri
autorii doresc să mulțumesc Farmacie cercetare Trust din New South Wales, Rebecca L. Cooper Medical Research Foundation, Gladys M. Brawn Fellowship, Ausee Research Foundation, și Universitatea din Newcastle pentru furnizarea de sprijin financiar pentru cercetarea noastră.
Adler, K. și Schiemann, J. (1985). Caracterizarea lipozomilor prin microscopie electronică de scanare și tehnica de îngheț-fractură. Micron Microsc. Acta 16, 109-113. doi: 10.1016/0739-6260(85)90039-5
CrossRef Full Text | Google Scholar
Almgren, M., Edwards, K., și Karlsson, G. (2000). Microscopie electronică cu transmisie crio a lipozomilor și a structurilor conexe. Coloizii Fac Surf. O Fizico-Chimie. Ing. Asp. 174, 3–21. doi: 10.1016/S0927-7757(00)00516-1
CrossRef Full Text/Google Scholar
Anabousi, S., Laue, M., Lehr, C. M., Bakowsky, U., și Ehrhardt, C. (2005). Evaluarea modificării transferinei lipozomilor prin microscopie de forță atomică și microscopie electronică de transmisie. Eur. J. Pharm. Biopharm. 60, 295–303. doi: 10.1016 / j.ejpb.2004.12.009
PubMed Abstract | CrossRef Full Text/Google Scholar
Bagatolli, L. A. (2009). Membrane și microscopie fluorescentă. Recenzii în fluorescență 2007. New York, NY: Springer, 33-51. doi: 10.1007 / 978-0-387-88722-7_2
CrossRef Full Text / Google Scholar
Bakker-Woudenberg, ia, Storm, G., și Woodle, M. C. (1994). Lipozomi în tratamentul infecțiilor. J. Țintă De Droguri. 2, 363–371. doi: 10.3109 / 10611869408996811
PubMed Abstract | CrossRef Full Text/Google Scholar
Bendas, G. (2001). Imunolipozomii: o abordare promițătoare pentru direcționarea terapiei cancerului. Biodrugurile 15, 215-224. doi: 10.2165 / 00063030-200115040-00002
CrossRef Full Text / Google Scholar
Bendas, G., Krause, A., Bakowsky, U., Vogel, J. și Rothe, U. (1999). Targetabilitatea imunolipozomilor noi preparați printr-o nouă tehnică de conjugare a anticorpilor. Int. J. Pharm. 181, 79–93. doi: 10.1016/S0378-5173(99)00002-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Bibi, S., Kaur, R., Henriksen-Lacey, M., McNeil, S. E., Wilkhu, J., lattmann, E. și colab. (2011). Imagistica prin microscopie a lipozomilor: de la capace la SEM de mediu. Int. J. Pharm. 417, 138–150. doi: 10.1016 / j. ijpharm.2010.12.021
PubMed Abstract | CrossRef Full Text/Google Scholar
Bouvrais, H., Pott, T., Bagatolli, L. A., Ipsen, J. H., și Meleard, P. (2010). Impactul sondelor fluorescente ancorate cu membrană asupra proprietăților mecanice ale bistraturilor lipidice. Biochim. Biophys. Acta 1798, 1333-1337. doi: 10.1016 / j. bbamem.2010.03.026
PubMed Abstract | CrossRef Full Text/Google Scholar
Cullis, P. R., Chonn, A. și Semple, S. C. (1998). Interacțiunile lipozomilor și sistemelor purtătoare pe bază de lipide cu proteinele din sânge: relația cu comportamentul de eliminare in vivo. ADV. Droguri Deliv. Rev. 32, 3-17. doi: 10.1016/S0169-409X(97)00128-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Ding, B. S., Dziubla, T., Shuvaev, V. V., Muro, S., și Muzykantov, V. R. (2006). Sisteme avansate de livrare a medicamentelor care vizează endoteliul vascular. Mol. Interv. 6, 98–112. doi: 10.1124 / mi.6.2.7
PubMed Abstract | CrossRef Full Text/Google Scholar
Henry, C. R. (2005). Morfologia nanoparticulelor susținute. Prog. Surf. Sci. 80, 92–116. doi: 10.1016 / j. progsurf.2005.09.004
CrossRef Full Text/Google Scholar
Hua, S. (2013). Direcționarea locurilor de inflamație: molecula de adeziune intercelulară-1 ca țintă pentru noi terapii inflamatorii. În față. Pharmacol. 4:127. doi: 10.3389 / fphar.2013.00127
PubMed Abstract | CrossRef Full Text/Google Scholar
Hua, S., Marks, E., Schneider, J. J. și Keely, S. (2015). Progrese în sistemele de nano-livrare orală pentru livrarea de medicamente vizate de colon în boala inflamatorie intestinală: direcționarea selectivă către țesutul bolnav versus cel sănătos. Nanomedicina 11, 1117-1132. doi: 10.1016 / j.nano.2015.02.018
PubMed Abstract | CrossRef Full Text/Google Scholar
Hua, S., și Wu, S. Y. (2013). Utilizarea nanocarrierilor pe bază de lipide pentru terapii de durere vizate. În față. Pharmacol. 4:143. doi: 10.3389 / fphar.2013.00143
PubMed Abstract | CrossRef Full Text/Google Scholar
Ishida, T., Harashima, H., și Kiwada, H. (2001). Interacțiunile lipozomilor cu celulele in vitro și in vivo: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L., Duportail, G. și colab. (2009). Vizualizarea domeniilor lipidice în veziculele unilamelare uriașe folosind o sondă de membrană sensibilă la mediu bazată pe 3-hidroxiflavonă. Biochim. Biophys. Acta 1788, 495-499. doi: 10.1016 / j. bbamem.2008.10.019
PubMed Abstract | CrossRef Full Text/Google Scholar
Kuntsche, J., Horst, J. C. și Bunjes, H. (2011). Microscopie electronică cu transmisie criogenică (crio-TEM) pentru studierea morfologiei sistemelor de livrare a medicamentelor coloidale. Int. J. Pharm. 417, 120–137. doi: 10.1016 / j. ijpharm.2011.02.001
PubMed Abstract | CrossRef Full Text/Google Scholar
Le Bihan, O., Bonnafous, P., Marak, L., Bickel, T., Trepout, S., Mornet, S. și colab. (2009). Tomografia crioelectronică a transmigrării nanoparticulelor în lipozomi. J. Struct. Biol. 168, 419–425. doi: 10.1016 / j. jsb.2009.07.006
PubMed Abstract | CrossRef Full Text/Google Scholar
Liang, X., Mao, G., și Ng, K. Y. (2004a). Proprietăți mecanice și măsurarea stabilității lipozomilor care conțin colesterol pe mica prin microscopie de forță atomică. J. Interfață Coloidală Sci. 278, 53–62.
PubMed Abstract/Google Scholar
Liang, X., Mao, G. și Ng, K. Y. (2005). Efectul lungimilor lanțului PEO-PPO-PEO asupra morfologiei și stabilității lipozomilor unilamelari mici: o investigație AFM. J. Interfață Coloidală Sci. 285, 360–372. doi: 10.1016 / j. JCI.2004.11.042
PubMed Abstract | CrossRef Full Text/Google Scholar
Liang, X., Mao, G., și Simon ng, K. Y. (2004b). Sondarea veziculelor mici unilamelare eggpc pe suprafața mica prin microscopie de forță atomică. Coloizii Fac Surf. B Biointerfețe 34, 41-51.
PubMed Abstract/Google Scholar
Mao, G., Liang, X. și Ng, K. Y. S. (2004). Enciclopedia Nanoștiinței și nanotehnologiei. New York, NY: Marcel Dekker.
Google Scholar
Mastrobattista, E., Koning, G. A. și Storm, G. (1999). Imunolipozomii pentru livrarea vizată a medicamentelor antitumorale. ADV. Droguri Deliv. Rev. 40, 103-127. doi: 10.1016 / S0169-409X (99)00043-5
CrossRef Full Text | Google Scholar
Mertins, O., și Dimova, R. (2013). Informații despre interacțiunile chitosanului cu veziculele fosfolipide. Partea II: rigidizarea membranei și formarea porilor. Langmuir 29, 14552-14559. doi: 10.1021/la4032199
PubMed Abstract | CrossRef Full Text/Google Scholar
Metselaar, J. M. și Storm, G. (2005). Lipozomi în tratamentul tulburărilor inflamatorii. Expert Opin. Droguri Deliv. 2, 465–476. doi: 10.1517 / 17425247.2.3.465
PubMed Abstract | CrossRef Full Text/Google Scholar
Mohammed, A. R., Weston, N., Coombes, A. G., Fitzgerald, M. și Perrie, Y. (2004). Formularea lipozomilor de medicamente slab solubile în apă: optimizarea încărcării medicamentului și analiza ESEM a stabilității. Int. J. Pharm. 285, 23–34. doi: 10.1016 / j. ijpharm.2004.07.010
PubMed Abstract | CrossRef Full Text/Google Scholar
Moutardier, V., Tosini, F., Vlieghe, P., Cara, L., Delpero, J. R., și Clerc, T. (2003). Biodisponibilitățile medicamentelor anticanceroase coloidale în modelele de administrare orală. Int. J. Pharm. 260, 23–38. doi: 10.1016/S0378-5173(03)00231-X
PubMed Abstract | CrossRef Full Text/Google Scholar
Murphy, D. B., și Davidson, M. W. (2012a). Microscopie De Scanare Laser Confocală. Bazele microscopiei luminoase și imagisticii electronice, EDN 2. Hoboken, NJ: John Wiley & fii, 265-305. doi: 10.1002/9781118382905.ch13
CrossRef Full Text/Google Scholar
Murphy, D. B., și Davidson, M. W. (2012b). Microscopie Fluorescentă. Bazele microscopiei luminoase și imagisticii electronice. Weinheim: John Wiley & fii, 199-231. doi: 10.1002/9781118382905.ch11
CrossRef Full Text/Google Scholar
Murphy, D. B., și Davidson, M. W. (2012c). Bazele microscopiei luminoase și imagisticii electronice. Hoboken, NJ: John Wiley & fii, 1-19. doi: 10.1002 / 9781118382905
CrossRef Full Text/Google Scholar
Murphy, D. B., și Davidson, M. W. (2012d). Microscopie De Polarizare. Bazele microscopiei luminoase și imagisticii electronice. Hoboken, NJ: John Wiley & fii, 153-171. doi: 10.1002/9781118382905.ch9
CrossRef Full Text/Google Scholar
Muscariello, L., Rosso, F., Marino, G., Giordano, A., Barbarisi, M., Cafiero, G., și colab. (2005). O imagine de ansamblu critică a aplicațiilor ESEM în domeniul biologic. J. Cell. Physiol. 205, 328–334. doi: 10.1002 / jcp.20444
PubMed Abstract | CrossRef Full Text/Google Scholar
Nallamothu, R., Wood, G. C., Pattillo, C. B., Scott, R. C., Kiani, M. F., Moore, B. M. și colab. (2006). O vasculatură tumorală a vizat sistemul de livrare a lipozomilor pentru combretastatina A4: proiectare, caracterizare și evaluare in vitro. AAPS PharmSciTech 7: E32. doi: 10.1208/pt070232
PubMed Abstract | CrossRef Full Text | Google Scholar
Nirale, N. M., Vidhate, R. D. și Nagarsenker, ms (2009). Lipozomi de propionat de fluticazonă pentru administrare pulmonară. Indian J. Pharm. Sci. 71, 709–711.
Google Scholar
Orlova, E. V., Sherman, Mb, Chiu, W., Mowri, H., Smith, L. C. și Gotto, A. M. Jr. (1999). Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Forni, F., Festa, M. și Vandelli ,M. A. (2005). Microscopia Forței Atomice și spectroscopia de corelație fotonică: două tehnici pentru caracterizarea rapidă a lipozomilor. Eur. J. Pharm. Sci. 25, 81–89. doi: 10.1016 / j. ejps.2005.01.020
PubMed Abstract | CrossRef Full Text/Google Scholar
Ruozi, B., Tosi, G., Leo, E. și Vandelli, ma (2007). Aplicarea microscopiei Forței Atomice pentru a caracteriza lipozomii ca purtători de medicamente și gene. Talanta 73, 12-22. doi: 10.1016 / j.talanta.2007.03.031
PubMed Abstract | CrossRef Full Text/Google Scholar
Ruozi, B., Tosi, G., Tonelli, M., Bondioli, L., Mucci, A., Forni, F. și colab. (2009). Imagistica în fază AFM a probelor hidratate moale: un instrument versatil pentru a finaliza studiul Chimico-fizic al lipozomilor. J. Liposome Res. 19, 59-67. doi: 10.1080 / 08982100802584071
PubMed Abstract | CrossRef Full Text/Google Scholar
Sawant, R. R., și Torchilin, V. P. (2012). Provocări în dezvoltarea terapiei lipozomale vizate. AAPS J. 14, 303-315. doi: 10.1208 / s12248-012-9330-0
PubMed Abstract | CrossRef Full Text/Google Scholar
Senior, JH (1987). Soarta și comportamentul lipozomilor in vivo: o revizuire a factorilor de control. Crit. Rev.Ther. Transportatorul De Droguri Syst. 3, 123–193.
PubMed Abstract/Google Scholar
Sercombe, L., Veerati, T., Moheimani, F., Wu, S. Y., Sood, A. K. și Hua, S. (2015). Avansuri și provocări ale lipozomilor asistate de livrare de droguri. În față. Pharmacol. 6:286. doi: 10.3389 / fphar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
PubMed Abstract | CrossRef Full Text/Google Scholar
Torchilin, V. P. (1994). Imunolipozomi și Imunolipozomi pegilați: posibilă utilizare pentru livrarea țintită a agenților imagistici. Imunometode 4, 244-258. doi: 10.1006 / immu.1994.1027
PubMed Abstract | CrossRef Full Text/Google Scholar
Van Antwerpen, R., și Gilkey, J. C. (1994). Microscopia crioelectronică dezvăluie substructura lipoproteinelor umane cu densitate scăzută. J. Lipide Res. 35, 2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
PubMed Abstract | CrossRef Full Text/Google Scholar
Willis, M. și Forssen, E. (1998). Lipozomi vizați de Ligand. ADV. Droguri Deliv. 29, 249-271. doi: 10.1016/S0169-409X(97)00083-5
CrossRef Full Text/Google Scholar
Zununi Vahed, S., Salehi, R., Davaran, S. și Sharifi, S. (2017). Sisteme de co-livrare a medicamentelor pe bază de lipozomi în celulele canceroase. Mater. Sci. Ing. C Mater. Biol. Appl. 71, 1327–1341. doi: 10.1016 / j. msec.2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply