Frontiers in Oncology
Introducere
aproximativ 25% dintre pacienții cu cancer de sân precoce prezintă încă recurență locală și dezvoltă metastaze la distanță după tratamentul activ (1) și aproape 10% dintre pacienți se află în stadiul IV al bolii la diagnosticul inițial în lumea dezvoltată, care este denumită cancer de sân metastatic de novo (MBC) (2). În ciuda progreselor tratamentului, MBC rămâne incurabilă și până la 70-80% dintre pacienții cu MBC mor de cancer în decurs de 5 ani (2). Ca urmare a eterogenității MBC, sunt dezvoltate mai multe modele de prognostic bazate pe factori sau scoruri prognostice pentru a prezice rezultatele lor clinice și medicii direcționați să ia decizii terapeutice adecvate (3-5). În plus, există, de asemenea, o varietate de modele de prognostic pentru cancerul de sân cu metastaze cerebrale (BCBM) pentru clinicieni pentru a prezice cu exactitate supraviețuirea la acești pacienți (6, 7).
cancerul de sân poate metastaza oriunde în organism, dar în primul rând metastazează la plămâni, os, ficat, ganglioni limfatici non-axilari și creier (8). În special, metastazele hepatice (LM) nu sunt doar un sit metastatic comun, ci și asociate cu un risc semnificativ crescut de deces similar metastazelor cerebrale, o mortalitate disproporționat mai mare comparativ cu metastazele pulmonare sau osoase (5, 8). Deoarece evaluarea prognostică gradată (GPA) este larg acceptată la pacienții cu BCBM, modelele de prognostic menționate mai sus ne stimulează să propunem un model practic pentru BCLM (3-7). Scopul nostru a fost de a construi un model de prognostic fiabil și ușor de utilizat pentru BCLM și de a evalua concordanța și acuratețea acestuia prin validarea acestuia atât pe plan intern, cât și extern. Modelul prognostic ar putea ajuta clinicienii să estimeze riscul de deces al pacienților cu BCLM și să selecteze tratamentul optim.
pacienți și metode
selecția pacienților
studiul de față a fost aprobat de comitetele independente de etică ale FUSCC. Au fost identificați pacienți consecutivi cu MBC diagnosticați la FUSCC din ianuarie 2007 până în decembrie 2018 (n = 9.062). Criteriile de eligibilitate au fost următoarele: (1) cancer de sân confirmat histologic, (2) pacienți de sex feminin, (3) ficatul ca primul loc al bolii metastatice în cancerul de sân metastatic sau recurent de novo și (4) înregistrări complete și detaliate. Pacienții cu cancer mamar bilateral, Alte neoplasme invazive sau cu urmărire necunoscută au fost excluși. În cele din urmă, au fost selectați 1.022 de pacienți eligibili pentru analize suplimentare. Etapele complete de selecție sunt prezentate în figura S1.
studierea variabilelor și selectarea valorilor limită
au fost colectate informații despre următoarele variabile clinicopatologice: vârsta, subtipurile moleculare, informațiile privind tratamentul anterior (chirurgie și chimioterapie sistemică), ifm, locurile metastazelor extrahepatice (creier, plămân, OS și ganglioni limfatici), caracteristicile metastazelor hepatice (distribuție, număr, diametru maxim), hemoglobină (HB), teste ale funcției hepatice și timpul de supraviețuire. Subtipurile moleculare au inclus receptorul hormonal (HR) și starea receptorului 2 al factorului de creștere epidermică umană (HER2). Am definit ifm ca intervalul dintre data diagnosticării cancerului de sân primar și data primei metastaze îndepărtate. Punctele limită ale IFM utilizate în acest studiu au fost de 3 și 24 de luni conform referinței (9). Prin urmare, pacienții ar putea fi împărțiți în trei grupe: pacienți cu MBC de novo (ifm < 3 luni), pacienți cu IFM scurtă (24 luni) și pacienți cu IFM lungă > 24 luni. Metastaza ganglionilor limfatici îndepărtați a fost definită ca metastază din ganglionii limfatici axilari ipsilaterali, supraclaviculari, infraclaviculari sau interni. Diagnosticul de LM S-a bazat pe imagistica radiografică sau pe dovezi patologice. Caracteristicile metastazelor hepatice au fost evaluate cu ajutorul tomografiei computerizate abdominale (CT), imagisticii prin rezonanță magnetică (RMN) sau specimenelor de rezecție chirurgicală. Testele funcției hepatice au fost, de asemenea, analizate în studiul de față, incluzând bilirubina totală, alanin aminotransferaza (ALT), aspartat aminotransferaza (AST), fosfataza alcalină (ALP), lactat dehidrogenaza (LDH) și raportul dintre lacto-glutamil transferază și albumină (GAR). Probele de sânge au fost prelevate pentru teste de laborator în decurs de 1 săptămână după diagnosticarea LM. Clasificările distribuției, numărului sau diametrului maxim al metastazelor hepatice și LDH s-au bazat pe alte studii (10-13). Valorile limită pentru HB, bilirubina totală, ALT, AST și ALP au fost determinate în conformitate cu criteriile terminologice comune pentru evenimente Adverse (CTCAE), deoarece anomaliile moderate sau de gradul II ale nivelurilor de hemoglobină sau ale funcției hepatice ar putea influența alegerile terapeutice (14). Valoarea GAR a fost definită ca un raport simplu între nivelul serum-glutamil transferazei (GGT, U/l) și nivelul albuminei serice (ALB g/l). OS din momentul metastazelor a fost măsurată de la data diagnosticării LM până la moarte pentru orice cauză. Ultima perioadă de urmărire a fost Noiembrie 2019, cu un timp mediu de urmărire de 18,63 luni. Dacă pacienții au fost pierduți la urmărire, a fost cenzurat în ultima zi de urmărire.
analiza statistică
pacienții au fost împărțiți în formarea (2007-2016, n = 715) și validarea (2016-2018, n = 307) stabilită la un raport de 7:3. Valoarea cutoff optimă pentru GAR a fost ales prin calcularea indicelui Youden și receptor curba caracteristică de funcționare (ROC) analiză (figura s2). Testul Pearson chi-squared sau testul exact al lui Fisher a fost utilizat pentru a face o comparație între variabilele categorice. Modelele de regresie a pericolelor proporționale Cox cu metoda de selecție înapoi au fost utilizate pentru analiza multivariată și pentru calcularea ratelor de pericol. Coeficienții de regresie au fost calculați prin analiza regresiei multivariate și apoi înmulțiți cu 10 și rotunjiți pentru a reprezenta scorurile prognostice finale. Bootstrapping a fost folosit pentru validarea internă. Apoi, curbele Roc dependente de timp și parcelele de calibrare au fost utilizate pentru a evalua discriminarea și calibrarea acestui model prognostic în setul de validare. Valorile limită ale grupurilor de risc au fost determinate de parcelele X-tile (15). Analiza supraviețuirii a fost efectuată utilizând curbele de supraviețuire Kaplan-Meier, iar testele log-rank au fost utilizate pentru a compara curbele de supraviețuire. Toate valorile P au fost față-verso, iar valorile p < 0,05 au fost considerate semnificative statistic. Analiza statistică a fost efectuată utilizând software-ul SPSS (SPSS 20, Chicago, IL, SUA) și versiunea software r 4.0.1.
rezultate
caracteristici și relația cu stratificarea riscului
Un total de 1022 de pacienți selectați în acest studiu au fost împărțiți în seturi de formare (n = 715) și validare (n = 307). O descriere a caracteristicilor clinicopatologice este prezentată în tabelul 1 și tabelul S1. În grupul de formare, au existat 126 de pacienți (17,6%) diagnosticați cu MBC de novo și 589 de pacienți (82,4%) cu MBC recurent, dintre care 297 de pacienți (50,4%) au avut o IFM scurtă și 292 de pacienți (49,6%) au avut o IFM lungă. Vârsta mediană la diagnosticul de LM a fost de 50 (interval 21-87) ani, cu 617 pacienți (86.3%) Sub 60 de ani. Dintre acești pacienți, proporția pacienților HR-pozitivi și HER2-pozitivi a fost de 62,2 și, respectiv, 38,0%. Dintre pacienții recurenți cu MBC, aproape toți pacienții au suferit o intervenție chirurgicală asupra tumorii primare (584, 99,2%) și au primit chimioterapie adjuvantă (neo) (569, 96,6%). Modelele metastazelor îndepărtate au arătat că cel mai frecvent loc al metastazelor extrahepatice a fost osul (42,7%) urmat de ganglionii limfatici îndepărtați (36,1%), plămânul (25,6%) și creierul (2,9%). Metastazele hepatice s-au caracterizat prin distribuție difuză și noduli mici, dintre care majoritatea au fost multipli (metastaze de la 3 la 77,3%), dar noduli mici (de la 3 la 3 la 59,4%) și au implicat lobii drepți și stângi (74,4%). În stadiul incipient al LM, funcția hepatică a fost afectată în grade diferite, dar în general ușoară. Creșterea LDH (36,1%) și GAR (35,9%) părea a fi indicatori sensibili ai disfuncției hepatice, iar anomaliile moderate sau peste valorile HB (2,9%), bilirubinei totale (2,7%), ALT (3,6%), AST (9,5%) și ALP (3,9%) au fost mai puțin frecvente în funcție de CTCAE. Comparativ cu grupul cu risc scăzut, grupul cu risc intermediar și ridicat a prezentat o rată mai mare de negativitate HR și HER2, o IFM scurtă, metastaze extrahepatice, încărcare tumorală a metastazelor hepatice și anomalii ale nivelurilor de hemoglobină sau ale funcției hepatice (toate PS 0,001), sugerând că acești factori ar putea afecta prognosticul BCLM.
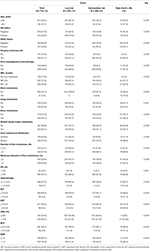
Tabelul 1. Caracteristicile de bază și relația sa cu stratificarea riscurilor setului de formare.
model Prognostic și validare
în modelul de regresie Cox multivariat, subtipurile moleculare (starea HR și HER2), ifm, situsurile metastazelor extrahepatice (metastaze cerebrale, pulmonare și osoase) și testele funcției hepatice (bilirubină totală, LDH și GAR) au fost asociate cu SG (Tabelul 2). Mai exact, riscul de deces al pacienților cu RR negativ (RR 1,740, IÎ 95% 1,424–2,127, p < 0,001) și HER2 negativ (RR 1,615, IÎ 95% 1,316–1,983, p < 0,001) a crescut în comparație cu RR sau HER2 omologii pozitive. Durata IFM a avut, de asemenea, un impact semnificativ asupra supraviețuirii pacienților cu BCLM și, prin urmare, supraviețuirea pacienților cu IFM lung (RR 1,612, IÎ 95% 1,195–2,174, P < 0,001) a fost scurtată în comparație cu pacienții cu MBC de novo și pacienții cu IFM scurt (RR 2,563, IÎ 95% 1,904–3.449, p < 0.001) au avut mai mult de două ori riscul de deces în raport cu acestea. În plus, prezența metastazelor extrahepatice (metastaze cerebrale, pulmonare și osoase) și a funcției hepatice anormale (bilirubină totală, LDH și GAR) au fost corelate cu un impact prognostic nefavorabil asupra OS. Acest model de prognostic a avut aria de sub curbă (ASC) a ROC dependentă de timp la 1 an OS cu 0,78 în setul de antrenament și 0,80 în setul de validare, indicând că acest model a avut o bună discriminare (Figura 1). Metoda de bootstrapping a fost utilizată pentru a confirma stabilitatea modelului nostru de prognostic în setul de antrenament, iar rezultatele finale au fost destul de robuste (tabelul s2). Curbele de calibrare ale modelului prognostic pentru OS de 1 an și 3 ani în setul de antrenament, precum și OS de 1 an în setul de validare au arătat buna concordanță a acestuia (Figura 2).

Tabelul 2. Model de regresie Cox multivariat (set de antrenament).
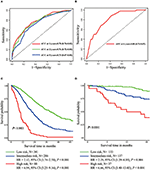
Figura 1. Curbele ROC dependente de timp ale modelului prognostic în setul de antrenament (a) și setul de validare (b). Supraviețuirea globală din metastaze a celor trei grupuri de prognostic în setul de formare (C) și validare (D).
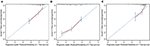
Figura 2. Curba de calibrare pentru estimarea supraviețuirii pacientului la 1 an (a) și 3 ani (B) în setul de antrenament și la 1 An (C) în setul de validare.
stratificarea riscului și supraviețuirea

Tabelul 3. Calcularea punctajului și a punctelor limită ale grupurilor de prognostic.
discuție
în analiza actuală a 1.022 de pacienți tratați în instituția noastră din 2007 până în 2018, am arătat că subtipurile moleculare (starea HR și HER2), ifm, locurile metastazelor extrahepatice (metastaze cerebrale, pulmonare și osoase), testele funcției hepatice (bilirubina totală, LDH și GAR) au fost factori prognostici independenți ai BCLM pacienți. Prin urmare, un model de prognostic pentru pacienții cu BCLM a fost construit folosind factori de prognostic.în ceea ce privește subtipurile moleculare, HR pozitiv poate indica faptul că creșterea și proliferarea cancerului de sân sunt încă reglementate de hormoni, numiți tumori dependente de hormoni. În același timp, terapia endocrină are beneficii, inclusiv puține reacții adverse și efecte de lungă durată, care pot aduce adesea beneficii de supraviețuire pe termen lung pacienților cu HR pozitiv. Prin urmare, HR pozitiv a fost considerat un factor semnificativ care sugerează un prognostic favorabil în cancerul de sân precoce și metastatic(1, 3-5, 8-10, 16). Deși amplificarea și supraexprimarea HER2 sunt considerate a fi un predictor al riscului de metastază la distanță și deces legat de cancerul de sân, agenții anti–HER2 dezvoltați ulterior au îmbunătățit remarcabil supraviețuirea pacienților cu cancer de sân HER2-pozitivi (2, 9, 17). În epoca terapiei vizate, un studiu din sud-estul Olandei a constatat că riscul de mortalitate al pacienților HER2–negativi a fost crescut cu 44% (IÎ 95% 1,13-1,83, P = 0,003) comparativ cu pacienții HER2 pozitivi (9). În studiul nostru, riscul de deces al pacienților HR-negativi și HER2-negativi a crescut comparativ cu omologii HR sau HER2-pozitivi, în concordanță cu aceste observații. Pacienții cu IFM scurt, de obicei definit ca 24 de luni, au avut un prognostic mai rău (3, 5, 9). În plus, pacienții cu MBC de novo păreau să aibă un prognostic semnificativ mai bun în raport cu pacienții cu MBC recurenți, deși această diferență a fost redusă treptat odată cu extinderea intervalului fără boală (DFI) sau ifm (9, 18, 19). Lobbezoo și colab. s-a constatat că pacienții cu IFM 24 de luni au avut un timp de supraviețuire semnificativ mai scurt (9,1 vs.29.4 luni, P< 0,001) decât cei cu boli de novo stadiul IV, dar pacienții cu IFM mai lungă (>24 luni) au avut un prognostic similar (27,9 față de 29,4 luni, P = 0,73) (9). Motivul posibil al acestui fenomen este că pacienții cu MBC recidivat care au urmat anterior terapie sistematică pot fi mai rezistenți la chimioterapie decât pacienții naivi cu terapie cu MBC de novo, dar sunt necesare investigații suplimentare (9, 18, 19). Acest studiu a confirmat că timpul de supraviețuire al pacienților cu IFM lung a fost scurtat în comparație cu MBC de novo cu pacienții cu IFM scurt care au prezentat un rezultat semnificativ mai slab.
supraviețuirea MBC a diferit semnificativ în funcție de locurile metastatice, iar pacienții cu metastaze viscerale au fost asociați cu un risc crescut de mortalitate comparativ cu cei cu metastaze non-viscerale (3-5, 9, 18). Mai mult, prezența metastazelor cerebrale a avut un impact mai mare asupra supraviețuirii decât orice alte site-uri metastatice(3, 5, 9, 18). Nu a fost surprinzător faptul că metastazele multiple au avut o influență mai nefavorabilă asupra prognosticului (3, 5, 9, 17, 18). În această analiză, metastazele extrahepatice, cu excepția metastazelor ganglionilor limfatici îndepărtați, ar putea duce la scurtarea supraviețuirii, probabil pentru că metastazele hepatice au fost factorul critic care pune viața în pericol în comparație cu metastazele ganglionilor limfatici.
trebuie remarcat faptul că pacienții cu niveluri mai mari de bilirubină au avut un risc mult mai mic pentru mai multe boli, în parte, prin proprietățile sale antioxidante și antiinflamatorii (20). Un studiu recent a raportat, de asemenea, că o reducere de aproape 40% a riscului de deces a fost demonstrată în rândul pacienților cu cancer de sân precoce cu un nivel mai mare de bilirubină totală (21). Cu toate acestea, hiperbilirubinemia a fost asociată cu prognostic slab în rândul pacienților cu BCLM (22). Este posibil ca, spre deosebire de bilirubina totală relativ mai mare la pacienții cu cancer de sân non-metastatic, o bilirubină crescută de 1,5 ori mai mare decât limita superioară a normalului (LSVN) la pacienții cu BCLM să poată prezice leziuni hepatice severe și, astfel, să contribuie la întreruperea tratamentului sau encefalopatie hepatică.efectul Warburg determină celulele canceroase să depindă de glicoliza aerobă chiar și atunci când aportul de oxigen este suficient, ceea ce reprezintă semnul distinctiv al metabolismului cancerului în contrast cu țesuturile normale (23). LDH joacă un rol indispensabil în glicoliză datorită capacității sale de a transforma piruvatul în lactat în condiții anaerobe (24). Nivelurile dereglementate de LDH ar putea reflecta o povară tumorală mai mare, un răspuns mai slab la tratament și prognostic, care au fost raportate anterior în mai multe tumori (21, 24-26). O meta-analiză a efectului prognostic al LDH la pacienții cu cancer de sân a arătat că nivelurile mai mari de LDH au dus la un OS nesatisfăcător și la supraviețuirea fără progresie, care au inclus 11 studii care au implicat 6102 pacienți (27).
GGT, principalul antioxidant endogen, face aminoacizii precursori asimilați și se implică în sinteza glutationului (28). GGT în tumori permite celulelor să umple rapid glutationul după ce au primit terapie anticanceroasă pro-oxidantă și, prin urmare, este corelată cu rezistența la medicamente și supraviețuirea slabă (29). Interesant, Fentiman și colab. a raportat că a fost identificată o relație semnificativ pozitivă între GGT crescut și riscul de cancer mamar (30). ALB sintetizat de ficat funcționează ca un antioxidant, transportor de nutrienți și are participare la căile de semnal datorită proprietăților sale structurale unice (31). Hipoalbuminemia apare de obicei la pacienții cu cancer avansat și este atribuită diferitelor mecanisme, inclusiv sinteza hepatică afectată, catabolismul crescut și cașexia (21, 31). Hipoalbuminemia este un indicator independent al prognosticului slab al diferitelor tumori (21, 22, 32, 33). Spre deosebire de scăderea nivelului seric de albumină, nivelurile serice de GGT tind să fie crescute atunci când funcția hepatică este afectată. Prin urmare, GAR pe baza celor doi parametri de mai sus pot avea avantajul de a reflecta capacitatea de rezervă hepatică și prezice prognosticul (32, 33). În studiul actual, funcția hepatică anormală (bilirubina totală, LDH și GAR) a fost corelată cu un impact prognostic nefavorabil asupra OS.
după analizarea prognosticului a 123 de pacienți cu BCLM, Duan și colab. sa constatat că pacienții cu trei sau mai multe metastaze hepatice efectuate 2.Risc crescut de deces de 26 de ori comparativ cu pacienții cu <3 metastaze hepatice în analiza multivariată (10). Cu toate acestea, caracteristicile metastazelor hepatice din acest studiu par să nu facă nicio diferență. Există două motive potențiale care contribuie la această discrepanță. În primul rând, distribuția, numărul și diametrul maxim al metastazelor hepatice au fost semnificativ diferite în cele trei grupuri de risc, indicând faptul că riscul de mortalitate a crescut odată cu extinderea metastazelor hepatice în analiza univariată. Ulterior, funcția hepatică anormală a fost strâns legată de sarcina tumorală a metastazelor hepatice, ajustând rolul acestor factori în analiza multivariată.
au existat multe studii privind factorii de prognostic în stabilirea BCLM. O analiză a 145 de pacienți cu BCLM a arătat că hipoalbuminemia, vârsta înaintată și negativitatea ER au fost predictori independenți ai supraviețuirii slabe (22). O analiză a registrului grec a obținut rezultate similare, în care pozitivitatea HR, gradul histologic scăzut, absența metastazelor extrahepatice și starea bună de performanță au fost factori prognostici semnificativi pentru prognosticul favorabil în analiza univariată (34). Un studiu populațional recent, care a inclus peste 4000 de pacienți cu BCLM de novo, a identificat factori demografici și socioeconomici, gradul patologic, numărul total de metastaze extrahepatice, tratamentul și subtipul molecular ca parametri care influențează semnificativ supraviețuirea globală (17). Regierer și colab. a dezvoltat un scor prognostic pentru MBC bazat pe starea HR, IFM și site-urile metastazelor pentru a prezice prognosticul lor și a individualiza tratamentul optim, care a fost validat intern și extern (5). Din păcate, statutul HER2 nu a fost inclus în scorul prognostic și, prin urmare, i-a limitat aplicabilitatea. GPA de sân modificat pentru pacienții cu BCBM care au integrat patru parametri clinici simpli a avut un rol imediat în prezicerea supraviețuirii lor, dar nu a fost aplicabil pentru pacienții cu BCLM (7). Din cunoștințele noastre, nu există un model prognostic care să integreze acești factori prognostici pentru pacienții cu BCLM, deci modelul nostru are sens pragmatic.
au existat, de asemenea, unele limitări în această cercetare. În primul rând, un studiu cu un singur centru și retrospectiv a dus inevitabil la părtinirea selecției, deși modelul nostru prognostic a fost validat intern și extern. În al doilea rând, pacienții care au dezvoltat metastaze hepatice mai târziu în cursul bolii au fost excluși, astfel încât nu am putut evalua acești pacienți. În al treilea rând, în acest studiu nu au fost disponibile informații detaliate privind starea de performanță și tratamentul.
concluzii
În ciuda acestor limitări, această cercetare poate oferi un model de prognostic simplu și fiabil. Avantajul major al studiului nostru este încorporarea parametrilor ușor accesibili în practica clinică pe baza eșantionului mare de pacienți cu BCLM. În afară de clasificarea rafinată a tumorilor în funcție de metodele de secvențiere de generație următoare, modelul nostru poate ajuta la identificarea subgrupurilor cu prognostic diferit și ghidarea terapiei ulterioare.
declarație de disponibilitate a datelor
contribuțiile originale prezentate în studiu sunt incluse în articol/Material suplimentar, întrebări suplimentare pot fi direcționate către autorul/autorii corespondenți.
declarație de etică
prezentul studiu a fost aprobat de comitetele independente de etică ale FUSCC. Pacienții / participanții și-au dat consimțământul scris în cunoștință de cauză pentru a participa la acest studiu.
contribuțiile autorului
LJ a propus studiul. XZ și YG au colectat datele. LJ și LF au analizat datele și au scris primul proiect. ZW a revizuit critic manuscrisul. Toți autorii au contribuit la articol și au aprobat versiunea trimisă.
Conflict de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
mulțumiri
recunoaștem Lei Cheng pentru efectuarea analizei datelor.
material suplimentar
abrevieri
BCLM, cancer de sân cu metastaze hepatice; FUSCC, Universitatea Fudan Shanghai Cancer Center; Roc, curba caracteristică de funcționare a receptorului; ifm, interval fără metastaze; HR, risc relativ; CI, interval de încredere; OS, supraviețuire generală; MBC, cancer de sân metastatic; BCBM, cancer de sân cu metastaze cerebrale; LM, metastaze hepatice; GPA, evaluare prognostică gradată; HB, hemoglobină; HR, receptor hormonal; HER2, receptorul factorului de creștere epidermică umană 2; CT, tomografie computerizată; RMN, imagistică prin rezonanță magnetică; ALT, alanin aminotransferază; AST, aspartat aminotransferază; ALP, fosfatază alcalină; LDH, lactat dehidrogenază; gar, raportul dintre glutamil-glutamil transferază și albumină; GGT, x-glutamil transferază; ALB, albumină; CTCAE, criterii terminologice comune pentru evenimente Adverse; LSVN, limita superioară a normalului.
4. Puente J, Lopez-Tarruella S, Ruiz A, Lluch a, Pastor m, Alba E și colab. Indicele practic de prognostic pentru pacienții cu cancer de sân recurent metastatic: analiza retrospectivă a 2.322 de pacienți din registrul geicam spaniol El Alamo. Cancerul De Sân Res Trata. (2010) 122:591–600. doi: 10.1007/s10549–009-0687–4
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Regierer AC, Wolters R, Ufen MP, Weigel A, Novopashenny I, Kohne CH, et al. An internally and externally validated prognostic score for metastatic breast cancer: analysis of 2269 patients. Ann Oncol. (2014) 25:633–8. doi: 10.1093/annonc/mdt539
PubMed Abstract | CrossRef Full Text
6. Marko NF, Xu Z, Gao T, Kattan MW, Weil RJ. Prezicerea supraviețuirii la femeile cu cancer de sân și metastaze cerebrale: o nomogramă depășește modelele actuale de predicție a supraviețuirii. Cancer. (2012) 118:3749–57. doi: 10.1002 / cncr.26716
PubMed Abstract | CrossRef Full Text/Google Scholar
7. Subbiah IM, Lei X, Weinberg JS, Sulman EP, Chavez-MacGregor M, Tripathy D, și colab. Validarea și dezvoltarea unei evaluări prognostice clasificate a sânului modificat ca instrument de supraviețuire la pacienții cu cancer de sân și metastaze cerebrale. J Clin Oncol. (2015) 33:2239–45. doi: 10.1200 / JCO.2014.58.8517
PubMed Abstract | CrossRef Full Text/Google Scholar
9. De asemenea, este important să se țină cont de faptul că, în cazul în care nu există nici un fel de probleme de sănătate, este necesar să se ia în considerare faptul că, în cazul în care nu există probleme de sănătate, este necesar să se ia în considerare. Prognosticul cancerului de sân metastatic: există diferențe între pacienții cu de novo și cancerul de sân metastatic recurent? Br J Cancer. (2015) 112:1445–51. doi: 10.1038/bjc.2015.127
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Duan XF, Dong NN, Zhang T, Li Q. The prognostic analysis of clinical breast cancer subtypes among patients with liver metastases from breast cancer. Int J Clin Oncol. (2013) 18:26–32. doi: 10.1007/s10147–011-0336-x
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dueck AC, Mendoza TR, Mitchell sa, Reeve BB, Castro KM, Rogak LJ și colab. Valabilitatea și fiabilitatea versiunii rezultatelor raportate de pacienți a Institutului Național al Cancerului din SUA a criteriilor comune de terminologie pentru evenimente Adverse (PRO-CTCAE). JAMA Oncol. (2015) 1:1051–9. doi: 10.1001 / jamaoncol.2015.2639
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Xie J, Xu Z. Un studiu bazat pe populație privind metastazele hepatice la femeile cu Cancer de sân nou diagnosticat. Cancer Epidemiol Biomarkeri Prev. (2019) 28:283–92. doi: 10.1158/1055–9965.EPI-18–0591
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dawood S, Broglio K, Ensor J, Hortobagyi GN, Giordano SH. Survival differences among women with de novo stage IV and relapsed breast cancer. Ann Oncol. (2010) 21:2169–74. doi: 10.1093/annonc/mdq220
PubMed Abstract | CrossRef Full Text
19. den Brok WD, Speers CH, Gondara L, Baxter E, Tyldesley SK, Lohrisch CA. Supraviețuirea cu cancer de sân metastatic pe baza prezentării inițiale, de novo versus recidivat. Cancerul De Sân Res Trata. (2017) 161:549–56. doi: 10.1007 / s10549–016-4080–9
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Fujiwara R, Haag M, Schaeffeler E, Nies AT, Zanger UM, Schwab M. reglarea sistemică a homeostaziei bilirubinei: beneficiile potențiale ale hiperbilirubinemiei. Hepatologie. (2018) 67:1609–19. doi: 10.1002/hep.29599
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Liu X, Meng QH, Ye Y, Hildebrandt MAT, Gu J, Wu X. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer. Carcinogenesis. (2015) 36:243–8. doi: 10.1093/carcin/bgu247
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Vander Heiden MG, Cantley LC, Thompson CB. Înțelegerea efectului Warburg: cerințele metabolice ale proliferării celulare. Știință. (2009) 324:1029–33. doi: 10.1126 / știință.1160809
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Mishra D, Banerjee D. lactat dehidrogenaze ca legături metabolice între tumoare și stroma în micromediul tumoral. Cancer. (2019) 11:750. doi: 10.3390/cancers11060750
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Pelizzari G, Basile D, Zago S, Lisanti C, Bartoletti M, Bortot L, et al. Lactate dehydrogenase (ldh) response to first-line treatment predicts survival in metastatic breast cancer: first clues for a cost-effective and dynamic biomarker. Cancers. (2019) 11:1243. doi: 10.3390/cancers11091243
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Hopkins AM, Rowland A, McKinnon RA, Sorich MJ. Predictors of long-term disease control and survival for HER2-positive advanced breast cancer patients treated with pertuzumab, trastuzumab, and docetaxel. Front Oncol. (2019) 9:789. doi: 10.3389/fonc.2019.00789
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Pentheroudakis G, Fountzilas G, Bafaloukos D, Koutsoukou V, Pectaside D, Skarlos D și colab. Cancer de sân Metastatic cu metastaze hepatice: o analiză de registru a caracteristicilor clinicopatologice, de management și de rezultat ale 500 de femei. Cancerul De Sân Res Trata. (2006) 97:237–44. doi: 10.1007 / s10549–005-9117–4
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply